





2021学年第二节 化学平衡教学ppt课件
展开人教版化学选修一
《影响化学平衡的因素》教学设计
课题名 | 化学平衡常数 |
教学目标 | 1.通过外界条件对可逆反应速率的影响,以变化观念与平衡思想掌握化学平衡移动的影响因素。 2.通过实验探究,讨论分析浓度、压强对化学平衡移动的影响,培养科学探究与创新意识。 3.通过实验探究温度对化学平衡的影响,提升科学探究与创新意识。 4.理解平衡移动原理(勒夏特列原理)形成变化观念与平衡思想,并能运用平衡移动原理解决平衡问题。 |
教学重点 | 1.掌握化学平衡移动的影响因素 2.理解平衡移动原理(勒夏特列原理)形成变化观念与平衡思想,并能运用平衡移动原理解决平衡问题。 |
教学难点 | 能运用平衡移动原理解决平衡问题 |
教学准备 | 教师准备:课件、例题 学生准备:复习化学平衡知识 |
教学过程 | 一.新课导入 回顾一下, 化学平衡状态有哪些特征? 逆——化学平衡状态研究的对象是可逆反应 等——达到化学平衡状态时,正反应速率和逆反应速率相等(v(正)=v(逆)≠0) 动——化学平衡是一种表面静止状态,反应并未停止,是一种动态平衡 定——达到化学平衡状态后,各组分浓度不再改变,不随时间变化而变化 变——外界条件改变时,原平衡状态将被打破,再在新条件下建立新的平衡状态
Q:当一个可逆反应达到化学平衡状态后,如果改变浓度、压强、温度等条件,化学平衡状态是否会发生变化?如何变化?
二.知识精讲 (一)化学平衡的移动 1.定义:当一个可逆反应达到平衡状态后,如果改变反应条件,平衡状态被破坏,平衡体系的物质组成也会随着改变,直至达到新的平衡。 2.本质:V正≠V逆 3.标志:各组分的百分含量发生改变 4.平衡移动与反应速率的关系 (1)v正>v逆,化学平衡向正反应方向移动 (2)v正<v逆,化学平衡向逆反应方向移动 (3)v正=v逆,化学平衡不发生移动 不同的外界条件改变,对化学平衡移动的影响分别是怎样的呢?
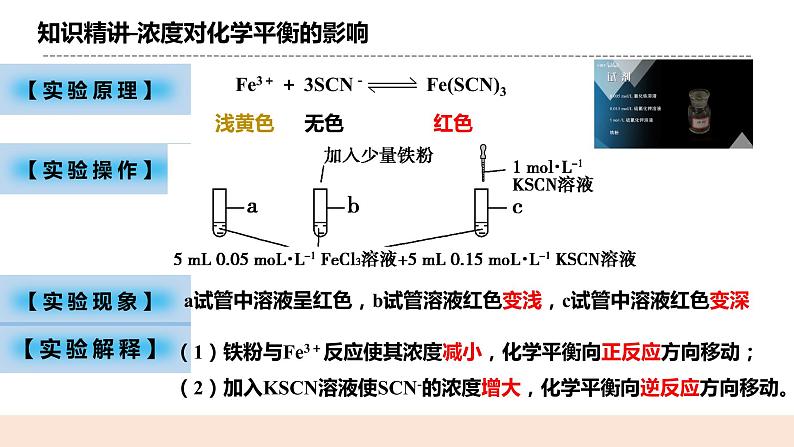
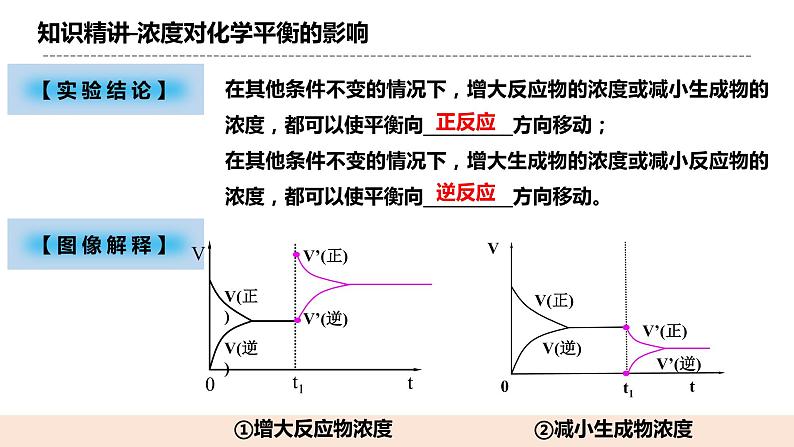
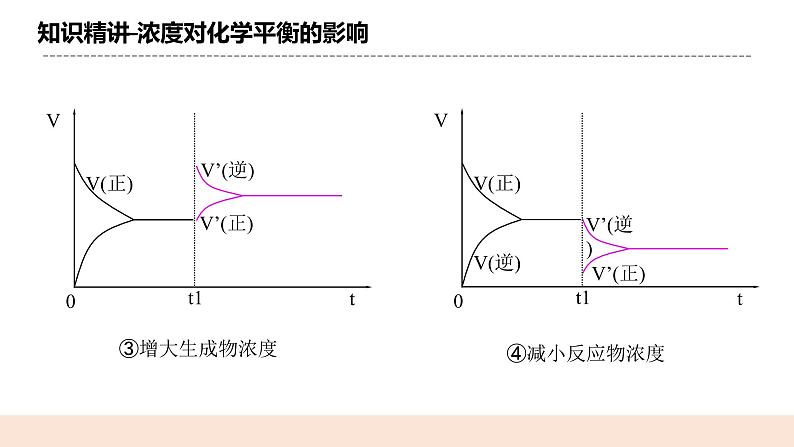
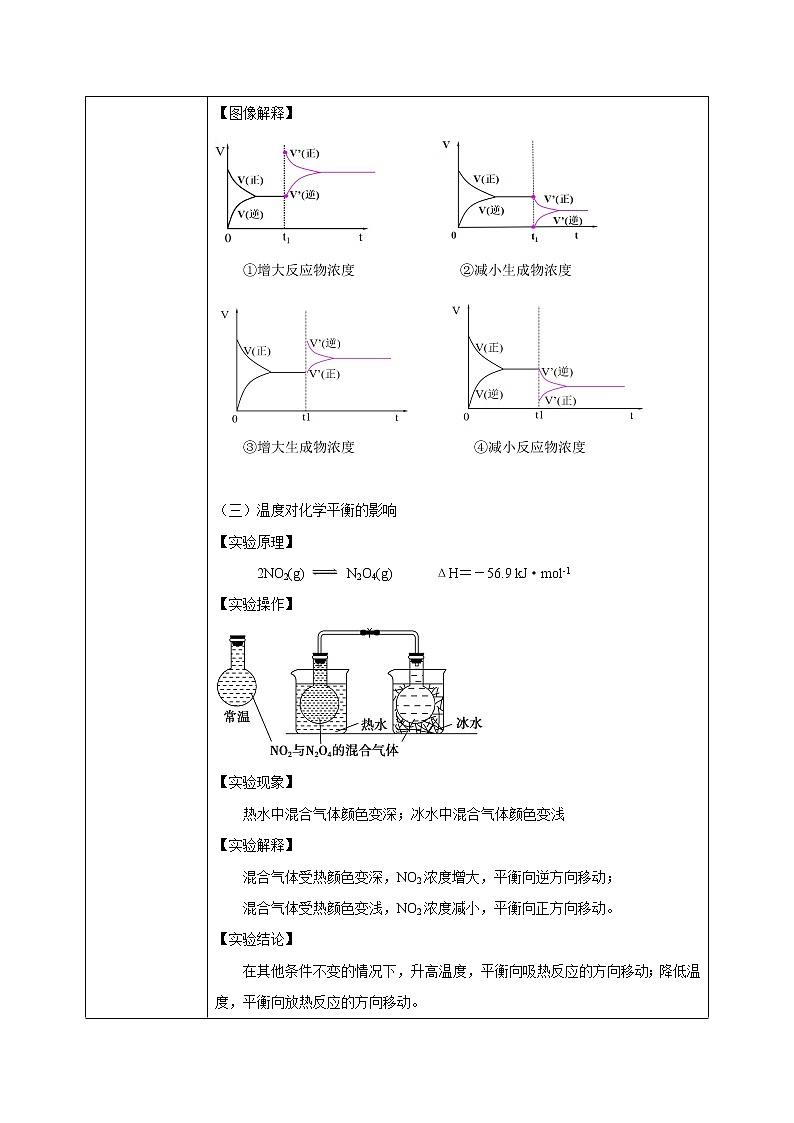
(二)浓度对化学平衡的影响 【实验原理】Fe3+ + 3SCN-Fe(SCN)3 【实验操作】 【实验现象】 a试管中溶液呈红色,b试管溶液红色变浅,c试管中溶液红色变深 【实验解释】 (1)铁粉与Fe3+反应使其浓度减小,化学平衡向正反应方向移动; (2)加入KSCN溶液使SCN-的浓度增大,化学平衡向逆反应方向移动。 【实验结论】 在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使平衡向_正反应_方向移动; 在其他条件不变的情况下,增大生成物的浓度或减小反应物的浓度,都可以使平衡向__逆反应_方向移动。 【图像解释】
①增大反应物浓度 ②减小生成物浓度
③增大生成物浓度 ④减小反应物浓度
(三)温度对化学平衡的影响 【实验原理】 2NO2(g) N2O4(g) ΔH=-56.9 kJ·mol-1 【实验操作】 【实验现象】 热水中混合气体颜色变深;冰水中混合气体颜色变浅 【实验解释】 混合气体受热颜色变深,NO2浓度增大,平衡向逆方向移动; 混合气体受热颜色变浅,NO2浓度减小,平衡向正方向移动。 【实验结论】 在其他条件不变的情况下,升高温度,平衡向吸热反应的方向移动;降低温度,平衡向放热反应的方向移动。 【图像解释】 (1)当 ΔH < 0 时,即正反应是放热反应: ① 升高温度 ② 降低温度 (2)当 ΔH >0 时,即正反应是吸热反应: ③ 升高温度 ④ 降低温度
(四)压强对化学平衡的影响 【实验原理】2NO2(g) N2O4(g) 【实验操作】 用50 mL注射器抽入20 mL NO2和N2O4混合气体,将细管端用橡胶塞封闭 (1)将针筒活塞迅速推至10 mL处(压强增大) (2)将针筒活塞从10mL处迅速拉至 40 mL处(压强减小) 【实验现象】 (1)气体颜色先变深,后变浅,最终比原来深 (2)气体颜色先变浅,后变深,最终比原来浅 【实验结论】 在其他条件不变的情况下,增大压强,平衡向气体物质的量减小的方向移动;减小压强,平衡向气体物质的量增大的方向移动。
【图像解释】对于反应mA(g) +nB (g) pC (g) +qD (g) 在可变容器中进行。 ⑴当 m + n > p + q时: ①增大压强 ②减小压强 ⑵当 m + n < p + q 时: ③增大压强 ④减小压强 Q:对于反应前后气体总体积不变的可逆反应达到平衡后只改变压强, 对化学平衡有无影响? H2(g) + I2(g) 2HI(g)
①增大压强 ②减小压强
(五)催化剂对化学平衡的影响 使用正催化剂,正、逆反应速率同时增大,且增大的倍数相同,化学平衡不移动。
(六)勒夏特列原理 勒夏特列原理: 如果改变影响平衡的一个条件(如温度、压强、浓度),平衡就向着能够减弱 这种改变的方向移动。 平衡移动的结果只能减弱(不可能抵消)外界条件的变化。
三.课堂小结
四.随堂练习 1.反应3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g),在一容积可变的密闭容器中进行,试回答: (1)增加Fe的量,其正反应速率_不变_(填“增大”“不变”或“减小”,下同),平衡__不_移动(填“不”“向正反应方向”或“向逆反应方向”,下同)。 (2)将容器的体积缩小一半,其正反应速率___增大__,平衡__不__移动。 (3)保持体积不变,充入N2使体系压强增大,其正反应速率_不变____,平衡__不_移动。 (4)保持体积不变,充入水蒸气,其正反应速率_增大 ,平衡_向正反应方向移动。
2.对于下列化学平衡在一定条件下发生移动的描述,不正确的是( C ) A.Cl2+H2OHCl+HClO,氯水中加入碳酸钙,漂白性增强 B.ZnS+Cu2+CuS+Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS) C.2NO2N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅 D.Cr2O(橙色)+H2O2CrO(黄色)+2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深 3.一定温度下,反应C(s)+H2O(g) CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是( A ) ①增加C的物质的量 ②保持容器容积不变,充入N2使体系压强增大 ③将容器的容积缩小一半 ④保持压强不变,充入N2使容器容积变大 A.①② B.②③ C.①④ D.③④
|
布置作业 | 化学课时作业《影响化学平衡的因素》 |
板书设计 | 影响化学平衡的因素 一.浓度 增大反应物浓度 正 减小反应物浓度 逆 减小生成物浓度 移 增大生成物浓度 移 二.温度 升温:向吸热反应方向移动 降温:向放热反应方向移动 三.压强 (1)反应前后气体分子总数改变 增大压强:向气体分子总数减小的方向移动 减小压强:向气体分子总数增大的方向移动 (2)反应前后气体分子总数不变 改变压强:平衡不移动 四.催化剂 平衡不移动 |
教学反思 | 本节课通过实验,理论与图形结合,注重学生的理解。教师在教学过程中应注意对学生的引导,帮助学生理解知识的本质。 |
高中化学人教版 (2019)选择性必修1第二节 化学平衡备课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡备课课件ppt,共28页。PPT课件主要包含了V正≠V逆,V正V逆≠0,条件改变,建立新平衡,破坏旧平衡,一定时间,化学平衡移动,实验2-1,硫氰化铁,正反应等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二节 化学平衡完美版课件ppt: 这是一份人教版 (2019)选择性必修1第二节 化学平衡完美版课件ppt,文件包含新人教版化学选择性必修一223影响化学平衡的因素课件pptx、新人教版化学选择性必修一223影响化学平衡的因素针对练习含解析docx、新人教版化学选择性必修一223影响化学平衡的因素教案doc等3份课件配套教学资源,其中PPT共54页, 欢迎下载使用。
化学人教版 (2019)第二章 化学反应速率与化学平衡第二节 化学平衡精品课件ppt: 这是一份化学人教版 (2019)第二章 化学反应速率与化学平衡第二节 化学平衡精品课件ppt,共29页。PPT课件主要包含了基础巩固,能力提升等内容,欢迎下载使用。














