





2023届高中化学一轮复习课件:弱电解质的电离平衡
展开高考评价要求1.从电离、离子反应、化学平衡的角度认识电解质水溶液的组成、性质和反应,如酸碱性、导电性等。2.认识弱电解质在水溶液中存在电离平衡,了解电离平衡常数的含义。3.能用化学用语正确表示水溶液中的离子反应与平衡,能通过实验证明水溶液中存在的离子平衡,能举例说明离子反应与平衡在生产、生活中的应用。
考点 弱电解质的电离平衡
1.电离平衡的概念在一定条件(如温度、压强等)下,当_________________________的速率和___________________的速率相等时,电离过程达到平衡状态。
弱电解质分子电离成离子
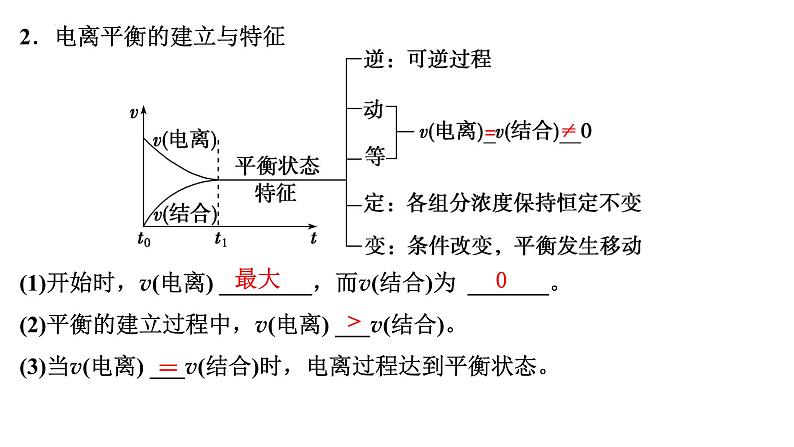
2.电离平衡的建立与特征
(1)开始时,v(电离) ________,而v(结合)为 _______。(2)平衡的建立过程中,v(电离) ___v(结合)。(3)当v(电离) ___v(结合)时,电离过程达到平衡状态。
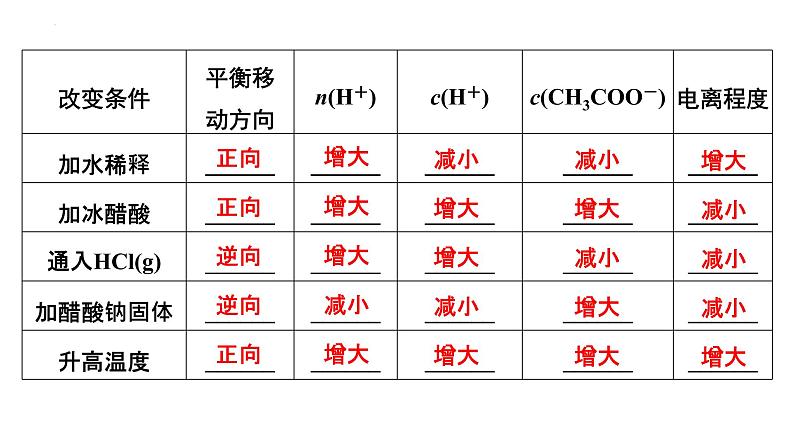
3.外界条件对电离平衡的影响(1)浓度:在一定温度下,同一弱电解质溶液,浓度越小,电离程度________。(2)温度:温度越高,电离程度________。(3)同离子效应:加入与弱电解质具有相同离子的电解质时,可使电离平衡向______________________的方向移动。
①稀醋酸加水稀释时,溶液中的各离子浓度并不是都减小,如c(OH-)是增大的。②电离平衡右移,电解质分子的浓度不一定减小,如向稀醋酸中加入冰醋酸。③电离平衡右移,离子的浓度不一定增大,电离程度也不一定增大。
题组一 外界条件对电离平衡移动的影响1.25 ℃时不断将水滴入0.1 ml·L-1的氨水中,下列图像变化合理的是( )
题组二 电离平衡与溶液导电性综合判断3. 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )A.a、b、c三点溶液的pH:c
表达式中离子浓度指达到平衡时溶液中存在的离子浓度,不一定是弱电解质自身电离的,可以对比水的离子积去掌握。
2.特点(1)电离平衡常数只与温度有关,升温,K值增大。(2)多元弱酸的各步电离常数的大小关系是Ka1>Ka2>Ka3>……当Ka1≫Ka2时,计算多元弱酸中的c(H+),或比较多元弱酸酸性的相对强弱时,通常只考虑第一步电离。多元弱碱的情况与多元弱酸类似。
4.应用(1)判断弱酸(弱碱)酸性(碱性)强弱。(2)判断盐溶液酸性(碱性)强弱。(3)判断反应能否发生或产物是否正确。
②意义电离度实质上是一种平衡转化率,表示弱电解质在水中的电离程度。弱电解质溶液的浓度不同,弱电解质的电离度就不同;溶液越稀,弱电解质的电离度就越大。
2.相同温度下,根据三种酸的电离常数,下列判断正确的是( ) A.三种酸的强弱关系:HX>HY>HZB.反应HZ+Y-===HY+Z-能够发生C.相同温度下,0.1 ml/L的NaX、NaY、NaZ溶液,NaZ溶液的pH最大D.相同温度下,1 ml/L HX溶液的电离常数大于0.1 ml/L HX溶液的电离常数
题组二 电离度及电离平衡常数的相关计算3.(2022·临汾高三模拟)现取20 mL c(H+)=1×10-3 ml·L-1的CH3COOH溶液,加入0.2 ml·L-1的氨水,测得溶液导电能力的变化如图所示,则加入氨水前CH3COOH的电离度为 ( )A.0.5% B.1.5% C.0.1% D.1%
4.(双选)已知室温时,0.1 ml·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )A.该溶液的pH=4B.升高温度,溶液的pH增大C.此酸的电离常数约为1×10-7D.由水电离出的c(H+)约为由HA电离出的c(H+)的 106倍
考点 强酸(碱)与弱酸(碱)的比较
1.一元强酸与一元弱酸的比较(1)相同物质的量浓度、相同体积的盐酸与醋酸的比较
(2)相同pH、相同体积的盐酸与醋酸的比较
2.一元强酸与一元弱酸的稀释图像比较(1)相同体积、相同浓度的盐酸、醋酸
(2)相同体积、相同pH的盐酸、醋酸
1.在下列性质中,可以证明CH3COOH是弱电解质的是( )A.1 ml/L的醋酸溶液中,c(H+)=1 ml/LB.CH3COOH与水以任意比互溶C.10 mL 1 ml/L的醋酸溶液恰好与10 mL 1 ml/L的NaOH溶液完全反应D.在相同条件下,醋酸溶液的导电性比盐酸弱
2.在两个密闭的锥形瓶中,0.05 g形状相同的镁条(过量)分别与2 mL 2 ml·L-1的盐酸和醋酸溶液反应,测得容器内压强随时间的变化曲线如图。下列说法正确的是( )A.①代表的是盐酸与镁条反应时容器内压强随时间的变化曲线B.任意相同时间段内,盐酸与Mg反应的化学反应速率均快于醋酸溶液与Mg反应的化学反应速率C.反应中醋酸的电离被促进,两种溶液最终产生的氢气总量基本相等D.1 ml·L-1NaOH溶液完全中和上述两种酸溶液,盐酸消耗NaOH溶液的体积更大
1.(2021·浙江6月选考)某同学拟用pH计测定溶液pH以探究某酸HR是否为弱电解质。下列说法正确的是( )A.25 ℃时,若测得0.01 ml·L-1 NaR溶液pH=7,则HR是弱酸B.25 ℃时,若测得0.01 ml·L-1HR溶液pH>2且pH<7,则HR是弱酸C.25 ℃时,若测得HR溶液pH=a,取该溶液10.0 mL,加蒸馏水稀释至100.0 mL,测得pH=b,b-a<1,则HR是弱酸D.25 ℃时,若测得NaR溶液pH=a,取该溶液10.0 mL,升温至50 ℃,测得pH=b,a>b,则HR是弱酸
2023届高三化学一轮复习 弱电解质的电离平衡 课件: 这是一份2023届高三化学一轮复习 弱电解质的电离平衡 课件,共25页。PPT课件主要包含了cOH-增大,Ka和Kb的应用,4加水稀释,步步高P171T3,步步高P171T4,步步高P173T4,NH3·H2O,NH4+,步步高P171T7,H2C2O4等内容,欢迎下载使用。
人教版高考化学一轮复习8.1弱电解质的电离平衡课件: 这是一份人教版高考化学一轮复习8.1弱电解质的电离平衡课件
化学选择性必修1第一单元 弱电解质的电离平衡课前预习ppt课件: 这是一份化学选择性必修1第一单元 弱电解质的电离平衡课前预习ppt课件,共12页。PPT课件主要包含了学习目标,交流讨论,电离平衡有哪些特征,课堂探究,课堂小结,课堂巩固,课堂练习等内容,欢迎下载使用。












