




- 鲁科版高中化学选择性必修第一册第1章化学反应与能量转化章末总结课件 课件 2 次下载
- 鲁科版高中化学选择性必修第一册第2章化学反应的方向限度与速率第1节化学反应的方向课件 课件 2 次下载
- 鲁科版高中化学选择性必修第一册第2章化学反应的方向限度与速率第2节化学反应的限度课时2反应条件对化学平衡的影响课件 课件 1 次下载
- 鲁科版高中化学选择性必修第一册第2章化学反应的方向限度与速率第3节化学反应的速率课时1化学反应是有历程的化学反应速率课件 课件 1 次下载
- 鲁科版高中化学选择性必修第一册第2章化学反应的方向限度与速率第3节化学反应的速率课时2外界条件对化学反应速率的影响课件 课件 1 次下载
鲁科版 (2019)选择性必修1第2节 化学反应的限度背景图ppt课件
展开知识点一 化学平衡常数
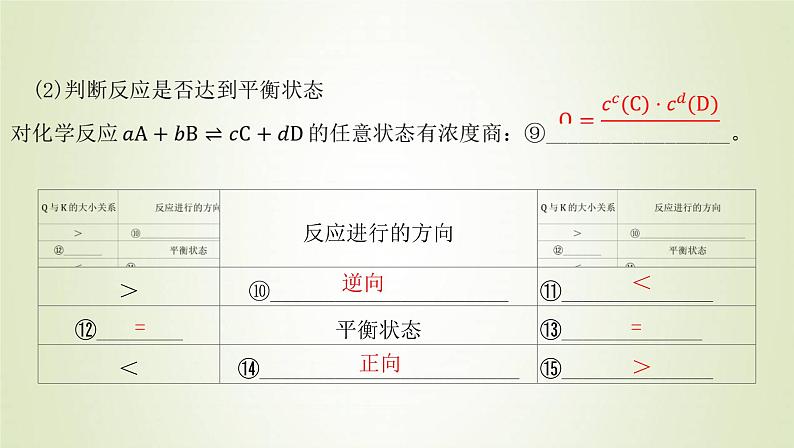
b.注意事项平衡常数表达式与化学方程式的③_____________________有关。同一反应,④_______________________不同,平衡常数的表达式不同。对于给定的化学反应,正、逆反应的平衡常数⑤_____________________。(2)意义平衡常数的大小反映化学反应可能进行的⑥_________________;平衡常数的数值越大,说明反应可以进行得越⑦_________________。(3)反应条件对化学平衡的影响
只与反应体系的⑧_________________有关,与反应物的浓度、压强无关。
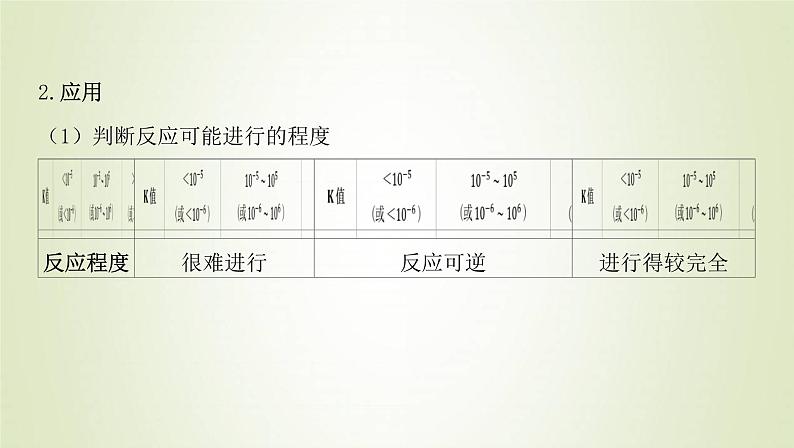
2.应用(1)判断反应可能进行的程度
(1) 该反应的平衡常数表达式如何书写?
1. 所有参加反应的物质都出现在平衡常数表达式中( )
2. 平衡常数只是温度的函数,随温度的改变而改变( )
1. 平衡转化率是该物质在此条件下的最大转化率( )
2. 化学反应达平衡后,增大某反应物的量,则该反应物的转化率增大( )
探究点一 化学平衡状态的判断
1.化学平衡的判断依据,即化学平衡的两个主要特征
①各组分的百分含量保持不变(各物质的物质的量分数一定、各物质的质量分数一定、各气体的体积分数一定);②各组分的物质的量不随时间的改变而改变;③各气体的体积不随时间的改变而改变。
(3)特例判断法(反应在恒容密闭容器中进行)
④断裂氢氧键的速率为断裂氢氢键速率的2倍⑤混合气体的密度保持不变A. ①②B. ③④C. ①D. ④
[解析] 甲容器中的可逆反应属于反应前后气体分子数不相等的反应;乙容器中的可逆反应属于反应前后气体分子数相等的反应,故乙容器中混合气体的平均相对分子质量、密度、压强都始终保持不变,①②⑤错误;容器中各气体的浓度相等,不能判断反应是否达到了平衡状态,③错误;断裂氢氧键的速率为断裂氢氢键速率的2倍,即氢氧键的断裂速率等于形成氢氧键的速率,④正确。
解题感悟 利用“变量”不变来判断化学平衡状态
探究点二 化学平衡常数与平衡转化率的有关计算
1.化学平衡常数的计算(1)可逆反应达到平衡后各物质浓度的变化关系①反应物:平衡浓度=起始浓度-转化浓度。②生成物:平衡浓度=起始浓度+转化浓度。③各物质的转化浓度之比等于它们在化学方程式中相应的化学计量数之比。
2.平衡转化率的计算(1)转化率的三种计算公式
(1) 该温度下反应的平衡常数为______________________。
解题感悟1.化学平衡常数计算思路
已达到平衡状态B. 未达到平衡状态,反应正向进行C. 未达到平衡状态,反应逆向进行D. 无法确定
(2) 在相同条件下,为增大反应物的转化率,该反应应在_________(填“高温”或“低温”)条件下进行。
[解析] 题给反应为反应前后气体分子数改变的反应,恒容条件下,该可逆反应在建立平衡的过程中会有压强的改变、气体总分子数的改变、颜色的改变,一旦这些可变量不变了,则证明反应达到平衡了,而混合气体的总质量始终不发生变化。
(1) 此反应的平衡常数为______。
方法技巧 有关化学平衡的计算模式及解题思路
鲁科版 (2019)选择性必修1第2节 化学反应的限度课文内容课件ppt: 这是一份鲁科版 (2019)选择性必修1第2节 化学反应的限度课文内容课件ppt,共46页。PPT课件主要包含了学业基础,核心素养,当堂评价,生成物,反应物,K105,影响因素,很难进行,反应可逆,进行完全等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第1节 化学反应的方向课文内容课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第1节 化学反应的方向课文内容课件ppt,共60页。PPT课件主要包含了目录索引,必备知识,自我检测等内容,欢迎下载使用。
鲁科版 (2019)选择性必修1第1节 化学反应的方向作业课件ppt: 这是一份鲁科版 (2019)选择性必修1第1节 化学反应的方向作业课件ppt,共27页。PPT课件主要包含了c平CO2,Mpa等内容,欢迎下载使用。













