

所属成套资源:高二下学期期中考试化学试卷含答案
2021-2022学年福建省莆田第一中学高二下学期期中考试化学试题含答案
展开
这是一份2021-2022学年福建省莆田第一中学高二下学期期中考试化学试题含答案,共12页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
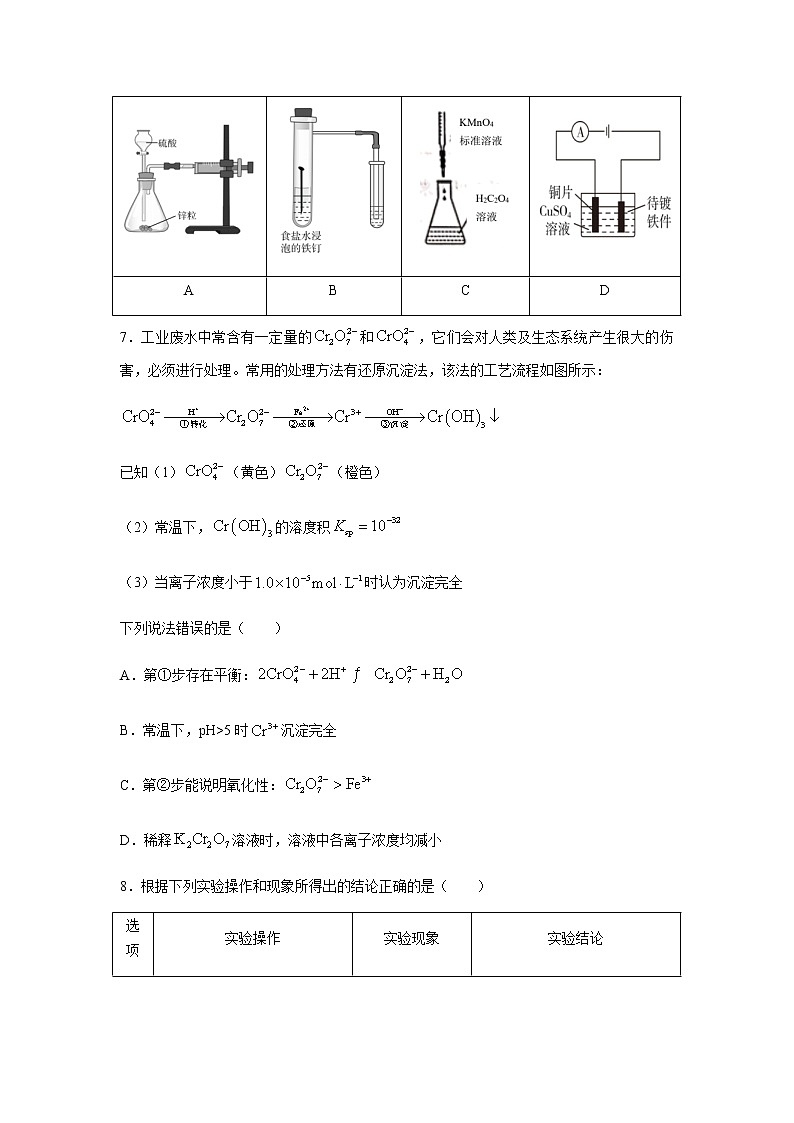
莆田一中2021-2022学年度下学期期中考试试卷高二化学试卷第Ⅰ卷(共40分)一、选择题(单项选择,每小题4分,共40分)1.2021年12月9日,神舟十三号乘组航天员翟志刚、王亚平、叶光富在中国空间站进行太空授课。王亚平利用泡腾片演示了微重力环境下液体表面张力的实验。某维C泡腾片具有抗氧化、防衰老的功效,含有维生素C、柠檬酸、碳酸氢钠、乳糖、山梨糖醇等,遇水有大量气体生成。下列属于强电解质的是( )A.柠檬酸 B.碳酸氢钠 C.乳糖 D.山梨糖醇2.化学与生产、生活密切相关。下列说法错误的是( )A.电解NaCl饱和溶液,可制得金属钠B.“一次性保暖贴”在发热过程中应用的是原电池原理C.明矾水解形成的胶体能吸附水中的悬浮物,可用于水的净化D.热的碳酸钠溶液可用于去除餐具的油污3.《Science》杂志报道了王浩天教授团队发明的制取的绿色方法,原理如图所示。下列说法正确的是( )A.a极为正极,发生还原反应B.X膜为阳离子交换膜C.当外电路通过2mol时,消耗22.4LD.该装置可实现化学能与电能间的完全转化4.下列离子方程式书写不正确的是( )A.用硫化钠溶液除去废水中的:B.用饱和溶液处理锅炉水垢中的:C.酚酞滴入醋酸钠溶液中变为浅红色:D.和灭火器产生泡沫:5.设为阿伏加德罗常数的值,下列说法正确的是( )A.25℃时,1LpH=10的溶液中,水电离出的的数目为B.2.24L溶于水制成饱和氯水,转移电子数目为C.在1L0.2mol/L的溶液中,所含数目为D.粗铜精炼时,每生成0.25molCu,此时转移的电子数为6.用下列仪器或装置(图中夹持装置略)进行相应实验,能达到实验目的的是:( )测定锌与稀硫酸反应速率(计时器未画出)探究铁钉发生析氢腐蚀测定溶液的浓度在铁制镀件上镀铜ABCD7.工业废水中常含有一定量的和,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程如图所示:已知(1)(黄色)(橙色)(2)常温下,的溶度积(3)当离子浓度小于时认为沉淀完全下列说法错误的是( )A.第①步存在平衡:B.常温下,pH>5时沉淀完全C.第②步能说明氧化性:D.稀释溶液时,溶液中各离子浓度均减小8.根据下列实验操作和现象所得出的结论正确的是( )选项实验操作实验现象实验结论A向含有酚酞的溶液中加入少量固体有白色沉淀生成,溶液红色变浅证明存在水解平衡B室温下,用pH试纸测定浓度均为的NaCN溶液、溶液的pHNaCN溶液的pH较大酸性:C向浓度均为NaCl和NaI混合溶液中滴加2-3滴溶液产生黄色沉淀溶度积:D用盐酸滴定未知浓度NaOH溶液(甲基橙做指示剂)滴入最后一滴盐酸时,溶液由橙色变红色,且在半分钟内不恢复滴定到达终点9.工业上可通过甲醇羰基化法制取甲酸甲酯():,在容积固定的密闭容器中,投入等物质的量和CO,测得相同时间内CO的转化率随温度变化如下图所示。下列说法不正确的是( )A.增大压强甲醇转化率增大B.b点反应速率C.平衡常数,反应速率D.生产时反应温度控制在80~85℃为宜10.分析化学中“滴定分数”的定义为:所加滴定剂与被滴定组分的物质的量之比。常温下以的HCl溶液滴定同浓度某一元碱MOH溶液并绘制滴定曲线如下图所示。下列说法不正确的是( )A.该酸碱中和滴定过程应该选用甲基橙做指示剂B.x点处的溶液中满足:C.根据y点坐标可以算得D.从x点到z点,溶液中水的电离程度逐渐增大第Ⅱ卷(共60分)二、非选择题(共60分)11.(18分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,请回答下列问题:(1)用催化还原可以消除氮氧化物的污染,例如: 写出1mol还原生成、和气态水的热化学方程式______(2)合成氨工业在国民生产中有重要意义。在容积为2L的恒温密闭容器中加入0.1mol的和0.3mol的在一定条件下发生反应: ,在5min时反应恰好达到平衡,此时测得的物质的量为0.1mol。①这段时间内用表示的反应速率为______②平衡后,若要再提高反应速率,且增大的产率,可以采取的措施有______。(答一条即可)③下列各项能作为判断该反应达到化学平衡状态的依据是______(填序号字母)。A.容器内、、的物质的量浓度之比为1:3:2B.C.混合气体的密度保持不变D.容器内压强保持不变(3)已知合成氨反应在400℃时的平衡常数。在400℃时,测得某时刻、、,此时刻该反应的______(填“>”“=”或“<”)。(4)如图表示合成氨在恒压密闭容器中,不同温度下,达到平衡时的体积百分数与投料比[]的关系。由此判断、、的大小关系为:______。12.(15分)某食用白醋是由醋酸与纯水配制而成,用中和滴定的方法准确测定其中醋酸的物质的量浓度。实验步骤:①配制500mL浓度约为的NaOH溶液;②用标准溶液准确测定该NaOH溶液的浓度;③用已知准确浓度的NaOH溶液测定醋酸的浓度。(1)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解。该配制步骤______(填“可行”或“不可行”)。(2)称量时NaOH在空气中极易吸水,配制所得的NaOH溶液浓度通常比预期______(填“小”或“大”),这是不能直接配制其标准溶液的原因。(3)查阅白醋包装说明,醋酸含量约为6g/100mL,换算成物质的量浓度约为______,滴定前将白醋稀释______(填“10”或“100”)倍。(已知醋酸的相对分子质量为60)(4)准确量取稀释后的白醋20.00mL,置于250mL锥形瓶中,加水30mL,再滴加酚酞指示剂,用上述NaOH标准溶液滴定至______即为终点。重复滴定两次,平均消耗NaOH标准溶液VmL(NaOH溶液浓度为)。(5)误差分析:下列操作会导致测定结果偏高的是_______。A.未用NaOH标准溶液润洗滴定管B.滴定前锥形瓶内有少量水C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失D.观察读数时,滴定前仰视,滴定后俯视(6)原白醋中醋酸的物质的量浓度=______。13.(15分)、NO是大气污染物。吸收和NO,获得和产品的流程图如下(Ce为铈元素):(1)含硫各微粒(、和)存在于与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如下图所示。①下列说法正确的是______(填字母序号)。a.pH=8时,溶液中b.pH=7时,溶液中c.为获得尽可能纯的,可将溶液的pH控制在4~5左右②已知溶液显酸性,用化学平衡原理解释并写出相应的离子反应方程式:______。(2)装置Ⅱ中,酸性条件下,NO被氧化的产物主要是、,写出生成的离子方程式______。(3)装置Ⅲ的作用之一是再生,其原理如图所示。①生成的电极反应式为______。②生成从电解槽的______(填字母序号)口流出。14.(12分)氧化锌在半导体领域的液晶显示器、薄膜晶体管、发光二极管等产品中应用广泛。实验室利用清洗过的废电池铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如下:已知:锌灰的主要成分为Zn、ZnO,含有铁及其氧化物杂质;ZnO、均为两性化合物。(1)实验室用质量分数30%的双氧水配制约15%的双氧水通常使用的玻璃仪器有量筒、烧杯、_______(填名称)。(2)写出第Ⅰ步中Cu参加反应的离子方程式:______。(3)若溶液C中、,常温下,有关离子沉淀的pH如下表所示(当离子浓度为时认为沉淀完全): 开始沉淀的pH2.37.36.2沉淀完全的pHa 8.37①上表中的a=_______。②溶液C中加入过氧化氢溶液的目的是______。③查阅资料发现,沉淀的pH不能大于11,其原因是_______。(4)第Ⅴ步中“系列操作”指的是过滤、洗涤和煅烧,检验沉淀洗涤干净的方法是_______(写出实验操作、现象和结论)。 答案1-5:BABBA 6-10:ADABD11.(每空3分,18分) (2)①0.015 ②加压;通入氮气或氢气 ③BD(3)<;(4)12.(1~5每空2分,共15分)(1)可行(2)小(3)1 10(4)溶液变成浅红色且30秒内不褪色(5)AC(6)(3分)13.(共15分)(1)①a、c(2分)② 在溶液中存在:和,的电离程度强于水解程度(4分)(2)(3分)(3)①(3分) ②a(3分)14.(每空2分,共12分)(1)玻璃棒(2)(3)①3.3 ②将溶液中的亚铁离子氧化为铁离子③碱性太强时,溶解转化为,从而降低ZnO的产率(4)取少量最后一次的洗涤液于试管中,向其中先滴加盐酸,再滴加氯化钡溶液,若无白色沉淀生成,则表明沉淀已洗涤干净
相关试卷
这是一份福建省莆田锦江中学2023-2024学年高二上学期期中考试化学试题(含答案),文件包含福建省莆田锦江中学2023-2024学年高二上学期期中考试化学试题docx、福建省莆田锦江中学2023-2024学年高二上学期期中考试化学试题答案docx等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
这是一份2022-2023学年福建省莆田第一中学高二下学期第二学段(期中)考试化学试题含答案,共9页。
这是一份2021-2022学年福建省莆田第一中学高二上学期期末考试化学试题含答案









