






人教版 (2019)选择性必修1第三节 金属的腐蚀与防护备课ppt课件
展开1.能说出金属腐蚀的危害,能用电化学原理解释金属腐蚀现象。2.能选择并设计防止金属腐蚀的措施。
一、金属的腐蚀1.金属的腐蚀是金属或合金与周围的气体或液体发生氧化还原反应而引起损耗的现象。2.金属腐蚀的实质是金属原子失去电子变为金属阳离子,金属发生氧化反应。
3.金属腐蚀的类型。(1)化学腐蚀与电化学腐蚀。
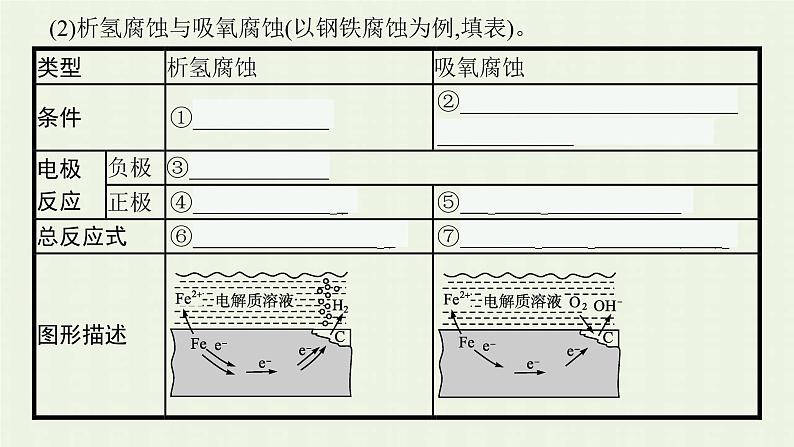
(2)析氢腐蚀与吸氧腐蚀(以钢铁腐蚀为例,填表)。
二、金属的防护1.改变金属材料的组成,如在普通钢中加入铬、镍等制成不锈钢产品,以增强钢铁的抗腐蚀性能。2.在钢铁制品的表面喷涂油漆、矿物性油脂或覆盖搪瓷、塑料等;用电镀等方法在钢铁表面镀上一层锌、锡、铬、镍等金属;用化学方法在钢铁部件表面进行发蓝处理(生成一层致密的四氧化三铁薄膜);利用阳极氧化处理铝制品的表面,使之形成致密的氧化膜而钝化等。另外,采用离子注入、表面渗镀等方式在金属表面也可以形成稳定的钝化膜等。
3.电化学保护法。(1)牺牲阳极法。如图1,应用原电池原理,让活动性比铁强的金属锌作负极,钢铁设备作正极而被保护。(2)外加电流法。如图2,应用电解原理,把被保护的钢铁设备作为阴极,用惰性电极作为辅助阳极,在电解质溶液里,接外加直流电源。
【自主思考】 镀锌铁和镀锡铁的镀层破损后,是否失去对铁的防护能力? 提示:镀锌铁的镀层破损后,在潮湿的空气里,镀层锌作负极,对铁仍具有防护能力(牺牲阳极法);镀锡铁的镀层破损后,在潮湿的空气里,镀层锡作正极,会加速铁的腐蚀。
【效果自测】 1.判断正误,正确的画“√”,错误的画“×”。(1)Al、Fe、Cu在潮湿的空气中被腐蚀均生成氧化物。( )(2)钢铁发生电化学腐蚀时,负极铁失去电子生成Fe3+。( )(3)有些金属表面覆盖的保护层破损后,保护层对金属继续有保护作用。( )(4)在海轮外壳上附着一些锌块或铝块,都可以减缓海轮外壳的腐蚀。( )(5)铁皮表面镀上一层锌可增强铁皮的抗腐蚀性。( )
2.(1)A、B两装置长时间露置于空气中,A发生 腐蚀,B发生 腐蚀。(2)利用如图装置,可以模拟钢铁的电化学保护法。为减缓铁的腐蚀,若开关K置于N处,则X应为石墨棒或Pt等惰性电极,该电化学保护法为 ;若开关K置于M处,则X应为 ,该电化学保护法称为 。 答案:(1)析氢 吸氧(2)外加电流法 Zn等比铁活泼的金属 牺牲阳极法
金属腐蚀的现象普遍存在,金属腐蚀后造成的危害也是巨大的。采取有效措施防止金属腐蚀具有重要意义。1.金属腐蚀的快慢与哪些因素有关?提示:金属本身的性质、金属的纯度、与金属接触的物质的性质、温度等。2.电化学防护的实质是什么?提示:电化学防护的实质是把被保护的金属作原电池的正极或电解池的阴极,不参与电极反应,从而不被氧化。
1.金属腐蚀快慢的一般规律(1)电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。有防护措施的腐蚀发生的可能性很小或几乎不发生,包括原电池原理的防护(牺牲阳极法)和电解原理的防护(外加电流法)。(2)对同一种金属而言,在相同浓度的溶液中腐蚀的快慢:强电解质溶液>弱电解质溶液>非电解质溶液。(3)活动性不同的两种金属,活动性差别越大,活动性强的金属腐蚀越快。(4)对同一种电解质溶液而言,电解质溶液浓度越大,金属腐蚀越快。
(5)温度升高,对化学腐蚀的速率影响很大;升高温度,电解质溶液中的离子运动速率增大,溶液的导电性增强,因此温度对电化学腐蚀的速率也有一定的影响。2.应用(1)实验室里,利用原电池反应,增大制取氢气的反应速率。在用锌与稀硫酸制取氢气时,常常向稀硫酸中滴入几滴硫酸铜溶液,锌置换出铜,铜、锌在稀硫酸中相接触,形成原电池,从而加速锌的腐蚀。(2)利用电解原理提纯金属。工业上电解精炼铜就是利用电解原理加速铜以及杂质锌、铁、镍等活泼金属杂质的腐蚀。(3)采用原电池原理的牺牲阳极法和采用电解原理的外加电流法,则是减慢金属腐蚀的重要措施。
思考牺牲阳极法和外加电流法都是采用辅助阳极,将被保护的金属作为阴极。两种方法中,对于用作辅助阳极的金属的化学性质有何要求?提示:牺牲阳极法中,用作辅助阳极的金属要比被保护的金属化学性质活泼;外加电流法中,用作辅助阳极的金属必须是惰性金属,如Pt。
【例题】 如图,各烧杯中盛有相同浓度的NaCl溶液,纯铁在其中被腐蚀由慢到快的顺序为( )。A.②①③④B.④③①②C.④②①③D.③①②④答案:D解析:②③④实质均为原电池装置。③中Fe为正极被保护;②④中Fe为负极,均被腐蚀,但相对来说,Fe与Cu的金属活动性的差别比Fe与Sn的大,故④中Fe被腐蚀得快;①中纯铁发生化学腐蚀。
方法技巧 解决此类题目,首先判断出金属腐蚀是化学腐蚀还是电化学腐蚀;对于电化学腐蚀,根据金属活动性判断出正、负极,一般活动性强的金属为负极被腐蚀,活动性弱的金属为正极被保护。对于活动性不同的两金属,活动性差别越大,活泼金属被腐蚀得越快;纯度越高的金属,腐蚀得越慢。
【变式训练】 铁生锈是一种常见的自然现象,其变化过程可用化学方程式4Fe+3O2+xH2O══2Fe2O3·xH2O表示。如图为一放在水槽中的铁架,水位高度如图。最容易生锈的铁架横杆是( )。A.①B.②C.③D.④答案:C解析:④处没有与水接触,锈蚀较慢;①②③处均与水接触,但①②处水中溶解的O2浓度较小,锈蚀较慢;③处水中溶解的O2浓度较大,腐蚀最快。
人教版 (2019)选择性必修1第三节 金属的腐蚀与防护教课内容课件ppt: 这是一份人教版 (2019)选择性必修1第三节 金属的腐蚀与防护教课内容课件ppt,共42页。PPT课件主要包含了探究一金属的腐蚀,情境探究,方法突破,应用体验,探究二金属的防护等内容,欢迎下载使用。
化学选择性必修1第三节 金属的腐蚀与防护作业课件ppt: 这是一份化学选择性必修1第三节 金属的腐蚀与防护作业课件ppt,共26页。PPT课件主要包含了A级必备知识基础练,B级关键能力提升练,C级学科素养创新练等内容,欢迎下载使用。
化学选择性必修1第三节 金属的腐蚀与防护评课ppt课件: 这是一份化学选择性必修1第三节 金属的腐蚀与防护评课ppt课件,共40页。PPT课件主要包含了目录索引,探究一金属的腐蚀,探究二金属的防护等内容,欢迎下载使用。













