






所属成套资源:全套新人教版高中化学选择性必修2教学PPT课件
新人教版高中化学选择性必修2第一章原子结构与性质本章整合课件
展开
这是一份新人教版高中化学选择性必修2第一章原子结构与性质本章整合课件,共29页。
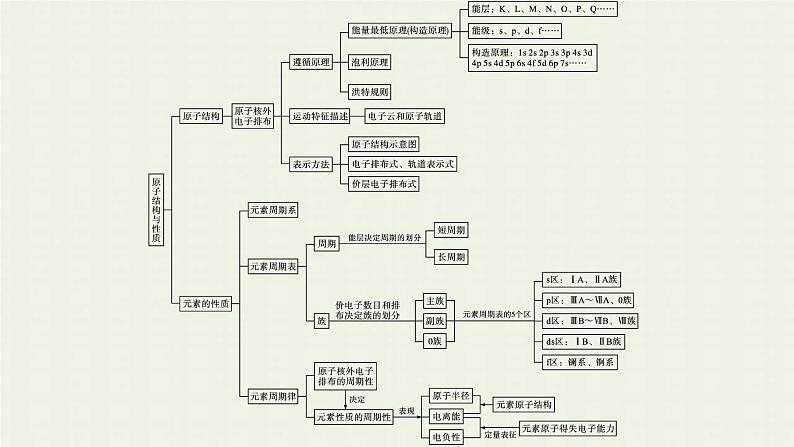
第一章内容索引知识网络·系统构建专题归纳·素养整合知识网络·系统构建专题归纳·素养整合A.能量最低原理 B.泡利原理 C.洪特规则 (4)第三周期元素的第一电离能(用I1表示)如图所示: ①根据图中提供的信息,可推断同周期内,随着原子序数的增大,I1值变化的总趋势是 ; ②根据图中提供的信息,可推断出I1(氧) (填“>”“O2->Na+ H2O(4)共价键、离子键解析:原子核外L层电子数是K层的2倍,则A为碳元素;臭氧层是地球生物的“保护伞”,则B为氧元素;同一周期从左到右,元素的第一电离能呈增大趋势,则C为钠元素;根据D的基态原子的最外层电子排布式可知n=2,则D为硫元素;根据题给信息可形成多种氧化物,其中一种为具有磁性的黑色晶体,可推知E为铁元素。B、C的单质按物质的量之比为1∶2形成的化合物为Na2O2,既含共价键,又含离子键。1.元素周期律 2.元素周期表中的隐含规律(1)相等规律。①周期序数=能层数。②主族元素的最外层电子数=价层电子数=主族序数=最高正化合价(O、F除外)。③主族非金属元素最低负价绝对值=8-族序数(H除外)。(2)序差规律。同主族相邻元素的原子序数差与主族序数有关,ⅠA~ⅡA族(s区)上下相邻元素的原子序数之差等于上面元素所在周期包含的元素种数,ⅢA~0族(p区)上下相邻元素的原子序数之差等于下面元素所在周期包含的元素种数,如Na和K的原子序数相差8(第三周期含8种元素),Cl和Br的原子序数相差18(第四周期含18种元素)。ⅠA~ⅡA族元素在过渡元素之前,ⅢA~0族元素在过渡元素之后,故该规律可简称为“前差上,后差下”。3.主族元素的周期性变化规律 【例题3】 下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。请回答下列问题(除特别说明外,凡涉及用元素回答的问题均用具体元素符号表示):(1)R原子的轨道表示式为 。 (2)在化合物YZ2中Y的化合价为 ;Y2-与Na+的半径大小为 。(3)在X、Y、Z三种元素中,电负性由大到小的顺序是 ;X与Y的第一电离能:X (填“”或“=”)Y,其理由是 。(4)在表中6种元素形成的双原子分子中,最稳定单质的电子式为 ;有一种酸HX3的酸性与醋酸相近,HX3溶液与NaOH溶液反应的离子方程式为 。





