






所属成套资源:《2023年高考化学一轮复习讲练测》
第7讲 铁及其重要化合物
展开
这是一份第7讲 铁及其重要化合物,共60页。PPT课件主要包含了考点一,考点二,考点三,Fe2O3,Fe3O4,FeCO3,FeS2,磁性氧化铁,红棕色,白色固体等内容,欢迎下载使用。
第7讲 铁及其重要化合物
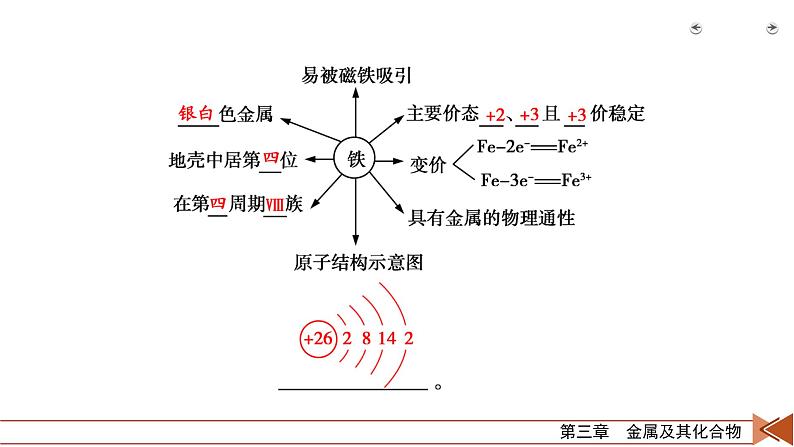
1.铁单质(1)铁的位置、结构、化合价铁元素是重要的金属元素,在地壳中的含量仅次于氧、硅、铝。
考点一 铁的单质、氧化物及氢氧化物
(2)铁的物理性质纯铁具有金属的共性,如具有________色金属光泽和良好的延展性,是电和热的良导体,具有能被________吸引的特性,铁在地壳中含量占第4位。
Fe2O3·xH2O
②与水的反应常温下铁与水不反应,在高温条件下与水蒸气反应的化学方程式为:______________________________。
Fe+2H+═══Fe2++H2↑
3Fe2++2NO↑+4H2O
Fe3++NO↑+2H2O
④与某些盐溶液的反应(离子方程式)与CuSO4溶液:____________________________。与FeCl3溶液:__________________________。
Fe+Cu2+═══Fe2++Cu
Fe+2Fe3+═══3Fe2+
(4)铁单质的制备方法①工业上利用铁矿石在高炉中炼铁,以赤铁矿为例写出该反应的化学方程式_____________________________。②利用铝热反应焊接无缝钢轨,写出以氧化铁和铝粉为铝热剂反应的化学方程式__________________________。(5)重要的铁矿石主要成分的化学式赤铁矿_________;磁铁矿_________;褐铁矿________________;菱铁矿_________;黄铁矿________。
2Fe2O3·3H2O
(1)铁遇冷的浓硫酸或浓硝酸,表面会形成一层致密的氧化膜而发生钝化。铝遇冷的浓硝酸或浓硫酸也会发生钝化。钝化可阻止内部金属继续与浓酸发生反应,从而表现出较强的化学稳定性和耐腐蚀性。(2)Fe与Cl2反应生成FeCl3而不是FeCl2;Fe与S反应生成FeS而不是Fe2S3;Fe与盐酸反应生成FeCl2而不是FeCl3;Fe与I2反应生成FeI2而不是FeI3;铁在潮湿的空气中生成铁锈的主要成分是Fe2O3,而铁在纯O2中燃烧的产物是Fe3O4。
2.铁的氧化物列表对比分析如下:
(1) Fe3O4的组成可用氧化物的形式表示为FeO·Fe2O3,即有1/3的铁显+2价,2/3的铁显+3价。(2)Fe(NO3)2溶液酸化后,NO在酸性条件下具有强氧化性,会将Fe2+氧化成Fe3+。
Fe(OH)2+2H+═══Fe2++2H2O
Fe2O3+3H2O
Fe2++2OH-═══Fe(OH)2↓
Fe3++3OH-═══ Fe(OH)3↓
4Fe(OH)2+O2+2H2O═══4Fe(OH)3
(1)在判断铁的化合物与酸反应的产物时,要注意铁在化合物中的价态,利用铁的价态及与其反应的化合物的氧化性或还原性判断发生反应的类型属于复分解反应还是氧化还原反应。
(2)成功制备Fe(OH)2的关键Fe(OH)2具有很强的还原性,易被氧化为Fe(OH)3。在实验室中制备Fe(OH)2,并使Fe(OH)2长时间保持白色沉淀状态,成功的关键有以下两点:①溶液中不含Fe3+和O2等氧化性物质;②制备过程中,保证生成的Fe(OH)2在密闭的隔绝空气的体系中。(3)实验室中制备Fe(OH)2常用的三种方法
方法一:有机层覆盖法将吸有NaOH溶液的胶头滴管插到液面以下,并在液面上覆盖一层苯或煤油(不能用CCl4),以防止空气与Fe(OH)2接触发生反应,如图1所示。
方法二:还原性气体保护法用H2将装置内的空气排尽后,再将亚铁盐与NaOH溶液混合,这样可长时间观察到白色沉淀,如图2所示。方法三:电解法用铁作阳极,电解NaCl(或NaOH)溶液,并在液面上覆盖苯(或煤油),如图3所示。
(4)FeO、Fe3O4、Fe(OH)2与足量HNO3反应时,均发生氧化还原反应,Fe2+被HNO3氧化生成Fe3+。(5)Fe2O3、Fe3O4、Fe(OH)3与足量HI反应时,均发生氧化还原反应,Fe3+被I-还原生成Fe2+。
1.判断正误,正确的打“√”,错误的打“×”。(1)常温下,将铁片浸入足量浓硫酸中,铁片不溶解,说明常温下,铁与浓硫酸不发生化学反应。( )(2)Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应。( )(3)浓盐酸与铁屑反应的离子方程式:2Fe+6H+═══2Fe3++3H2↑。( )
(4)四氧化三铁和稀盐酸反应的离子方程式为Fe3O4+8H+═══3Fe3++4H2O。( )(5)铁是较活泼的金属,它与卤素单质(X2)反应的生成物均为FeX3。( )(6)向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁。( )(7)Fe2O3不可与水反应得到Fe(OH)3,所以不能通过化合反应制取Fe(OH)3。( )
(8)Fe在稀硝酸中发生钝化。( )[提示] Fe在浓硝酸中发生钝化。(9)铁表面自然形成的氧化层能保护内层金属不被空气氧化。( )[提示] 铁表面形成的氧化膜较疏松,不能保护内层金属。(10)过量的铁与氯气反应生成FeCl2。( )[提示] Fe与Cl2反应无论用量多少都生成FeCl3。(11)Fe(OH)2易被氧化成Fe(OH)3,说明稳定性:Fe(OH)2
相关课件
这是一份新教材适用2024版高考化学一轮总复习第3章金属及其化合物第7讲铁及其重要化合物课件,共60页。PPT课件主要包含了考点一,考点二,考点三,必备知识·梳理夯实,Fe2O3,Fe3O4,FeCO3,FeS2,磁性氧化铁,红棕色等内容,欢迎下载使用。
这是一份2023版案一轮总复习化学·人教版 第3章 第7讲 铁及其重要化合物
这是一份第三章 金属及其化合物 金属及其化合物 第13讲 铁及其重要化合物,文件包含第13讲铁及其重要化合物pptx、第13讲铁及其重要化合物docx等2份课件配套教学资源,其中PPT共60页, 欢迎下载使用。









