





人教版 (2019)必修 第一册第三节 化学键课文ppt课件
展开
这是一份人教版 (2019)必修 第一册第三节 化学键课文ppt课件,共22页。PPT课件主要包含了新课讲解,CDEFH,小试牛刀等内容,欢迎下载使用。
2022年北京冬奥会的绿色制冰与化冰
回忆金属钠和氯气反应的实验现象,并写出化学反应方程式。
实验现象:剧烈燃烧,火焰呈黄色,并有大量白烟。
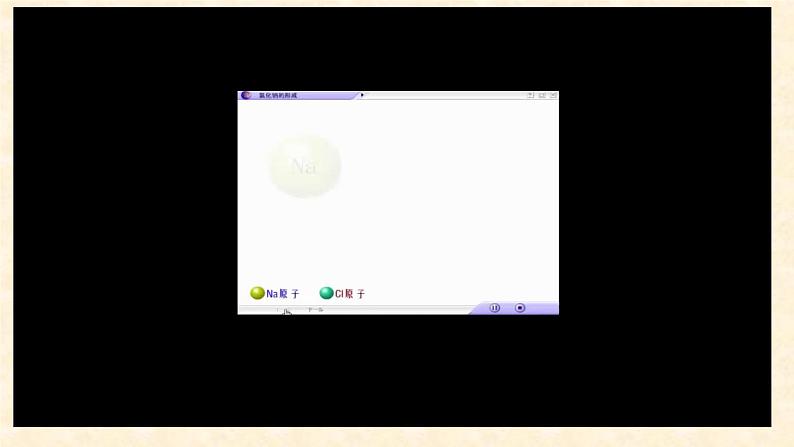
1、从微观角度看,在上述化学反应中,组成NaCl的微粒有哪些?2、从微粒组合的角度看,上述反应的过程和结果如何?
1、离子键的定义:定义:带相反电荷的离子之间的相互作用。2、定义解读:成键微粒:阴离子和阳离子相互作用力:静电作用成键过程:阴、阳离子靠近到某一距离时引力和 斥力达到平衡。
像氯化钠这样,由离子键构成的化合物叫做离子化合物。
哪些元素间容易形成离子键?这些元素在元素周期表哪些位置?(运用元素周期表相关知识)
离子键简单判断法: 活泼金属元素 + 活泼非金属元素
下列哪一组元素的原子间反应最容易形成离子键( )A、Na和O B、Na和F C、Mg和O D、Mg和F
说出下列化合物的物质类别,并判断属于离子化合物的是( )A、HBr B、H2SO4 C、NaOH D、NH4CI E、Na2SO4 F、KI G、AICI3 H、CaO L、CO2
1、定义:像氯化钠这样,由离子键构成的化合物叫做离子化合物。 2、类型:
强碱:如NaOH、Ba(OH)2等;绝大多数盐:如NaCl、K2SO4、CaCO3等;活泼金属氧化物:如Na2O、MgO等。
为方便起见,我们在元素符号周围用“·”或“×”表示原子的最外层电子(价电子)。这种式子叫做电子式。
离子化合物的形成,可以用电子式表示,如氯化钠的形成过程可以表示为:
(1)原子、离子都要标出最外层电子,离子必须标明电荷(2)阴离子要用方括号括起来(3)相同的原子可以合并,相同的粒子要单个写(箭头左边相同的微粒可以合并,箭头右边相同的微粒不可以合并)(4)不能把“—>”写成“=”(5)书写一般遵循左右方向上下点,上下方向左右点,使得对称美观,组成成对稳定的原则。
1.三个“一定” ①离子化合物中一定含有离子键; ②含有离子键的物质一定是离子化合物; ③离子化合物中一定含有阴离子和阳离子。2.两个“不一定” ①离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等; ②含有金属元素的化合物不一定是离子化合物,如AlCl3。
离子键的三个“一定”和两个“不一定”
1.下列说法正确的是( ) A.离子键就是使阴、阳离子结合成化合物的静电引力 B.所有金属与所有非金属原子之间都能形成离子键 C.在化合物CaCl2中,两个氯离子之间也存在离子键 D.含有离子键的化合物一定是离子化合物
2、写出下列(非)金属元素的电子式:① S _______;② K _______;③ H _______。
3、写出下列物质的电子式:①KCl_________________;②MgCl2_________________;③NaCl_________________。
4.下列物质属于离子化合物的是( )A.CO2 D.NaF
相关课件
这是一份高中化学人教版 (2019)必修 第一册第三节 化学键教学ppt课件,共30页。PPT课件主要包含了素养要求,化学键,离子键与离子化合物,电子式,课堂小结,当堂练习等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第一册第四章 物质结构 元素周期律第三节 化学键集体备课ppt课件,共10页。PPT课件主要包含了情景引入,一百多种元素,思考1,Na+,Cl-,不稳定,思考2,静电作用,平衡时成键,离子键等内容,欢迎下载使用。
这是一份高中化学必修一 专题4.3.1 离子键,共17页。











