




高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡实验活动1 探究影响化学平衡移动的因素背景图ppt课件
展开表明反应所释放或吸收的热量的化学方程式,叫热化学方程式。
这两个式子与我们通常所见的方程式有何不同?
①物质后面带有(g)、(l),有何涵义?
②系数为什么可以是分数?
③ΔH表示什么?ml-1是什么意思?
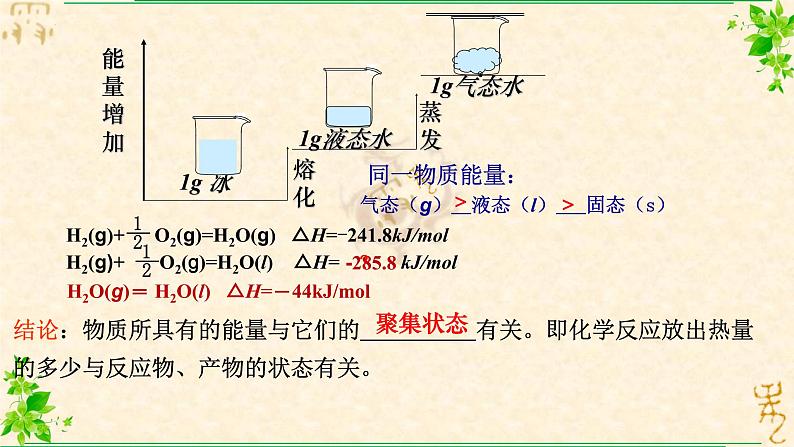
气态(g) 液态(l) 固态(s)
结论:物质所具有的能量与它们的 有关。即化学反应放出热量的多少与反应物、产物的状态有关。
H2O(g)= H2O(l) △H=-44kJ/ml
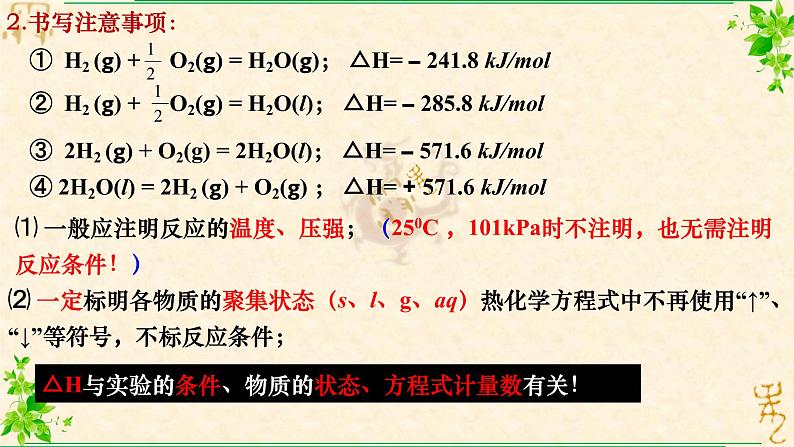
③ 2H2 (g) + O2(g) = 2H2O(l); △H= – 571.6 kJ/ml
④ 2H2O(l) = 2H2 (g) + O2(g) ; △H= + 571.6 kJ/ml
⑴ 一般应注明反应的温度、压强;(250C ,101kPa时不注明,也无需注明反应条件!)
△H与实验的条件、物质的状态、方程式计量数有关!
⑵ 一定标明各物质的聚集状态(s、l、g、aq)热化学方程式中不再使用“↑”、“↓”等符号,不标反应条件;
问题:ΔH 中的单位ml-1代表什么含义?
⑶ ΔH的“+”和“-”不能省,且单位为kJ/ml,单位中的ml-1是对应整个反应的,即反应热表示每摩尔反应放出或吸收的热量。△H 的数值与方程式中的计量数成正例。
⑷ 系数仅仅表示物质的量,不表示分子个数;故系数可以是整数、分数、小数;
(5)可逆反应中正逆反应的ΔH 绝对值相同,符号相反。
3.热化学方程式有什么意义?
(1)表明某状态的某物质参加反应,结果生成某状态的某物质。
(2)表明反应物和生成物之间的物质的量之比。
(3)反应物完全变成生成物后所放出或吸收的热量(注意可逆反应)。
总结:热化学方程式既表明了化学反应中的物质变化,也表明了化学反应中的热量变化。
N2 (g) + 3H2 (g) 2NH3 ( g ) △H = -92.0 kJ/ml
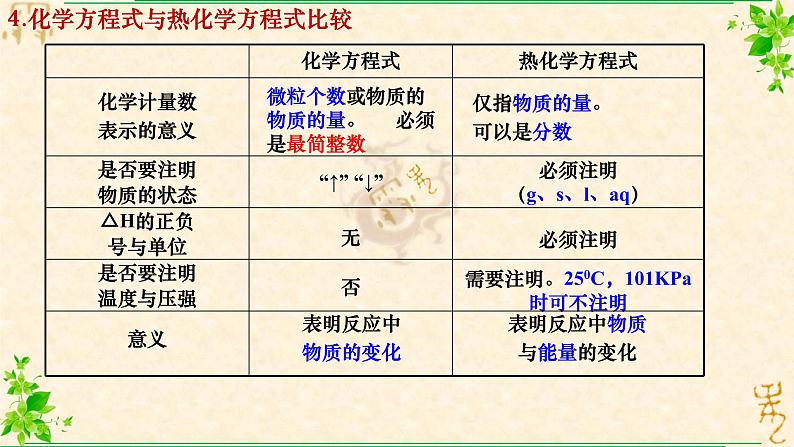
需要注明。250C,101KPa时可不注明
表明反应中物质与能量的变化
必须注明(g、s、l、aq)
仅指物质的量。可以是分数
微粒个数或物质的物质的量。 必须是最简整数
4.化学方程式与热化学方程式比较
1.沼气的主要成分是甲烷。0.5 ml CH4完全燃烧生成CO2和H2O(l)时,放出445 kJ的热量。则下列热化学方程式中正确的是( )
A、2CH4( g ) + 4O2( g ) = 2CO2( g ) + 4H2O ( l ) ΔH = + 890 kJ/ml
B、CH4 + 2O2 = CO2 + H2O ΔH = – 890 kJ/ml
C、CH4 ( g ) + 2 O2 ( g ) = CO2 ( g ) + 2 H2O ( l ) ΔH = – 890 kJ/ml
D、 1/2CH4 ( g ) + O2 ( g ) = 1/2CO2 ( g ) + H2O ( l ) ΔH = – 890 kJ/ml
ΔH = – 445 kJ/ml
2.已知0.5 ml甲烷和0.5 ml水蒸气在t ℃,p k Pa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量。该反应的热化学方程式是: _______________________________________________。
A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-4b kJ/mlB. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H=+2b kJ/mlC. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2b kJ/mlD. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=+b kJ/ml
3.已知充分燃烧a g 乙炔气体时生成1ml二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是( )
4.299 K时,合成氨反应 N2 (g) + 3H2 (g) 2NH3 ( g ) △H = -92.0 kJ/ml,将此温度下的1 mlN2 和3ml H2 放在一密闭隔热容器中,在催化剂存在时进行反应,测得反应放出的热量为:A.一定大于92.0 kJ B. 一定等于92.0 kJC. 一定小于92.0 kJ D. 不能确定
三、怎么比较反应热大小
思考1. 在同温、同压下,比较下列反应放出热量△H的大小
A:2H2(g)+O2(g)=2H2O(g) △H1=-Q1 2H2(g)+O2(g)=2H2O(l) △H2 =-Q2
△H1 △H2
B: S(g)+O2(g)=SO2(g) △H1=-Q1 S(S)+O2(g)=SO2(g) △H2 =-Q2
△H1 △H2
△H2= △H3
Q1 Q2
C: C(S)+1/2O2(g)=CO(g) △H1 C(S)+O2(g)=CO2(g) △H2
△H1 △H2
D: H2(g)+Cl2(g)=2HCl(g) △H1 1/2H2(g)+1/2Cl2(g)= HCl(g) △H 2
△H1 △H 2
三、什么是燃烧热
在101 kPa时,1 ml 物质完全燃烧生成 指定产物时所放出的热量,叫做该物质的燃烧热。
★注意事项★:(1)条件: ;(2)可燃物的用量: ; (3)生成 的产物: 如:C →________,S →_______, H → _________ ,N → _________。 (4)单位: ; (5)书写燃烧热的热化学方程式时,以 可燃物为配平标准,其余可出现分数。
燃烧热通常利用量热计由实验测得。例如, 25℃、101KPa时,1ml H2 完全燃烧生成液态水时放出的能量为285.8 kJ 的热量,这就是的燃烧热,其燃烧热化学方程式如下:
煤、石油、天然气是当今世界重要的化石燃料。煤的主要成分是碳单质(C),石油加工产品——汽油的成分之一是辛烷(C8H18),天然气的主要成分是甲烷(CH4),它们燃烧的热化学方程式分别表示如下:
C(s) + O 2 (g)=CO2 (g) △H=-393.5kJ ·ml -1
CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) △H=-890.3kJ ·ml -1
25℃、101KPa时,某些物质的燃烧热参见附表Ⅰ。
某些物质的燃烧热(25℃、101KPa)
重要的体内能源——脂肪 说起脂肪,你也许会想到肥胖、高血脂等。实际上,人体内的脂肪具有重要的生理功能。 脂肪是人体储存能量的重要物质。一般年人体内储存的脂肪占体重的10%~20%。当人体因劳动或体育运动消耗大量能量而糖类又不能及时供应能量时,储存在体内的脂肪就会发生水解反应,生成高级脂肪酸和甘油。高级脂肪酸发生氧化反应,生成二氧化碳和水,同时放出能量,满足机体活动的需要。例如,软脂酸[CH3(CH2)14COOH]是一种有代表性的人体脂肪酸,其燃烧的热化学方程式为: CH3(CH2)14COOH (s) +23O2(g)=16CO(g)+16H2O(1) ∆H=−9977kJ/ml。 尽管在人体内的反应远比上述反应复杂,但体内反应的反应物、生成物及其能量变化与上述反应完全相同。人体活动所成需要的能量就是来自体内类似的放热反应。 人体内的脂肪还能提供必需脂肪酸、促进脂溶性维生素的吸收和维持体温恒定等。因此,人体毎天需要摄入一定量的脂肪。中国营养学会推荐的每人每天油脂的食用量为25-30 g;此外,人体从许多食物(如肉类、奶类等)中也会摄入一部分脂肪。这两部分脂肪总量达到每天50-60g时,就能够满足人体体的需要。当然,如果摄入过量的脂肪,对人体也是有害的。
【例1】已知下列两个热化学方程式:
2H2(g)+O2(g) =2H2O(l) △H=-571.6 kJ•ml-1 C3H8(g)+5O2(g) =3CO2(g)+4 H2O(l) △H=-2220 kJ•ml-1(1)H2的燃烧热为 ,C3H8的燃烧热为 ;(2)2gH2和2ml C3H8组成的混合气体完全燃烧放出的热量为:___________ (3)现有H2和C3H8的混合气体5 ml,完全燃烧时放出热量3847 kJ,则混合气体中H2和C3H8的体积比为____。
285.5 kJ•ml-1
2220 kJ•ml-1
x+y=5285.8x+2220y=3847
设H2和C3H8的物质的量分别为x、y
1.CH4可做火箭推进剂的燃料。常温下,0.5 ml CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量。则下列热化学方程式中正确的是( )
2CH4(g) + 4O2(g) 2CO2(g) + 4H2O(l) ∆H=﹢890 kJ/ml
B . CH4 + 2O2 CO2 + 2H2O ∆H=−890 kJ/ml
C . CH4(g) + 2O2(g) CO2(g) + 2H2O(l) ∆H=−890 kJ/ml
D . CH4(g) + O2(g) CO2(g) + H2O(l) ∆H=−890 kJ/ml
完全燃烧生成液态水和CO2,放出55.6kJ热量,计算CH4的燃烧热。
设1ml CH4燃烧放热为Q
= -55.6×16 kJ/ml
= -889.6kJ/ml
答:CH4的燃烧热 △H=- 889.6kJ/ml
55.6kJ× 1ml
4.一定质量的无水乙醇完全燃烧时放出的热量为Q,它生成的CO2用过量饱和石灰水完全吸收可得100gCaCO3沉淀。则完全燃烧1ml无水乙醇时放出的热量是( ) A. 0.5Q B. Q C. 2Q D. 5Q
n(CO2)=n(CaCO3)=100g÷100g/ml=1ml
以生成物CO2为参照标准。生成1ml CO2放出热量为Q,而燃烧1ml乙醇生成2CO2,所以放出热量为2Q。
5.1g氢气在氧气中燃烧生成液态水,放出142.9kJ的热量,表示该反应的热化学方程式是( ) A. H2 +1/2 O2 == H2O ∆H= -285.8kJ/ml B.2H2(g)+O2(g)==2H2O(l) ∆H= -285.8kJ/ml C.H2(g)+1/2 O2(g)==H2O(l) ∆H= -285.8kJ/ml D.H2(g)+1/2 O2(g)== H2O(g) ∆H= -285.8kJ/ml
人教版 (2019)选择性必修1第一章 化学反应的热效应第一节 反应热教案配套ppt课件: 这是一份人教版 (2019)选择性必修1第一章 化学反应的热效应第一节 反应热教案配套ppt课件,共27页。PPT课件主要包含了学习目标,课前导入,只表示物质变化,热化学方程式,化学方程式,知识点一,书写步骤,①写方程式,②标状态,③标条件等内容,欢迎下载使用。
人教版 (2019)选择性必修1第一节 反应热评课课件ppt: 这是一份人教版 (2019)选择性必修1第一节 反应热评课课件ppt,共1页。
高中化学第一节 反应热精品课件ppt: 这是一份高中化学第一节 反应热精品课件ppt,文件包含112热化学方程式燃烧热练习解析版docx、112热化学方程式燃烧热练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。













