


2021温州高三下学期5月高考适应性测试(三模)化学试题含答案
展开
这是一份2021温州高三下学期5月高考适应性测试(三模)化学试题含答案,文件包含化学Worddoc、化学答案pdf等2份试卷配套教学资源,其中试卷共11页, 欢迎下载使用。
机密 ★ 考试结束前
2021年5月份温州市普通高中选考适应性测试
化学试题
考生须知:
1.本试卷分选择题和非选择题两部分,共8页,满分100分,考试时间90分钟。
2.考生答题前,务必将自己的姓名、准考证号用黑色字迹的签字笔或钢笔填写在答题卷上。
3.选择题的答案须用2B铅笔将答题卷上对应题目的答案标号涂黑,如要改动,须将原填涂处用橡皮擦净。
4.非选择题的答案须用黑色字迹的签字笔或钢笔写在答题卷上相应区域内,作图时可先使用2B铅笔,确定后须用黑色字迹的签字笔或钢笔描黑,答案写在本试题卷上无效。
5.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32
Cl 35.5 K 39 Ca 40 Fe 56 Cu 64 Zn 65 I 127 Ba 137
选择题部分
一、选择题(本大题共25小题,每小题2分,共50分。每个小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.下列含有共价键的盐是
A.NH4NO3 B.HClO4 C.NaOH D.MgCl2
2.下列仪器不需要标注温度的是
A. B. C. D.
3.下列物质能导电且属于电解质的是
A.KOH固体 B.熔融NaCl C.SO3 D.CH3COOH
4.下列物质对应的化学式正确的是
A.硬脂酸:C18H36O2 B.熟石膏:CaSO4 · 2H2O
C.漂白粉的有效成分:NaClO D.赤铁矿的主要成分:Fe3O4
5.下列表示不正确的是
A.CH3Cl的电子式 B.正丁烷的球棍模型
C.Mg2+的结构示意图 D.2,3—二甲基戊烷的键线式
6.下列说法不正确的是
A.乙烯在一定条件能与氯气发生取代反应制备氯乙烯(CH2=CHCl)
B.甲苯和间二甲苯的一氯代物均有3种
C.汽油等轻质油主要来自于石油的分馏和重油的催化裂化
D.煤可以直接液化,在一定条件下煤与氢气作用可以得到液体燃料
7.下列说法正确的是
A.和互为同分异构体 B.乙二醇和丙三醇互为同系物
C.16O和18O为不同核素 D.35Cl2和37Cl2互为同素异形体
8.下列说法不正确的是
A.硫酸钡可用作白色颜料,并可作高档油漆、油墨等的原料及填充剂
B.镁是优质的耐高温材料,被大量用于制造火箭、导弹和飞机的部件等
C.高纯的单晶硅是重要的半导体材料,可以作为太阳能光伏电池的基底材料
D.侯氏制碱法中,从过滤NaHCO3后的母液中提取的NH4Cl可用作化肥
9.下列说法不正确的是
A.氧化铝中添加冰晶石(Na3AlF6),使氧化铝熔融温度降低,可减少冶炼过程中的能量消耗
B.市售的碘盐(含KIO3),KIO3在稀硫酸条件下可以使湿润的淀粉-KI试纸变蓝
C.不可以用CuO或FeCl3来代替MnO2作为双氧水分解的催化剂
D.硝酸是一种重要的化工原料,常用来制造染料、炸药、硝酸盐等
10.超氧化钾(KO2)在加热条件下可以将CuO氧化成Cu(III)的化合物,化学方程式如下:2CuO+2KO2O2↑+2KCuO2,则下列说法正确的是
A.该反应中化合价升高的元素只有Cu
B.KCuO2既是氧化产物,又是还原产物
C.当反应中转移的电子数为0.2NA时,则有0.2molCuO被氧化
D.标准状况下,生成3.36LO2时,被还原的超氧化钾(KO2)为0.3mol
11.下列说法不正确的是
A.常温下,将10mL 0.1mol·L−1硫代硫酸钠与10mL 0.1mol·L−1稀硫酸混合,溶液立即产生淡黄色沉淀并有大量气泡冒出
B.pH计、酚酞和甲基橙均能用于NaOH溶液滴定盐酸终点的判断
C.电器设备所引起的火灾,可以使用二氧化碳或四氯化碳灭火器灭火
D.制备硫酸亚铁铵时,铁屑和稀硫酸反应过程中,应适当补充水,可以防止硫酸亚铁晶体析出
12.下列“类比”合理的是
A.酸性氧化物CO2可以与水反应生成碳酸,则酸性氧化物SiO2也可以与水反应生成硅酸
B.Na2O2与CO2反应生成Na2CO3和O2,则Na2O2与SO2反应生成Na2SO3和O2
C.NH3能与HCl反应生成NH4Cl,则H2N-NH2也可以与HCl反应生成N2H6Cl2
D.Zn与CuSO4溶液反应生成ZnSO4和Cu,则Na与CuSO4溶液反应生成Na2SO4和Cu
13.下列反应的离子方程式正确的是
A.将少量石灰水滴入到Ca(HCO3)2溶液中:Ca2++2OH−+2HCO=CaCO3↓+CO+2H2O
B.浓硝酸加热条件下可以氧化硫单质生成硫酸:S+6HNO3(浓)6NO2↑+2H++SO+2H2O
C.往FeBr2溶液中加入足量氯水:2Fe2++2Br−+2Cl2=2Fe3++Br2+4Cl−
D.用银作电极电解稀盐酸:2Ag+2H++2Cl−H2↑+2AgCl↓
14.下列说法不正确的是
A.质谱法是用高能电子束轰击有机物分子,使之分离成带电的“碎片”,从而测定其相对分子质量
B.CH3CH2CH2Cl和CH3CHClCH3分别与NaOH的乙醇溶液共热发生消去反应,可得到2种有机产物
C.淀粉在酸或酶的作用下水解,最终生成葡萄糖
D.溶液中的氨基酸主要以两性离子的形态存在时,可以形成晶体析出
15.有关的说法不正确的是
A.分子中没有手性碳原子
B.可以与氢气发生加成反应
C.该物质在酸性条件下水解,部分产物可以发生缩聚反应
D.该物质在碱性条件下水解并酸化后,得到3种有机产物
16.如图所示化合物是合成纳米管原料之一,W、X、Z、Y是原子半径逐渐减小的短周期元素,且原子序数均为奇数,Z元素无正化合价,W与Z同周期。则下列叙述正确的是
A.液态XY3气化过程中需要破坏X和Y之间的共价键
B.X的氧化物对应水化物一定为强酸
C.Y元素与Na形成的二元化合物与水反应属于非氧化还原反应
D.与W同主族短周期元素形成的单质可以与氢氧化钠溶液反应产生氢气
17.常温下,下列说法一定正确的是
A.pH相同的 NH4HSO4 溶液和NH4Cl溶液,后者的c(NH4+)大
B.CH3COONa溶液,随温度升高,溶液中c(OH−)增大,c(H+)减小
C.在pH=11的氨水中滴加NaOH溶液,会抑制NH3·H2O电离
D.pH=7的CH3COONH4溶液和pH=7的NaCl溶液,两溶液中水的电离程度相等
18.设NA为阿伏加德罗常数的值,下列说法正确的是
A.常温下,0.1L pH=1的H2SO4溶液中SO的数目为0.01NA
B.向100mL 0.10mol·L−1 FeCl3溶液中加入足量Zn粉充分反应,转移电子数目为0.01NA
C.1 mol乙醇和二甲醚的混合物中含共价键数目为8NA
D.密闭容器中充入1 mol [2SO2+ O2],充分反应后生成的SO3分子数为2NA
19.T℃时,向绝热恒容密闭容器中通入a mol SO2 和b mol NO2,一定条件下发生反应:
第19题图
SO2(g)+NO2(g)SO3(g)+NO(g) ΔH<0,测得 SO3的浓度随时间变化如图所示,
下列说法不正确的是
A.容器内压强不再改变说明反应已达平衡
B.SO3在40~50s内的平均反应速率大于50~60s 内的平均反应速率
C.NO2速率v(正)(t=60s时)大于 v(逆)(t=80s时)
D.T℃时,若在恒温恒容下,向原容器通入a mol SO2和bmol NO2,达到平衡时c(SO3)>0.33 mol·L−1
共价键
H-H
H-Br
键能/(kJ·mol−1)
436
369
20. 已知H2(g) + Br2(l) = 2HBr(g) ΔH= -72kJ·mol−1。蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如右表所示,
下列说法正确的是
A. Br2(l)= Br2(g) ΔH= -30kJ·mol−1
B. 2Br (g)= Br 2(g) ΔH= 230kJ·mol−1
C.2HBr(g) =H2(g) + Br2(g) ΔH= 102kJ·mol−1
D.H2(g) + Br2(l) = 2HBr(g) ΔH= -72kJ·mol−1表示一个氢气分子和一个液溴分子完全反应放出72kJ热量
21.近年来用作汽油抗震剂的五羰基合铁[Fe(CO)5],熔点-20℃,沸点103℃,可由金属铁粉和一氧化碳在一定条件下直接反应合成。五羰基合铁中C和O的化合价分别为+2和-2。利用Fe(CO)5的生成和分解,可制得适用于做磁铁心和催化剂的高纯细铁粉。下列有关叙学科网述不正确的是
A.Fe(CO)5属于含氧酸盐
B.Fe(CO)5为分子晶体
C.反应Fe(CO)5=Fe+5CO↑中铁元素的化合价不变
D.由铁粉和一氧化碳在一定条件下合成Fe(CO)5是化学变化
22.一种新型镁硫二次电池的工作原理如图所示。下列说法不正确的是
A.b电极添加石墨烯可以提高电池正极材料导电性
B.放电时,正极反应包括:
Mg2+ + MgS2+2e− = 2MgS
C.隔膜是阳离子交换膜,充电时Mg2+从b极移向a极
第22题图
D.充电时,若发生2mol电子转移,则阳极增加的质量为24g
23.常温下,用0.01mol·L−1甲溶液滴定0.01mol·L−120.00mL乙溶液,混合溶液的相对导电能力变化曲线如图所示。(已知lg2=0.3;忽略混合前后溶液体积的变化)下列有关说法不正确的是
A.条件相同时溶液的导电能力:盐酸>NaOH溶液>CH3COONa溶液
B.曲线①,当NaOH的体积由19.98mL变为20.02mL,混合溶液的pH从5.3突跃到8.7
C.曲线②,对应混合溶液中存在c(Na+)+ c(CH3COO−)+ c(CH3COOH )=0.01 mol·L−1
D.曲线③,当溶液呈中性时,溶液中离子浓度大小关系为:c(Na+)>c(Cl−)>c(CH3COO−)>c(H+)=c(OH−)
第23题图 第24题图
24.活泼自由基与氧气的反应一直是关注的热点。自由基HNO与O2反应过程的能量变化如图所示,下列说法不正确的是
A.反应物的总键能小于产物的总键能
B.产物的稳定性:P1 pH(CH3COONa),则说明Ka(CH3COOH)> Ka(HClO)
D
探究有机物基团之间的相互影响
取三支试管各加入等量的己烷、苯、甲苯,分别加入几滴等量的酸性KMnO4溶液(必要时可以稍稍加热),再观察现象
若加入甲苯中的溶液褪色,其他两支试管中的溶液不褪色,则说明苯环对甲基有影响,使甲基更易被氧化
非选择题部分
二、非选择题(本大题共6小题,共50分)
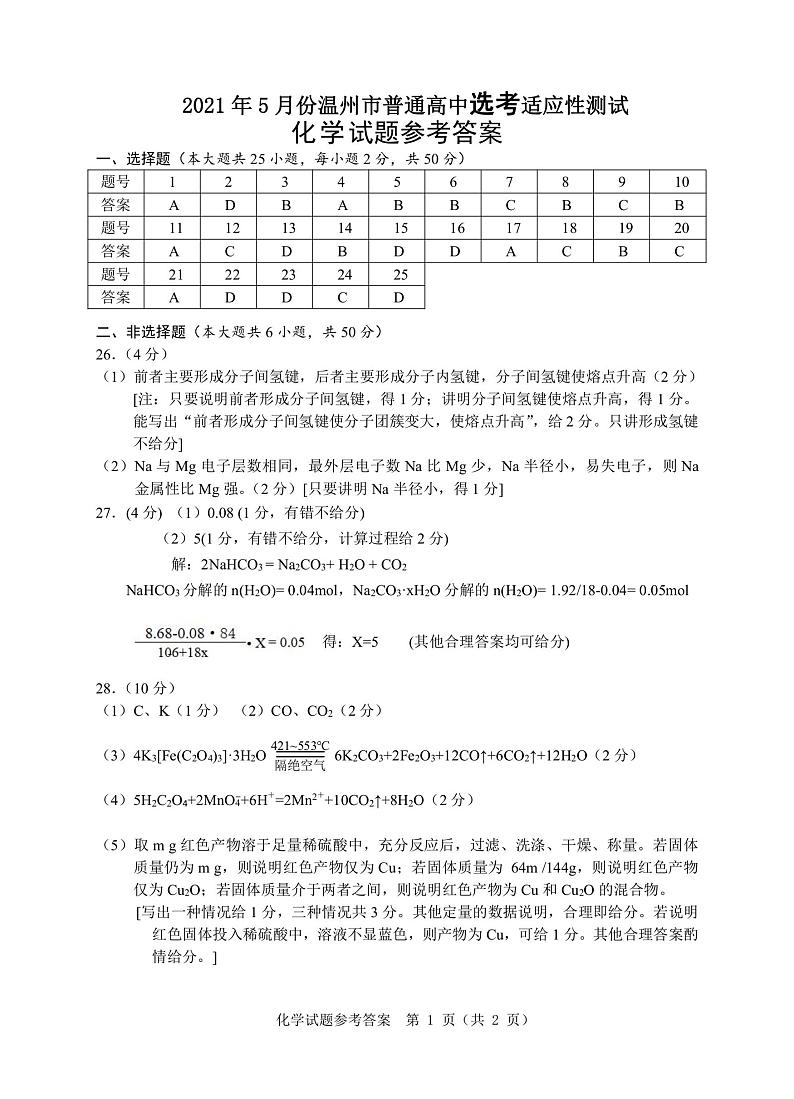
26.(4分)
(1)对羟基苯甲酸()的熔点(213~217 °C)比邻羟基苯甲酸
()的熔点(135~136℃)高,原因是 ▲ 。
(2)钠的金属性比镁强,从结构的角度说明理由 ▲ 。
27.(4分)实验室久置的NaHCO3固体中有Na2CO3·xH2O(x≤10)。取该固体8.68g充分加热,产生的气体依次通过浓硫酸和碱石灰被完全吸收,分别增重1.62g和1.76g。请计算:
(1)固体中NaHCO3物质的量 ▲ mol。
(2)Na2CO3·xH2O中x= ▲ 。(写出计算过程)
28.(10分)某含结晶水的盐A是制备负载型活性铁催化剂的主要原料,由五种常见元素组成,M(A)
相关试卷
这是一份2021温州高三11月适应性测试化学试题含答案
这是一份2021温州高三下学期3月高考适应性测试(二模)化学试题扫描版缺答案
这是一份2021温州高三下学期3月高考适应性测试(二模)化学试题含答案








