
2021西安中学高三下学期6月第二次仿真考试化学试题含答案
展开
这是一份2021西安中学高三下学期6月第二次仿真考试化学试题含答案,共12页。试卷主要包含了24LNH3,则b极产生0,0,A错误;等内容,欢迎下载使用。
西安中学高2021届高三第二次仿真考试
理综试题-化学部份
(时常:50分钟 满分100分)
可能用到的相对原子质量:H-1 C-12 N-13 O-16 Na-23 Mg-24 Al-27 P-31 S-32 Cl-35.5
Ti-49 Fe-56 Co-59 Ni-59 Cu-64 Zn-65
第I卷(选择题)
一、选择题:本题共7道小题,每小题6分,共42分。每小题只有一项符合题意要求。
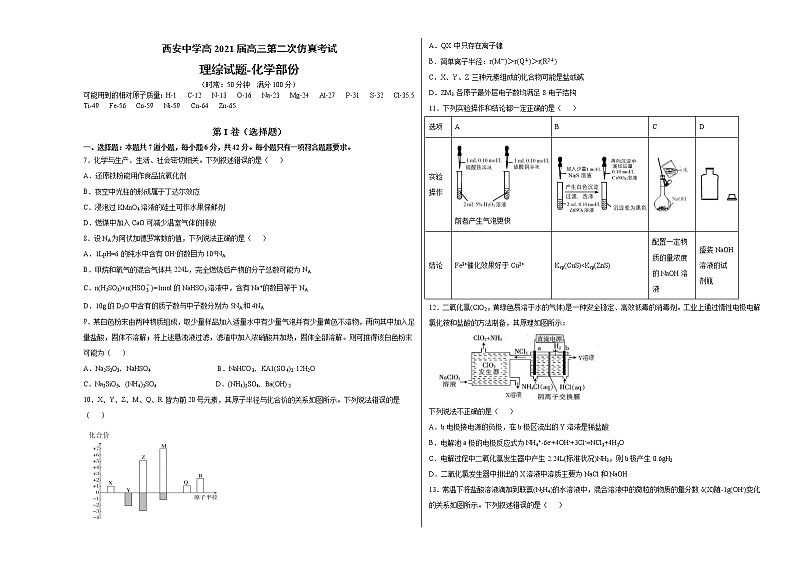
7.化学与生产、生活、社会密切相关。下列叙述错误的是( )
A.还原铁粉能用作食品抗氧化剂
B.夜空中光柱的形成属于丁达尔效应
C.浸泡过KMnO4溶液的硅土可作水果保鲜剂
D.燃煤中加入CaO可减少温室气体的排放
8.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1LpH=6的纯水中含有OH-的数目为10-8NA
B.甲烷和氧气的混合气体共224L,完全燃烧后产物的分子总数可能为NA
C.n(H2SO3)+n(HSO)=1mol的NaHSO3溶液中,含有Na+的数目等于NA
D.10g的D2O中含有的质子数与中子数分别为5NA和4NA
9.某白色粉末由两种物质组成,取少量样品加入适量水中有少量气泡并有少量黄色不溶物,再向其中加入足量盐酸,固体不溶解;将上述悬浊液过滤,滤渣中加入浓硝酸并加热,固体全部溶解。则可推得该白色粉末可能为( )
A.Na2S2O3、NaHSO4 B.NaHCO3、KA1(SO4)2·12H2O
C.Na2SiO3、(NH4)2SO4 D.(NH4)2SO4、Ba(OH)2
10.X、Y、Z、M、Q、R 皆为前20号元素,其原子半径与化合价的关系如图所示。下列说法错误的是( )
A.QX 中只存在离子键
B.简单离子半径:r(M-)>r(Q+)>r(R2+)
C.X、Y、Z 三种元素组成的化合物可能是盐或碱
D.ZM3 各原子最外层电子数均满足8 电子结构
11.下列实验操作和结论都一定正确的是( )
选项
A
B
C
D
实验操作
前者产生气泡更快
结论
Fe3+催化效果好于Cu2+
Ksp(CuS)c(OH-)
D.Kb1(N2H4)=10-6
第II卷(非选择题)
二、非选择题:本题共5道小题,共58分。第26~28为必做题,第35题和第36题任选一道答题,多做按第一道题计分。
26.(14分)下图为从预处理后的可充电电池粉末(主要为、、和等)中回收重金属的工艺流程。
回答下列问题:
(1)“浸取”过程先加入溶液,再通入,滤液①中主要含、、及。写出浸取时发生反应的化学方程式:________________________________。
(2)探究“催化氧化”步骤中氧化为的实验条件,向含量为的溶液中通入空气,待反应完全后,记录浓度数据如下表:
反应
时间
25℃
90℃,石墨催化
1.5h
0.090
0.35
2.5h
0.14
0.38
5h
0.35
0.38
由表中数据可得,氧化的最佳条件为_______________。
(3)已知为强氧化剂,向中加入浓盐酸发生“反应Ⅰ”,写出该反应的离子方程式___________。
(4)“反萃取”的原理为,需加入的试剂X为___________,分离有机相和水相的操作为____________________________________________。
(5)水相①的主要溶质为____________(填化学式)。
(6)生成沉淀是利用反应,常温下,该反应平衡常数,的平衡常数,列式计算:________________________。
27.(15分)纳米TiO2是一种重要的光催化剂。以钛酸酯Ti(OR)4为原料制备纳米TiO2的步骤如下:
①组装装置如图所示,保持温度约为65℃,先将30mL钛酸四丁酯[Ti(OC4H9)4]加入盛有无水乙醇的三颈烧瓶,再加入3mL乙酰丙酮,充分搅拌;
②将含水20%的乙醇溶液缓慢滴入三颈烧瓶中,得到二氧化钛溶胶;
③将二氧化钛溶胶干燥得到二氧化钛凝胶,灼烧凝胶得到纳米TiO2。
已知:钛酸四丁酯能溶于除酮类物质以外的大部分有机溶剂,遇水剧烈水解;Ti(OH)4不稳定,易脱水生成TiO2。回答下列问题:
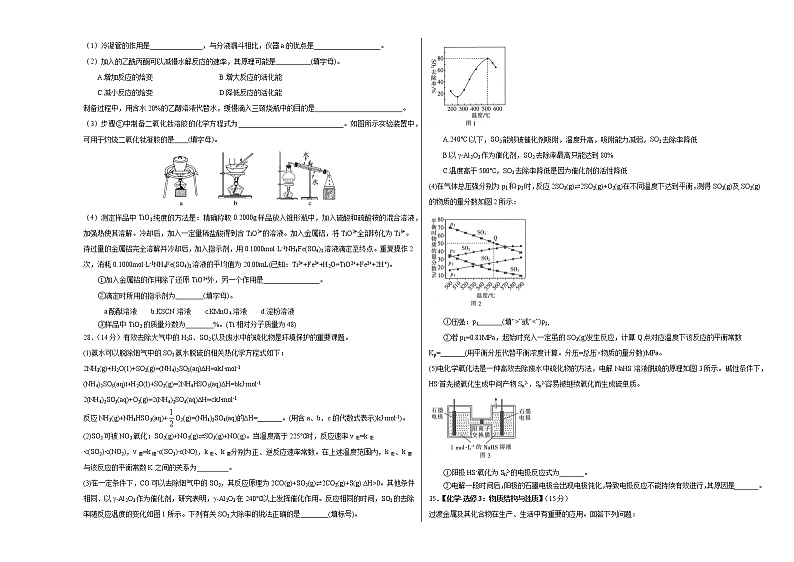
(1)冷凝管的作用是_______________,与分液漏斗相比,仪器a的优点是___________________。
(2)加入的乙酰丙酮可以减慢水解反应的速率,其原理可能是__________(填字母)。
A.增加反应的焓变 B.增大反应的活化能
C.减小反应的焓变 D.降低反应的活化能
制备过程中,用含水20%的乙醇溶液代替水,缓慢滴入三颈烧瓶中的目的是_________________________。
(3)步骤②中制备二氧化钛溶胶的化学方程式为______________________________。如图所示实验装置中,可用于灼烧二氧化钛凝胶的是____(填字母)。
(4)测定样品中TiO2纯度的方法是:精确称取0.2000g样品放入锥形瓶中,加入硫酸和硫酸铵的混合溶液,加强热使其溶解。冷却后,加入一定量稀盐酸得到含TiO2+的溶液。加入金属铝,将TiO2+全部转化为Ti3+。待过量的金属铝完全溶解并冷却后,加入指示剂,用0.1000mol·L-1NH4Fe(SO4)2溶液滴定至终点。重复操作2次,消耗0.1000mol·L-1NH4Fe(SO4)2溶液的平均值为20.00mL(已知:Ti3++Fe3++H2O=TiO2++Fe2++2H+)。
①加入金属铝的作用除了还原TiO2+外,另一个作用是________________。
②滴定时所用的指示剂为________(填字母)。
a.酚酞溶液 b.KSCN溶液 c.KMnO4溶液 d.淀粉溶液
③样品中TiO2的质量分数为________%。(Ti相对分子质量为48)
28.(14分)有效去除大气中的H2S、SO2以及废水中的硫化物是环境保护的重要课题。
(1)氨水可以脱除烟气中的SO2.氨水脱硫的相关热化学方程式如下:
2NH3(g)+H2O(1)+SO2(g)=(NH4)2SO3(aq)∆H=akJ∙mol-1
(NH4)2SO3(aq)t+H2O(l)+SO2(g)=2NH4HSO3(aq)∆H=bkJ∙mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq)∆H=ckJ∙mol-1
反应NH3(g)+NH4HSO3(aq)+O2(g)=(NH4)2SO4(aq)的∆H=_______。(用含a、b、c的代数式表示)kJ∙mol-1)。
(2)SO2可被NO2氧化:SO2(g)+NO2(g)⇌SO3(g)+NO(g)。当温度高于225℃时,反应速率v正=k正∙c(SO2)∙c(NO2),v逆=k逆∙c(SO3)∙c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为_________。
(3)在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO(g)+SO2(g)⇌2CO2(g)+S(g) ∆H>0。其他条件相同、以γ-Al2O3作为催化剂,研究表明,γ-Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2的去除率随反应温度的变化如图1所示。下列有关SO2大除率的说法正确的是________(填标号)。
A.240°C以下,SO2能够被催化剂吸附,温度升高,吸附能力减弱,SO2去除率降低
B.以γ-Al2O3作为催化剂,SO2去除率最高只能达到80%
C.温度高于500℃,SO2去除率降低是因为催化剂的活性降低
(4)在气体总压强分别为p1和p2时,反应2SO3(g)⇌2SO2(g)+O2(g)在不同温度下达到平衡,测得SO3(g)及SO2(g)的物质的量分数如图2所示:
①压强:p1_______(填“>”或“C>H Mn2+:[Ar]3d5,Fe2+:[Ar]3d6,其中Mn2+电子排布呈半充满状态,比较稳定,失电子需要能量高,故锰的第三电离能大于铁 4 四面体空隙
【详解】
(1)Cu是29号元素,价电子排布式为:3d104s1,价电子轨道表达式为;;
(2)连接4个共价单键的C原子价层电子对个数是4、连接碳碳双键两端的C原子价层电子对个数是3,根据价层电子对互斥理论判断碳原子的杂化类型:前者是sp3杂化、后者是sp2杂化,C原子的杂化类型有sp2、sp3;
X中,共价单键为σ键、共价双键中含有σ键和π键,O原子和Ti原子之间存在配位键,所以不含氢键和离子键,故选:ACD;
元素的非金属性越强,电负性越大,故电负性:O>Cl>C>H;
(3)构成大π键的原子分别为3C+2N;在形成大π键过程中每个原子首先形成单键,余下的最外层单电子或者孤对电子成大π键,则有电子数,大π键应表示为;
(4)价层电子排布式为Mn2+:[Ar]3d5,Fe2+:[Ar]3d6,其中Mn2+电子排布呈半充满状态,比较稳定,失电子需要能量高,故锰的第三电离能大于铁;
(5)①由题图可知,Cu2+周围距离最近的的个数为4。
②高温下,晶体结构如图所示,金属离子的随机性为50%,金属离子占据四面体空隙。
③分析题图可知,该晶胞中有4个CuFeS2,
则。
36.邻硝基甲苯(或2-硝基甲苯) C13H20ON2 浓HNO3/浓H2SO4,加热 氨基 取代反应 吸收反应产生的HCl,提高反应的转化率 或
【详解】
(1)B的化学名称是邻硝基甲苯(或2-硝基甲苯);H的分子式是C13H20ON2;
(2)由A生成B的反应是硝化反应,试剂:浓HNO3、浓H2SO4,反应条件:加热;
(3)C中所含官能团的名称为氨基;观察G生成H的路线:G的Cl原子被丙胺脱掉—NH2上的一个H原子后剩下的集团CH3CH2CH2NH—取代,故反应类型是取代反应;
(4)C与F反应生成G的化学方程式为;
有机反应大多是可逆反应,加入K2CO3消耗反应产生的HCl,使平衡正向移动,提高反应物的转化率;
(5)的单体是,联系原料有甲醇倒推出前一步是与甲醇酯化反应生成单体,由原料丙酮到增长了碳链,用到题干所给信息:,故流程如下:。
相关试卷
这是一份2020西安中学高三第二次模拟考试理综化学试题PDF版含答案
这是一份2021西安中学高三下学期第十次模拟考试化学试题含答案,共9页。试卷主要包含了5 Fe,6×10-15等内容,欢迎下载使用。
这是一份2021西安中学高三下学期5月第一次仿真考试化学试题含答案,共14页。试卷主要包含了5 Fe,01ml葡萄糖,外电路中转移0,4%,15等内容,欢迎下载使用。









