
2021银川贺兰县景博中学高三下学期二模理综化学试题含答案
展开这是一份2021银川贺兰县景博中学高三下学期二模理综化学试题含答案,共9页。试卷主要包含了化学与生活密切相关,无法达到相应实验目的的是等内容,欢迎下载使用。
景博高中2020-2021学年第二学期高三年级第二次模拟考试
理综化学试卷
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 Fe-56 Co-59
7、化学与生活密切相关。下列说法正确的是( )
A.含4%硅的硅钢具有很高的导磁性,可用作变压器铁芯
B.为增强“84”消毒液的消毒效果,可加入75%酒精
C.“西气东输”中的“气”是指液化石油气
D.柴油和生物柴油的主要成分都是烃类
8. 海洋具有十分巨大的开发潜力。下列有关海水综合利用的说法正确的是( )
A.海水晒盐的过程中只涉及化学变化
B.利用潮汐发电是将化学能转化为电能
C.将Br-转变为Br2是海水提溴中关键的化学反应
D.从海水制得的氯化钠除食用外,还可用于氯碱工业以制备金属钠
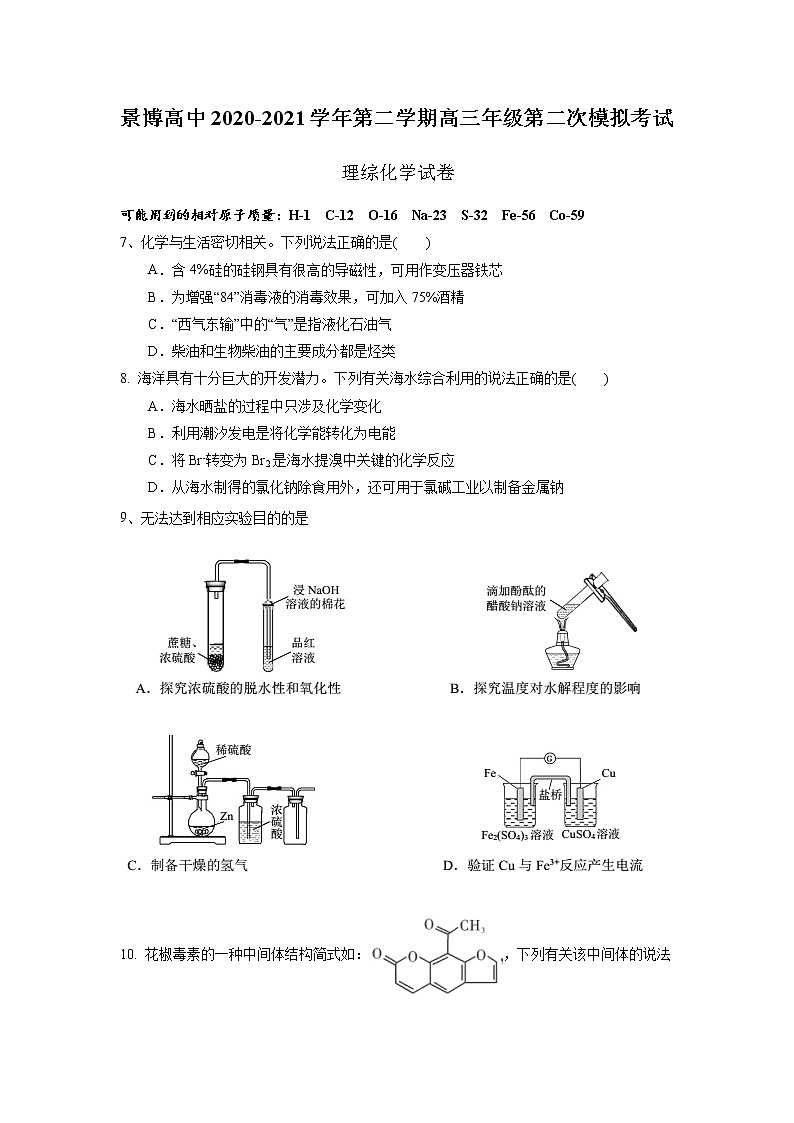
9、无法达到相应实验目的的是
10. 花椒毒素的一种中间体结构简式如:,下列有关该中间体的说法错误的是( )
A. 分子式为C13H7O4 B. 分子中所有原子不可能共平面
C. 能发生水解反应 D. 分子中含有4种官能团
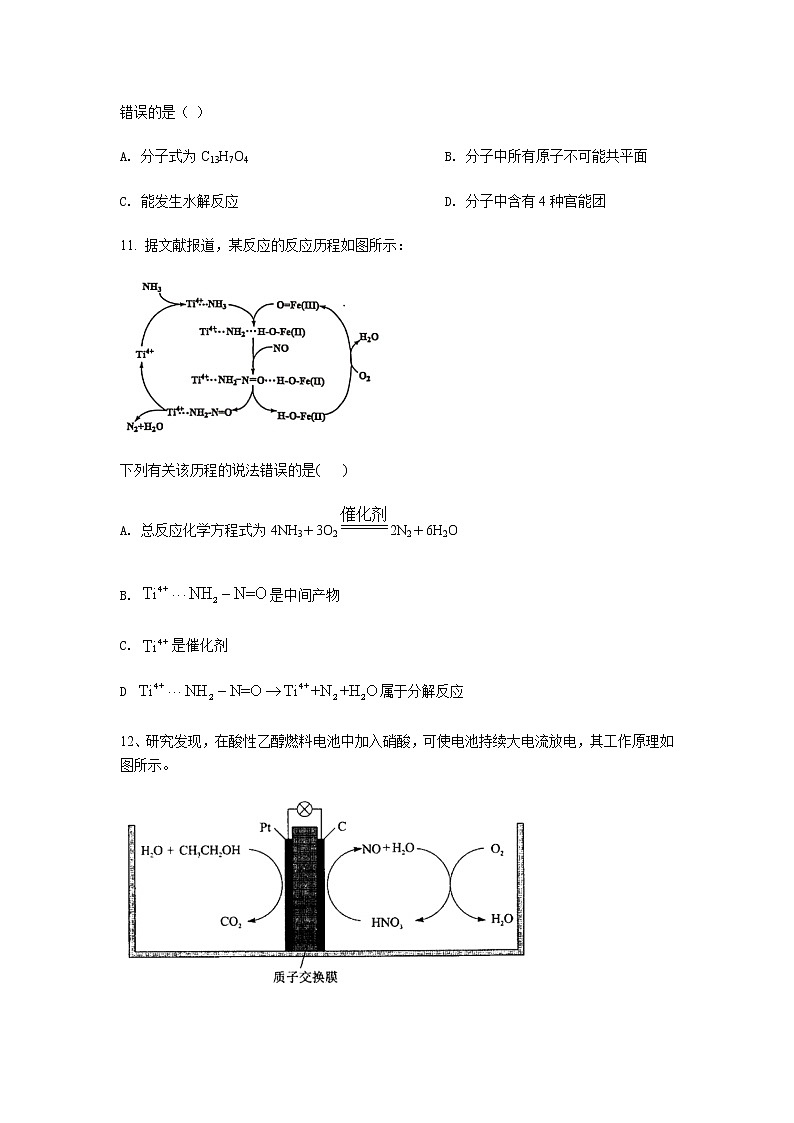
11. 据文献报道,某反应的反应历程如图所示:
下列有关该历程的说法错误的是( )
A. 总反应化学方程式为4NH3+3O22N2+6H2O
B. 是中间产物
C. 是催化剂
D 属于分解反应
12、研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示。
下列说法错误的是( )
A. 加入降低了正极反应的活化能
B. 电池工作时正极区溶液的降低
C. 被完全氧化时有被还原
D. 负极反应为
13、X、Y、Z、R、W、Q为原子序数依次增大的短周期元素,其中X与W同主族,Y是形成化合物最多的元素,Q与Y同主族,W与Q同周期。已知常温下单质X与W的状态不同,R的核电荷数是Y的最外层电子数2倍,化合物QY是第三代半导体材料的典型代表。则下列推断中正确的是
A. 由X、Z、R三种元素组成的化合物一定是共价化合物
B. Q与R形成的化合物性质很不活泼,不与任何酸反应
C. 原子半径由大到小的顺序是:W>Q>Z>R
D. 元素的非金属性由强到弱的顺序是:R>Z>Q>Y
26. (14分)陶瓷工业中钴系色釉具有呈色稳定、呈色强度高等优点,利用含钴废料(主要成分为Co3O4,还含有少量的铝箔、LiCoO2等杂质)制备碳酸钴的工艺流程如下:
(1)“滤液①”主要成分是__________;“操作②”的分离方法是________ 。
(2)“酸溶”中 H2O2的作用是:________________;若用 Na2S2O3代替 H2O2则有两种硫酸盐生成,写出 Na2S2O3在“酸溶”时发生的化学方程式:_____________________________________ 。
(3)已知钴、锂在有机磷萃取剂中的萃取率与 pH 的关系如下图所示,则有机磷萃取时最佳 pH 为_____________。
(4)Co2+萃取的反应原理如下:Co2+ + 2HR(有机层)=CoR2 + 2H+ ,则从有机相中分离出 CoSO4需向有机溶剂中加入以下哪种试剂 ___________(填选项)。
A.H2SO4 B.NaOH C.Co(OH)2 D.HR
(5)“沉钴”时 Na2CO3 的滴速过快或浓度太大,都会导致产品不纯,请分析原因:
__________________________________________。
(6)在空气中煅烧 CoCO3生成钴的氧化物和 CO2,测得充分煅烧后固体质量为 24.1g,CO2的体积为 6.72L(标准状况),则该钴氧化物的化学式为___________。
27.(15分)我国有丰富的Na2SO4资源,2020年10月,中科院过程工程研究所公布了利用Na2SO4制备重要工业用碱(NaHCO3)及盐(NaHSO4)的闭路循环绿色工艺流程:
某校化学兴趣小组根据该流程在实验室中进行实验。回答下列问题:
(1)用以下实验装置图进行流程中的“一次反应”。
①装置A中的橡皮管a的作用是________________________。
②装置B中加入CCl4的目的是________________________。
③装置C中的试剂b是______。
(2)在“二次反应”中,硫酸铵溶液与过量的硫酸钠反应生成溶解度比较小的复盐Na2SO4·(NH4)2SO4·2H2O,分离该复盐与溶液需要的玻璃仪器有________________________。
(3)用以下实验装置图进行流程中的“煅烧(350℃)”
①煅烧时,要边加热边通氮气,理由是_________________________________。
②依据该流程的闭路循环绿色特点,“一次反应”与“煅烧(350℃)”的实验中均采用下图所示装置处理尾气,则烧杯中的X溶液最好是___________溶液。
(4)测定产品硫酸氢钠的纯度:称取12.5g所得产品,配成1000mL溶液,每次取出配制的溶液,用0.1000mol·L-1NaOH标准溶液滴定,测得的实验数据如下表:
序号 | 1 | 2 | 3 | 4 |
标准溶液体积/mL | 20.05 | 18.40 | 19.95 | 20.00 |
所得产品硫酸氢钠的纯度为______________(以百分数表示,保留三位有效数字)。
(5)分析上述流程图,写出利用该流程制备两种盐的总反应的化学方程式
___________________________________________。
28.(14分)羰基硫(COS)是一种粮食熏蒸剂,能防治某些害虫和真菌的危害。以FeOOH作催化剂,分别以CO和CO2为碳源,与H2S反应均能产生COS,反应如下:
反应I:CO(g)+H2S(g)=COS(g)+H2(g)
反应Ⅱ:CO2(g)+H2S(g)=COS(g)+H2O(g)
(1)以CO为碳源制COS反应分两步进行,其反应过程能量变化如图所示。
① CO(g)+H2S(g)=COS(g)+H2(g) △H=___________。
②决定COS生成速率的步骤是___________(填“第1步”或“第2步”)
(2)在密闭容器中按下表投料,分别发生反应Ⅰ和反应Ⅱ(N2不参与反应),反应时间和压强相同时,测得COS的物质的量分数随温度变化关系如下图实线所示(虚线表示平衡曲线)。
| 反应Ⅰ | 反应Ⅱ | ||||
起始投料 | CO | H2S | N2 | CO2 | H2S | N2 |
起始物质的量分数/% | 1 | 1 | 98 | 1 | 1 | 98 |
①已知相同条件下,反应Ⅰ速率比反应Ⅱ快。反应Ⅰ的平衡曲线是_________(填标号)。800~1200℃时,曲线d中COS物质的量分数不断增大,原因是_____________________________________。
②下列说法正确的是___________(填标号)。
A.降低反应温度,CO和CO2的平衡转化率均增大
B.该实验中,900℃时,反应Ⅰ的COS生成速率大于分解速率
C.恒温恒容下反应Ⅱ达到平衡后,增大N2的体积分数,平衡正向移动
D.选用合适的催化剂均能增大反应Ⅰ和反应Ⅱ的COS的平衡产率
③A点对应的平衡体系中,H2S的转化率为___________,该温度下反应的平衡常数K= ___________________(写计算式)。
(3)用COS处理过的粮食食用前需水洗,水洗时COS转化为两种气体,该反应的化学方程式为______________________________________________。
35.(15分)铜及其化合物在生产生活中有着广泛的应用。回答下列问题:
(1)在元素周期表的分区中,铜属于________区,与铜处于同一周期且最外层电子数相同的元素的基态原子共有________种。
(2)下列现代分析手段中,可用于检验水中痕量铜元素的是__________(填标号)。
A.X射线衍射 B.原子光谱 C.质谱 D.红外光谱
(3)在CO分子中,C与O之间形成______个σ键、______个π键,在这些化学键中,O原子共提供了______个电子,过渡金属与O形成羰基配合物时,每个CO分子向中心原子提供2个电子,最终使中心原子的电子总数与同周期的稀有气体原子相同,称为有效原子序数规则。根据此规则推断,镍与CO形成的羰基配合物中,______。
(4)CuCl2可与某有机多齿配体形成具有较强荧光性能的配合物,其结构简式如图所示。该配合物分子中N原子的杂化类型为__________,1mol该有机配体与Cu(Ⅱ)形成的配位键为______mol。
(5)铜催化烯烃硝化反应时会产生NO。键角:NO______NO (填“<”或“=”或“>”),其原因是_____________________________________。
(6)近期我国科学家合成了一种电化学性能优异的铜硒化合物,其晶胞结构如图所示。该铜硒化合物的化学式为___________,其中Cu元素以Cu+和Cu2+存在,则_____(填“①”或“②”)为Cu2+。
36. 热塑性树脂尼龙-66和工程塑料聚碳酸酯(PC)的合成路线如图所示:
回答下列问题:
(1)B中官能团的名称为___________。
(2)己二酸与己二胺生成尼龙-66的反应类型为___________。
(3)C的名称是___________,由1,4-二氯丁烷生成C的化学方程式为___________。
(4)1molE与足量的浓溴水反应,最多可以消耗___________molBr2。
(5)具有一种官能团的W是已二酸()的同分异构体,1molW与足量银氨溶液反应生成4molAg,符合条件的W共有___________种(不含立体异构),其中核磁共振氢谱为三组峰的结构简式为___________(任写一种)。
(6)参照上述合成路线,以对二氯苯为原料(无机试剂任选),设计制备的合成路线___________。
景博高中二模化学参考答案
7 | 8 | 9 | 10 | 11 | 12 | 13 |
A | C | D | A | A | B | C |
26.(14分)
(1)NaAlO2 分液 (各1分,共2分)
(2) 作还原剂或将钴元素还原为二价钴 (2分)
4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O (2分)
(3) 5.3 至6区间(或5.5左右) (2分)
(4) A (2分)
(5) Na2CO3的滴速过快或浓度太大,会使溶液碱性增强而产生 Co(OH)2 (2分)
(6) Co3O4 (2分)
27.(15分)
(1)平衡气压,使氨水能顺利滴加 (2分) 防止溶液倒吸 (1分) 饱和NaHCO3溶液 (2分)
(2) 烧杯、玻璃棒、漏斗 (2分)
(3) 排出分解产生的氨气,防止氨气重新与硫酸氢钠反应 (2分) Na2SO4 (2分)
(4) 96.0% (2分)
(5)Na2SO4+CO2+H2O=NaHSO4+NaHCO3 (2分)
28.(14分)
(1)-11.3kJ/mol (2分) 第1步 (1分)
(2)①a (1分) 温度升高,反应速率加快,相同时间内生成的COS物质的量增多,物质的量分数不断增大 (2分)
②AB (2分)
③3% (2分) 或 (2分)
(3)COS+H2O=CO2+H2S (2分)
35.(15分)
(1)ds 2 (各1分,共2分)
(2)B (1分)
(3)1、2、4、4(共4分,各1分)
(4)sp2、sp3 (2分) 3 (1分)
(4)> (1分) 根据VSEPR理论,NO2+为直线型结构,键角为180°,NO2-为V型结构 (2分)
(5)Cu3Se2 ① (各1分,共2分)
36、 (1). 氨基 (2). 缩聚反应 (3). 1,3-丁二烯 (4). +2NaOH2NaCl+2H2O+ (5). 4 (6). 9 (7). HCOOCH2CH2CH2CH2OOCH或HCOOCH(CH3)CH(CH3)OOCH (8).
相关试卷
这是一份2024银川贺兰县景博中学高三上学期第二次月考化学试题含答案,文件包含宁夏银川市贺兰县景博中学2023-2024学年高三上学期第二次月考化学试题docx、宁夏银川市贺兰县景博中学2023-2024学年高三上学期第二次月考化学试题答案docx等2份试卷配套教学资源,其中试卷共5页, 欢迎下载使用。
这是一份2021银川贺兰县景博中学高二下学期期中考试化学试题含答案,文件包含景博高中2020-2021学年第二学期高二年级期中考试修改版pdf、景博高中2020-2021学年第二学期高二年级期中考试答题卡修改版docx、高二化学期中答案修改版docx、景博高中2020-2021学年第二学期高二年级期中考试答题卡修改版pdf等4份试卷配套教学资源,其中试卷共5页, 欢迎下载使用。
这是一份2020银川贺兰县景博中学高三第五次模拟考试化学试题含答案











