

2021江苏省苏锡常镇四市高三下学期5月教学情况调研(二)化学试题含答案
展开2020~2021学年度苏锡常镇四市高三教学情况调研(二)
化学2021.05
注意事项:
1.本试卷分为选择题和非选择题两部分,共100分,考试时间75分钟。
2.请把选择题和非选择题的答案均填写在答题卷的指定栏目内。
可能用到的相对原子质量:H-1 C-12 O-16 S-32 K-39 Mn-55 Zn-65
选择题
单项选择题:本题包括13小题,每小题3分,共计39分。每小题只有一个选项最符合题意。
1.化学与生活、环境和生产密切相关。下列叙述不涉及氧化还原反应的是
A.使用添加氟化物牙膏预防龋齿B.绿化造林助力实现碳中和目标
C.用氨化铁溶液制作铜印刷电路板D.用泡腾片杀灭新型冠状病毒
2.工业上制备保险粉的反应为。下列有关说法正确的是
A.的结构示意图为
B.NaOH的电子式为
C.HCOONa中含有键和键的数目之比为3∶1
D.基态S原子核外价电子的轨道表达式为
3.酸在生产、实验中有广泛应用。下列有关酸的性质与用途具有对应关系的是
A.氢氟酸显弱酸性,可用于雕刻玻璃
B.浓盐酸具有挥发性,可用于除去铁锈
C.浓硫酸有强氧化性,实验室可用于与甲酸反应制取CO
D.硝酸有强氧化性,能溶解Ag等不活泼金属用于贵重金属的提炼
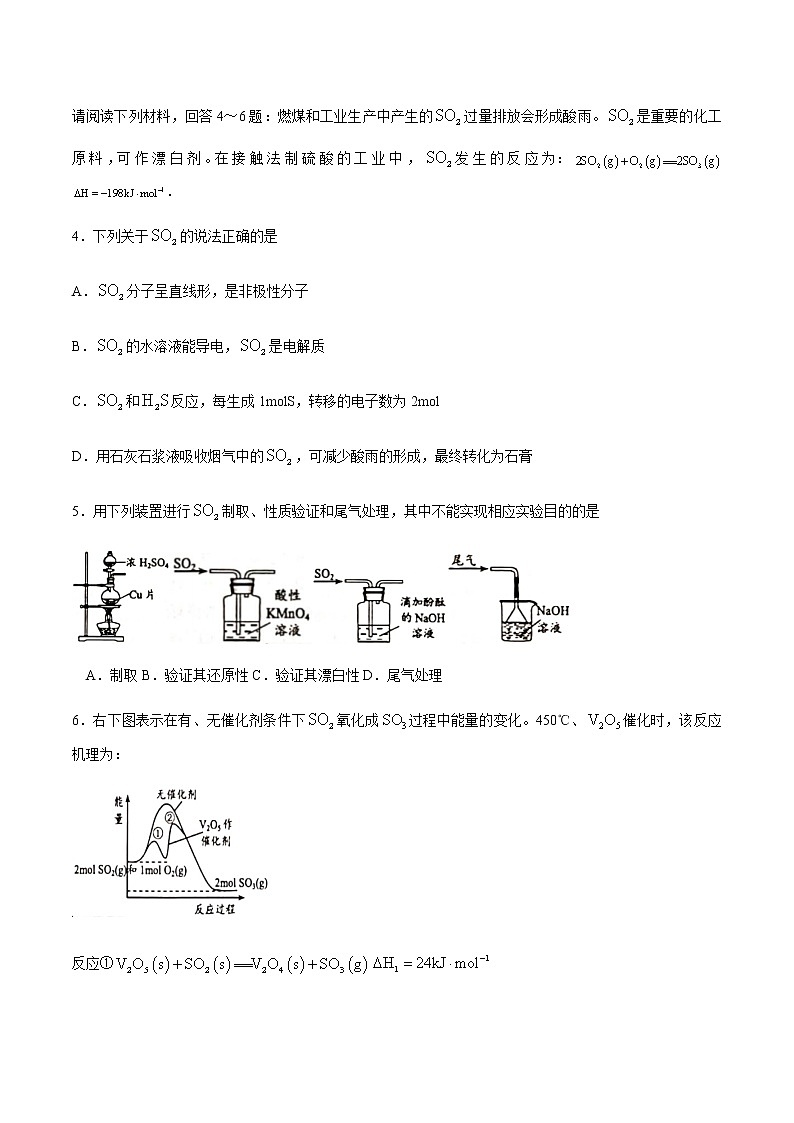
请阅读下列材料,回答4~6题:燃煤和工业生产中产生的过量排放会形成酸雨。是重要的化工原料,可作漂白剂。在接触法制硫酸的工业中,发生的反应为:.
4.下列关于的说法正确的是
A.分子呈直线形,是非极性分子
B.的水溶液能导电,是电解质
C.和反应,每生成1molS,转移的电子数为2mol
D.用石灰石浆液吸收烟气中的,可减少酸雨的形成,最终转化为石膏
5.用下列装置进行制取、性质验证和尾气处理,其中不能实现相应实验目的的是
A.制取B.验证其还原性C.验证其漂白性D.尾气处理
6.右下图表示在有、无催化剂条件下氧化成过程中能量的变化。450℃、催化时,该反应机理为:
反应①
反应②
下列说法正确的是
A.催化时,反应②的速率大于反应①
B.
C.升高温度,反应的化学平衡常数增大
D.增大压强或选择更高效的催化剂,可提高的平衡转化率
7.N、A1、P、S、As均是主族元素。下列有关说法正确的是
A.离子半径:
B.第一电离能:
C.氢化物的沸点:
D.最高价氧化物的水化物的酸性:
8.亚氯酸钠()是一种高效的漂白剂和氧化剂,一种制备亚氯酸钠的流程如下。下列说法正确的是
A.反应①阶段,参加反应的和的物质的量之比为1∶2
B.若通过原电池反应来实现①,负极的电极反应为
C.反应②中的可用代替
D.为防止反应②中有N生成,投料时加入的应过量
9.一种在微生物细菌作用下净化高浓度有机废水的原理如下图所示。下列说法正确的是
A.工作时,从b极区向a极区迁移
B.该装置在高温下仍可正常工作
C.为使此装置持续工作,需不断补充硫酸溶液
D,理论上,每处理含162.0g该有机物的废水,需消耗5mol
10.利用如下实验研究与的反应。
步骤1:向烧杯中加入10mL0.1的KI溶液,再滴加2mL0.1的溶液,振荡,把溶液分为四等份于编号为①②③④的四支试管中。
步骤2:向试管①中加入淀粉溶液,观察到溶液变蓝。
步骤3:向试管②中滴加15%KSCN溶液5~6滴,观察到溶液变红。
步骤4:向试管③、试管④中分别加入1mL2.0的溶液和1mL的蒸馏水,振荡,观察到试管③中溶液颜色比试管④中溶液颜色浅。
下列说法不正确的是
A.试管①中的现象说明此条件下的氧化性大于
B.试管②中的现象说明与的反应为可逆反应
C.试管②中红色物质的组成为,此微粒中心离子的配位数为6
D.步骤4的现象不能说明此条件下能将氧化成
11.水杨酸X与化合物Y在一定条件下可合成阿司匹林Z。下列说法不正确的是
A.W的结构简式为
B.X、Y分子中碳原子轨道杂化类型均有、
C.可用氯化铁溶液鉴别X和Z
D.1mol的X、Z分别与足量的NaOH反应,消耗的NaOH的量不相等
12.常温下,,。对进行下列实验。
实验 | 实验操作和现象 |
1 | 向0.01溶液中滴加适量的KOH溶液,测得pH为7.0 |
2 | 向10.00mL0.01溶液中加入5.00mL0.01KOH溶液 |
3 | 向酸性溶液中滴加过量0.1溶液,溶液从红色变为无色 |
4 | 向0.01溶液中加入过量澄清石灰水,产生白色沉淀 |
下列有关说法正确的是
A.实验1得到的溶液中有
B.实验2得到的溶液中有
C.实验3中反应的离子方程式为
D.实验4反应后静置的上层清液中有
13.CO、分别与反应均能制得粮食熏蒸剂COS,反应如下:
反应Ⅰ:平衡常数
反应Ⅱ:平衡常数
已知:在相同条件下,。
向两个容积相同的密闭容器中按下表投料(不参与反应),在催化剂作用下分别发生上述反应,在相同的时间内COS的物质的量随温度的变化关系如右下图中实线所示。图中虚线c、d表示两反应的平衡曲线。
| 反应Ⅰ | 反应Ⅱ | ||||
起始投料 | CO | |||||
起始物质的量(mol) | 1 | 1 | 3 | 1 | 1 | 3 |
下列有关说法正确的是
A.,曲线d为反应Ⅱ的平衡曲线
B.900℃时,平衡常数
C.相同条件下,延长反应时间能使反应体系中Y点COS的量达到W点
D.恒温恒容下,向W点表示的反应体系中增大的物质的量,能提高的转化率
二、非选择题:共4题,共61分。
14.(15分)
水合肼()易溶于水,具有弱碱性和还原性,能与铜离子形成络合物。利用水合肼处理碱性铜氨废液可获得纳米铜粉。
已知:
①;
在一定条件下可与铜反应转化为。
(1)水合脚电离平衡常数表达式为____________。
(2)获得纳米铜粉时,水合册被氧化成,发生反应的离子方程式为____________。
若水合肼的量不足时,生成另一种还原产物,其晶胞结构如题14图-1所示,该产物的化学式为____________。
(3)保持其它条件不变,水合肼浓度、反应温度对纳米铜的产率的影响如题14图-2、题14图-3所示。
图-2图-3
①水合肼浓度大于3.25时,纳米铜的产率下降的原因可能是____________。
②温度高于75℃后,纳米铜的产率下降的原因可能是____________.
(4)、都可用于处理高压锅炉水中溶解的,防止锅炉被腐蚀。与相比,使用水合肼处理水中溶解的的优点有____________。
15.(14分)依巴斯汀是一种抗过敏药物,其合成路线如下:
(1)
(2)
(1)D→E的反应类型为____________。
(2)G的化学式为,其结构简式为____________。
(3)E到F的转化过程中,加入的作用是____________。
(4)E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式________________________。
①分子中含有苯环,能发生水解。
②分子中有四种不同化学环境的氢原子。
(5)设计以苯和甲苯为原料制备化合物的合成路线(无机试剂任用,合成路线示例见本题题干)____________。
16.(16分)
葡萄糖酸锌是一种抗缺锌药物,可由为原料制得。工业上以废锌铁合金(主要成分为Zn,含有少量的Fe、、ZnO、CuO和油污等杂质)为原料制备的流程如下:
(1)碱洗的目的是____________。
(2)氧化时发生反应的离子方程式为____________。
(3)取“氧化”过程中的上层清液,滴加酸性稀溶液,紫红色褪去,可能的原因是____________。
(4)由过滤所得的滤液为原料制备,请补充完整相应的实验方案:向滤液中____________,过滤、晾干,得到。实验中须用到的试剂:锌粉、1.0。
(5)以为原料可制得葡萄糖酸锌。为测定葡萄糖酸锌样品的纯度,进行下列实验。
步骤1:称取5.200g样品溶于水配成100mL溶液,取25.00mL置于锥形瓶中,滴入少量的铬黑T作指示剂。
步骤2:向锥形瓶中加入过量的10.00mL2.000EDTA,振荡。
步骤3:用1.000锌标准溶液滴定过量的EDTA至终点,消耗锌标准溶液16.00mL(已知:与EDTA反应的化学计量比为1∶1).
①计算此产品中锌元素的质量分数:____________(写出计算过程)。
②中锌元素的含量为14.28%,对照①计算结果,产生误差的可能原因是(所有测定操作均正确)____________.
17.(16分)
As(0)、As(Ⅲ)和As(V)分别表示砷单质、三价砷和五价砷的化合物。硫酸厂产生的酸性废水中含有超标的,需处理达标后才能排放。目前含砷废水的处理常用石灰中和-PFS、氧化吸附、纳米级零价铁等方法。
(1)石灰中和-PFS法,处理过程如下:
含砷废水经氧化后,加入石灰乳,在相同时间内,废水中沉降的固体、砷的去除率与溶液pH的关系如题17图-1所示.水溶液中含砷微粒的物质的量分布分数与pH的关系如题17图-2所示。已知此温度下,溶于水,,,
。
图-1图-2
①一级沉降时,当,废水中开始产生沉淀,该沉淀主要成分的化学式为____________。pH调节到8时,开始产生沉淀,原因是____________。
②二级沉降中,保持溶液pH在8-10之间。加入PFS(聚合硫酸铁,形成的胶体粒子与含砷微粒反应可提高砷的去除率,其主要反应的离子方程式为____________.
(2)氧化吸附法:新生态悬浊液具有较强的氧化性,能将As(Ⅲ)氧化为As(V),也具有较强的吸附性,能吸附水体中的而带正电荷。所带正电荷越多,吸附含砷微粒的能力越强。pH不同时,新生态悬浊液对砷去除率如题17图-3所示。
①加入新生态悬浊液使废水中转化为反应的离子方程式为____________。
②pH从3增大到7的过程中,随着pH增大,砷的去除率上升。其原因是____________。
(3)纳米级零价铁法:纳米级零价铁具有强吸附性和还原性,可直接处理有氧条件下含As(Ⅰ)较多的废水。处理后在纳米级零价铁表面有大量的As(0),外围有大量的As(V)。产生As(0)的原理如题17图-4所示。请描述产生As(0)、As(V)的过程:.
2021江苏省苏锡常镇四市高三下学期3月教学情况调研(一)(一模)化学试题含答案: 这是一份2021江苏省苏锡常镇四市高三下学期3月教学情况调研(一)(一模)化学试题含答案
2021江苏省苏锡常镇四市高三下学期5月教学情况调研(二)化学试题含答案: 这是一份2021江苏省苏锡常镇四市高三下学期5月教学情况调研(二)化学试题含答案,共14页。试卷主要包含了05,酸在生产、实验中有广泛应用,下列关于的说法正确的是,利用如下实验研究与的反应等内容,欢迎下载使用。
2022届江苏省苏锡常镇四市5月高三教学情况调研(二)化学试题PDF版含答案: 这是一份2022届江苏省苏锡常镇四市5月高三教学情况调研(二)化学试题PDF版含答案,共9页。












