




高中化学人教版 (2019)必修 第一册第一节 铁及其化合物图片ppt课件
展开一、铁元素在自然界中的存在形态
问1:自然界中没有金属钠?
有!人类最早使用的铁就是来自太空的陨铁。
但主要是以+2价和+3价化合物的形态存在于矿石中。
铁元素在地壳中的含量仅次于氧、硅和铝,居第四位。
春秋初年,我国已经掌握了冶铁技术。
问2:为什么自然界有铁单质?
纯铁具有金属的共性,如具有银白色金属光泽,具有导电性、导热性和延展性。
铁能被磁铁吸引,具有铁磁性。
熔点 1538℃、沸点 2750℃密度 7.86g/cm3
【例题1】下列关于铁的叙述,错误的是( )A.纯净的铁是光亮的银白色金属B.铁能被磁铁吸引,在磁场作用下,铁自身能产生磁场C.铁是地壳中含量最多的金属元素,所以分布在地壳中的铁有游离态也有化合态D.纯铁的抗腐蚀能力强,在干燥空气中不易被氧化
铁单质只有还原性,一般遇弱氧化剂被氧化为+2价,遇强氧化剂被氧化为+3价。
问1:钠有哪些化学性质?
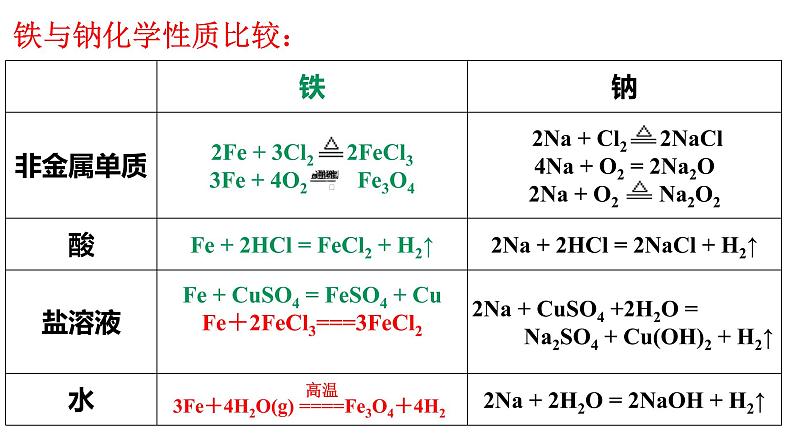
钠可以与非金属、水、酸、盐反应。
问2:那铁有哪些化学性质?
铁也可以与非金属、水、酸、盐反应。
铁在潮湿的空气中易被腐蚀,生成铁锈,其主要成分为
Fe2O3·xH2O。
剧烈燃烧,生成棕色的烟。
氧化性:Cl2 > S
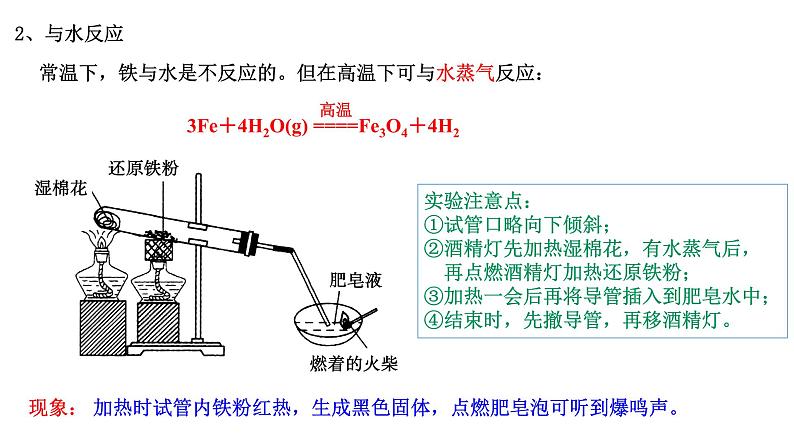
常温下,铁与水是不反应的。但在高温下可与水蒸气反应:
加热时试管内铁粉红热,生成黑色固体,点燃肥皂泡可听到爆鸣声。
实验注意点:①试管口略向下倾斜;②酒精灯先加热湿棉花,有水蒸气后, 再点燃酒精灯加热还原铁粉;③加热一会后再将导管插入到肥皂水中;④结束时,先撤导管,再移酒精灯。
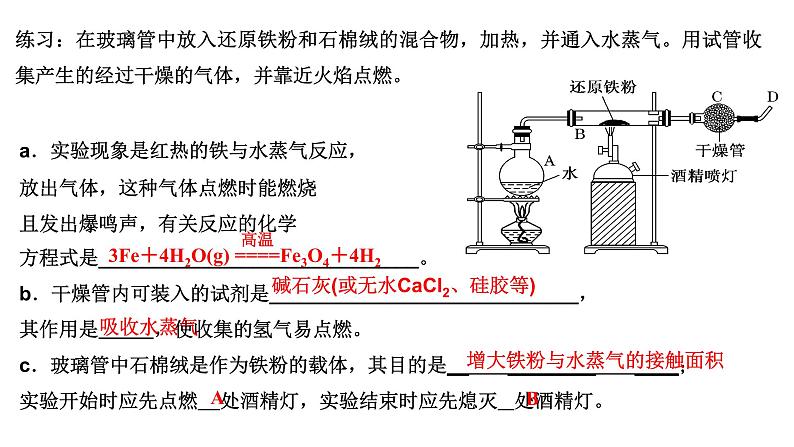
练习:在玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气。用试管收集产生的经过干燥的气体,并靠近火焰点燃。
a.实验现象是红热的铁与水蒸气反应,放出气体,这种气体点燃时能燃烧且发出爆鸣声,有关反应的化学方程式是_____________________________。b.干燥管内可装入的试剂是____________________________,其作用是 ,使收集的氢气易点燃。c.玻璃管中石棉绒是作为铁粉的载体,其目的是__ ________ ____;实验开始时应先点燃 处酒精灯,实验结束时应先熄灭 处酒精灯。
碱石灰(或无水CaCl2、硅胶等)
增大铁粉与水蒸气的接触面积
Fe+2H+===Fe2++H2↑
与非氧化性酸,如盐酸、稀硫酸反应离子方程式:
Fe+2Fe3+===3Fe2+
(2)与FeCl3溶液反应(离子方程式):
Fe+Cu2+===Fe2++Cu
(1)与CuSO4溶液反应(离子方程式):
思考:在钢铁厂的生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,不得留有水,这是为什么呢?
避免高温下铁与水反应,生成四氧化三铁。
铁矿石、焦炭、空气等。
利用还原剂将铁从矿石中还原出来。
思考:其中焦炭的作用?
2.把一定量的铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为( )A.1∶1 B.2∶1 C.2∶3 D.3∶2
1.下列物质反应后一定有+3价铁生成的是( )①过量的Fe与Cl2反应 ②Fe与过量稀硫酸反应③FeCl2溶液中通入少量Cl2 ④Fe和Fe2O3的混合物溶于盐酸中A.只有① B.只有①③ C.只有①②③ D.全部
3.把足量的铁粉投入硫酸和硫酸铜的混合溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与SO42-的物质的量浓度之比为( )A.1∶4 B.2∶7 C.1∶2 D.3∶8
铁元素可以形成三种氧化物,分别是FeO、Fe2O3、Fe3O4
Fe3O4+8HCl ==2FeCl3+FeCl2+4H2O
Fe2O3+6HCl==2FeCl3+3H2O
FeO+2HCl==FeCl2+H2O
红砖和青砖都是生活中用到的建筑材料
两者颜色不同的原因是两者所含的铁的氧化物是不一样的,你认为红砖和青砖中分别含有什么氧化物呢?
红砖中含的是氧化铁,青砖中含的是四氧化三铁
烧制砖瓦时,向窑内添加大量的煤炭后封窑1天,从窑顶向下慢慢浇水7天,水蒸气和窑内高温的炭发生化学反应产生大量的还原气体(氢气和一氧化碳),它们把氧化铁又逐渐还原成为四氧化三铁,而制得青砖。
1.准确称取某种铁的氧化物2.88 g,用足量的CO进行还原,将生成的CO2全部用足量的澄清石灰水吸收,得到沉淀4 g,则这种铁的氧化物为( )A.Fe3O4 B.Fe2O3 C.FeO D.以上都不是
2.有一铁的氧化物样品,用5 ml·L-1的盐酸140 mL恰好完全溶解,所得溶液还能吸收标准状况下0.56 L Cl2,使Fe2+全部变成Fe3+,则该氧化物可能的化学式为 ( )A.Fe2O3 B.Fe3O4 C.Fe4O3 D.Fe5O7
(1)在FeCl3溶液中滴入NaOH溶液,生成__________沉淀,原因是_________________________________(填反应的离子方程式)。(2)在FeSO4溶液中滴入NaOH溶液,生成________絮状沉淀,原因是_________________________________(填反应的离子方程式),沉淀迅速变成 ,最后会有 生成,原因是____________________________________ (填反应的化学方程式)。
在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。
Fe3++3OH-===Fe(OH)3↓
Fe2++2OH-===Fe(OH)2↓
4Fe(OH)2+O2+ 2H2O ===4Fe(OH)3
Fe2++2OH-=Fe(OH)2↓
Fe3++3OH-=Fe(OH)3↓
在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成灰绿色,最后变成红褐色,反应的化学方程式为 4Fe(OH)2+O2+2H2O===4Fe(OH)3
Fe(OH)2与Fe(OH)3的性质比较:
常见的铁盐有 等,常见的亚铁盐有 等。
FeCl3、Fe2(SO4)3
FeCl2、FeSO4
1.Fe3+的检验 【实验3-2】观察实验,填写下表:
Fe3++3SCN-=Fe(SCN)3
思考:你还有其他方法检验铁盐和亚铁盐吗?
也可在溶液中加入氢氧化钠溶液:
2.Fe3+的氧化性 【实验3-2】观察实验,填写下表:
2Fe3++Fe=3Fe2+
【思考】鉴别Fe2+时, (填“能”或“不能”)先加氯水,再加KSCN溶液,原因 。
无法排除亚铁离子的干扰
2Fe2++Cl2=2Fe2++2Cl-
滴入KSCN,黄色溶液变红色。
加入铁粉,溶液变浅绿色,
再加KSCN溶液,没有明显现象。
氧化性:Cl2>Fe3+>Fe2+
充分反应再加入KSCN溶液
由实验3-2得知,Fe3+和Fe2+可以相互转化:
② Fe3+可腐蚀印刷电路板上的铜箔,反应的离子方程式:
① Fe3+与S2-、I-、HS-、SO32-等具有较强还原性的离子不能大量共存。
含有Fe3+的溶液呈黄色,Fe3+处于铁的高价态,遇Fe、Cu、HI、H2S等均表现氧化性。
Cu+2Fe3+===Cu2++2Fe2+
Fe2+的酸性溶液与H2O2反应的离子方程式:
含有Fe2+的溶液呈浅绿色,Fe2+处于铁的中间价态,既有氧化性,又有还原性,以还原性为主,如遇Br2、Cl2、H2O2、NO3-(H+)等均表现还原性。
2Fe2++H2O2+2H+===2Fe3++2H2O
(制作过程看书本P70)
3.Fe3+和Fe2+的相互转化
铁及其化合物的相互转化关系:
【课堂总结】“铁三角”关系
1、判断下列描述的正误(正确的打“√”,错误的打“×”)(1)金属阳离子只有氧化性,不可能有还原性( )
(2)氢氧化铁与HI溶液仅能发生中和反应( )
(3)1 ml FeI2与足量氯气反应时转移的电子数为2NA( )
(4)检验Fe(NO3)2晶体是否变质:将样品溶于稀H2SO4后滴加KSCN溶液,观察溶液是否变红( )
(5)FeCl3溶液与KSCN溶液反应的离子方程式为Fe3++3SCN-=Fe(SCN)3↓( )
(6)向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含有Fe2+( )
(7)根据铁与Cl2、S反应的条件可以判断氯元素和硫元素的非金属性强弱( )
(8)Fe在足量Cl2中燃烧生成FeCl3,在少量Cl2中燃烧生成FeCl2( )
(9)Fe3O4可写作FeO·Fe2O3,所以Fe3O4是FeO和Fe2O3的混合物( )
高中化学人教版 (2019)必修 第一册第三节 化学键说课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第三节 化学键说课课件ppt,共18页。PPT课件主要包含了化学键,注意不包括分子,离子键,成键要素,阴阳离子,静电作用,②明显带离子的物质,2二个“不一定”,1三个“一定”,离子化合物等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 元素周期律授课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律授课课件ppt,共34页。PPT课件主要包含了知识回顾,原子结构分析,核电荷数,性质分析,周期性,原子半径,微粒半径大小,与冷水反应剧烈,中强碱,两性氢氧化物等内容,欢迎下载使用。
化学第二节 离子反应教课内容ppt课件: 这是一份化学第二节 离子反应教课内容ppt课件,共28页。PPT课件主要包含了因为水会导电,什么叫电流,带电粒子的定向移动,电流是怎么产生的,科学探究,实验一,实验二,小灯泡,是否导电,水分子等内容,欢迎下载使用。













