
26.初高中化学衔接——物质构成的奥秘
展开
这是一份26.初高中化学衔接——物质构成的奥秘,共16页。学案主要包含了学习目标,复习回顾,基础训练,例题分析,活动探究,初步探究,查阅资料,实验探究等内容,欢迎下载使用。
初高中化学衔接——物质构成的奥秘
【学习目标】
1、了解原子结构的特点,了解原子核外电子排布的一般规律,能熟练写出1-18号元素的元素符号和原子结构示意图;2、初步学会根据元素的电子层结构特征,进行元素性质的初步判断;了解原子和离子的区别,较熟练书写常见离子的符号和简单离子的结构示意图;3、初步了解元素化合价的概念,熟悉常见元素与原子团的化合价,熟悉常见原子团的符号;并能根据化合价正确书写化学式,初步掌握化学式的书写技能。
【复习回顾】
一、原子的构成与性质:
1、原子结构的特点:(已知每个电子的质量约为每个质子(或中子)质量的1/1836)下表为几种原子的构成:
原子种类
质子数
中子数
核外电子数
相对原子质量
氢
1
0
1
1
碳
6
6
6
12
氧
8
8
8
16
钠[来源:学#科#网Z#X#X#K]
11
12
11
23
铁
26
30
26
56
通过上表,你可以总结出如下特点:
(1)分析对比每一横行中的数据,我们可以发现有如下规律:
原子核内质子数=核外电子数; 相对原子质量=质子数+中子数。
(2)分析对比每一纵行,我们可以总结发现:①第一纵行的不同原子,其质子数不同,即质子数决定元素种类。②第二纵行,氢原子没有中子,其他原子的中子数也不一定相同,即不是所有原子都含中子。
(3)分析对比各纵行可以发现:原子核内质子数不一定等于中子数;原子核外电子数不一定等于中子数;相对原子质量随质子数或中子数的增大而增大……
2、原子核外电子分层排布的基础知识:
①在多电子的原子里,核外电子总是尽先排布在能量较低的电子层,然后由里往外,依次排布在能量逐步升高的电子层(即能量最低原理)。
②原子核外各电子层最多容纳的电子数不超过2n2个(n代表电子层数)。
③最外层电子数不超过8个(第一层即K层不超过2个),次外层电子数目不超过18个(K层为次外层时不超过2个),倒数第三层电子数目不超过32个。
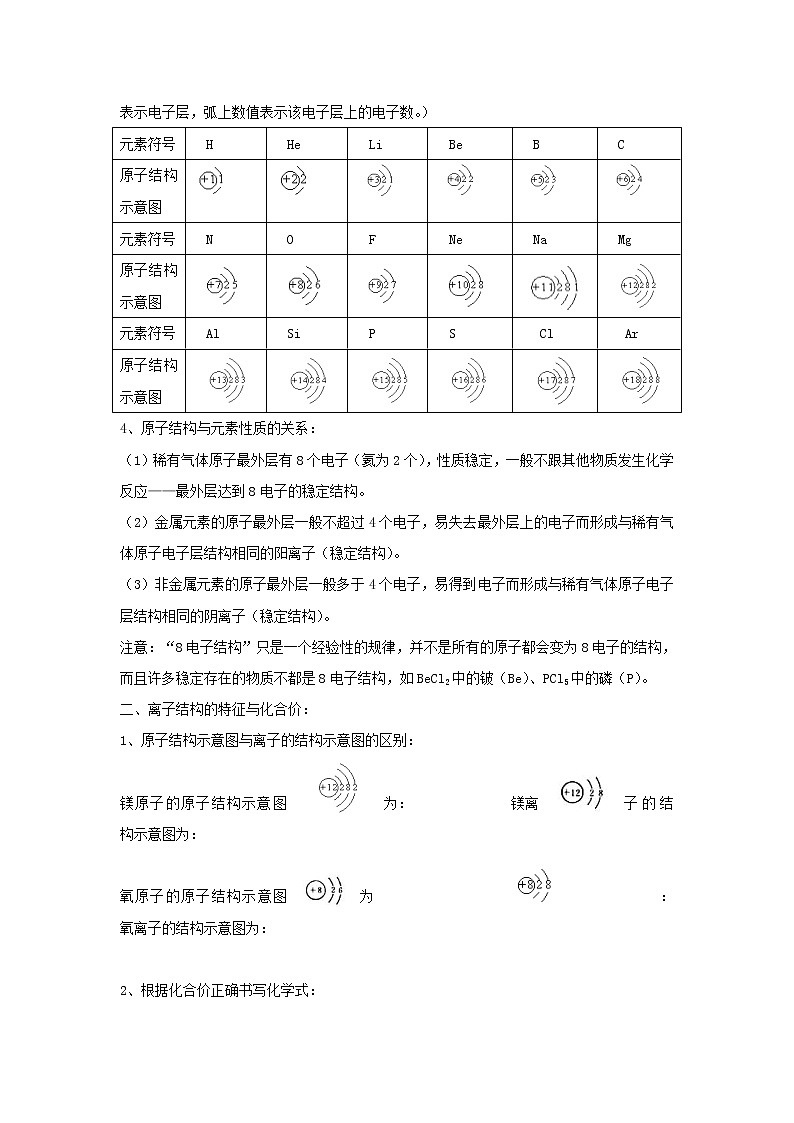
3、原子结构示意图的表示方法:(说明:圆圈表示原子核,圈内数值表示质子数,圈外弧表示电子层,弧上数值表示该电子层上的电子数。)
元素符号
H
He
Li
Be
B
C
原子结构示意图
元素符号
N
O
F
Ne
Na
Mg
原子结构示意图
元素符号
Al
Si
P
S
Cl
Ar
原子结构示意图
4、原子结构与元素性质的关系:
(1)稀有气体原子最外层有8个电子(氦为2个),性质稳定,一般不跟其他物质发生化学反应——最外层达到8电子的稳定结构。
(2)金属元素的原子最外层一般不超过4个电子,易失去最外层上的电子而形成与稀有气体原子电子层结构相同的阳离子(稳定结构)。
(3)非金属元素的原子最外层一般多于4个电子,易得到电子而形成与稀有气体原子电子层结构相同的阴离子(稳定结构)。
注意:“8电子结构”只是一个经验性的规律,并不是所有的原子都会变为8电子的结构,而且许多稳定存在的物质不都是8电子结构,如BeCl2中的铍(Be)、PCl5中的磷(P)。
二、离子结构的特征与化合价:
1、原子结构示意图与离子的结构示意图的区别:
镁原子的原子结构示意图为: 镁离子的结构示意图为:
氧原子的原子结构示意图为: 氧离子的结构示意图为:
2、根据化合价正确书写化学式:
书写原则:根据化合价法则,即在化合物里,正负化合价的代数和为零。
书写基本方法:a. 排元素(或原子团)的顺序:正价左,负价右
b. 标元素(或原子团)的化合价
c. 正、负化合价数值交叉约简定原子个数
d. 写出化学式
e. 用化合价法则检查化学式的正误
例如:硫酸铁的化学式的书写步骤为:
在化学物质中,有些物质的化学式较特殊,如氨(NH3)、甲烷(CH4)中负价在左、正价在右,有些物质如乙炔(C2H2)和双氧水(H2O2)是不能约简为CH和HO的。因此,要灵活应用而不能生搬硬套。
【基础训练】
1.据报道,一高校对某城市湖底淤泥的一项调查实验表明,底层沉积的淤泥中铅、镍、铬、锌等重金属含量,已经超过了城市的土壤的重金属含量。这里提到的铅、镍、铬、锌是指( )
A.元素 B.原子 C.分子 D.单质
2.下表是元素周期表的一部分,则下列回答正确的是( )
11Na
钠
12Mg
镁
13A1
铝
14Si
硅
15P
磷
16S
硫
17C1
氯
18Ar
氩
19K
钾
20Ca
钙
……
A.12号元素的离子符号是Mg+2 B.氯原子的核外电子排布是:
C.表中左边是非金属元素、右边是金属元素 D.钙元素的相对原子质量为20
3.请将下列短文中带点的部分,用恰当的化学用语填写在横线上:
太阳镜具有保护眼睛的功能。太阳镜的镜脚一般是由塑料(其中含有碳元素 )制成的,玻璃镜片的主要成分是二氧化硅 ,且变色玻璃中含有银离子 ,铜制镜框使用时间过长会生成铜绿[Cu2(OH)2CO3],铜绿中氢氧根离子的化合价显—1价 。
4.有几种元素的微粒的核外电子层结构如图所示,其中:
(1)某电中性微粒一般不和其他元素的原子反应,这种微粒符号是________。
(2)某微粒的盐溶液,加入AgNO3溶液时会出现白色浑浊, 这种微粒符号是_______。
(3)某微粒带正电荷,得到电子后还原性强,且这种原子最外层上只有一个电子,这种微粒符号是________。
(4)某微粒带负电荷,且这种微粒失去2个电子即变为原子,这种微粒的符号是___________。
5.2007年6月9日,“八国集团首脑会议”同意减少温室气体的排放。
空气
氧气
氮气
氩气
水蒸气
CO2
请根据右图回答:
(1)在物质分类中空气属于____________。
(2)用化学式填空:制造化肥并还可以作保护气
的是 ;能供给人类呼吸的是 ;上述“温
室气体”是指 ;温室气体增多的主要原因是
。
【例题分析】
例1:有A、B、C三种粒子:已知A带1个单位负电荷,其核外电子排布与氩原子相同;B粒子的第一、第三两电子层的电子数相等;每个C粒子中有3个原子核,其质子数总和为10。
(1) 写出A、B、C的符号:A ,B ,C 。
(2) B粒子的原子结构示意图是 ,A粒子的核电荷数是 。
(3) 写出B与稀硫酸反应的化学方程式: ;金属钠与C反应的化学方程式: 。
解析:这是原子结构的推断题,它的一般形式是:推元素、写用语、判性质。解答此类问题,要掌握好核外电子的排布规律,熟悉原子与阴、阳离子间的关系,以及要注意“粒子”既可以是原子,也可以是分子或离子。解题中要抓住特征条件,找出突破口。A是带一个负电荷的氩型阴离子,由氩的核电荷数可推知A- 有18个电子,而核电荷数为17,即为氯元素。B原子有三个电子层,由于原子的第一电子层最多只能有两个电子,第二电子层最多为8个电子,它的第3层应有2个电子,可推知B原子的核电荷数为12,是镁元素。C粒子有3个原子核,是原子团,由于未说带电荷,故应是分子。3个原子核的核电荷数为10,应有氢原子,且有2个,H2O符合题意。
答案:(1) A为Cl- ,B为Mg,C为H2O。 (2) 17
(3) Mg+H2SO4(稀)=MgSO4+H2↑;2Na+2H2O=2NaOH+H2↑
【活动探究】
“即食即热”型快餐适合外出旅行时使用。小明同学对它的原理产生浓厚的兴趣,于是进行了如下探究:
【初步探究】小明发现:快餐内层用铝箔包裹,外层是分开包装的两包化学物质。使用时拉动拉线,使这两种物质接触,便可对食物进行加热。打开来看:一包是无色液体,一包是白色粉末。小明作如下猜想:
猜想①:这两包物质分别是生石灰和水
猜想②:这两包物质分别是熟石灰和水
【查阅资料】氢氧化钠固体溶于水放出热量;在常温下,NaOH溶液可以和铝反应,并放出热量。
【实验探究】根据下图进行实验,观察发生的现象,完成下表。
化学物质
生石灰和水
熟石灰和水
现 象
温度计内液柱______________[来源:Z,xx,k.Com]
温度计内液柱升幅小
解 释
⑴_________________________________
⑵_________________________________
【结论】通过上述实验,说明该“即食即热”型快餐内两小包物质是 (填化学式)和水。
【讨论】小文建议把这两包物质换成氢氧化钠和水。他的建议合理吗?___________(填“合理”或“不合理”),原因是_________
[参考答案]:
化学物质
生石灰和水
熟石灰和水
现 象
温度计内液柱_大幅上升_
温度计内液柱升幅小
解 释
⑴_生石灰和水反应放出大量热__
⑵_熟石灰溶于水发热较小_
CaO;不合理,①NaOH腐蚀性强,不安全;②NaOH溶液会和铝箔发生反应。
【能力测试】
1. 原子是构成物质的一种粒子,下列关于原子结构的叙述错误的是( )
A. 原子核中的质子数决定元素种类 B. 原子核外的最外层电子与物质的化学性质密切相关
C. 在化学变化中,原子核外的电子没有发生改变 D. 原子核中的质子数和中子数之和可看成相对原子质量
2. 下列原子结构示意图所表示的元素中,属于金属元素的是
3. 飞船推进器中常装有肼(A)和过氧化氢,它们混合时发生反应的化学方程式可表示为:,肼(A)中氮元素的化合价为( )
A. +2价 B. -2价 C. -3价 D. +5价
4. 有研究报告称:除去“普通水”里含有的氮气和氧气后,水的去污能力将大为加强。对此说法的理解不正确的是( )
A. “普通水”中含有氧分子 B. 除去氧气后的水不再会有氧元素
C. “普通水”中含有氮分子 D. “普通水”中溶有一定量的氮气和氧气
5.高性能录音磁带中磁粉的主要材料之一是化学组成相当于CoFe2O4的化合物,又知Co(钴元素)和Fe都有可能为+2、+3,且在上述化合物中每种元素只具有一种化合价,则Co 和 Fe的化合价分别为( )[来源:学.科.网]
A. +2,+3 B. +3,+2 C. +2,+2 D. +3,+3
6. 化学用语是高度浓缩的符号体系,可准确、简洁地记录、表达、交流化学信息。请用化学用语表达:
(l)两个氢分子________________;
(2)构成氯化钠的粒子是____________________;
(3)在常见金属活动性顺序中,活动性最强的金属是_____________________;
(4)当前我市农村大力推广使用的沼气的主要成分是_________________;
(5)少量存在于人体胃液中可帮助消化的物质是_________________________;
(6)用作化肥的碳酸氢铵_______________________。
7. 酸、碱、盐溶解性表是学习化学的重要工具。下表为部分酸、碱、盐在水中的溶解性(20℃)。试回答:
(l)从上表中找出一种不溶盐____________________。
(2)某种盐溶液和某种碱溶液混合生成两种难溶物质,请你从上表找物质写出该反应的化学方程式____________________________________________________________。
(3)有A、B、C、D四种物质的稀溶液,下图为常温时四种溶液两两混合的实验现象,其中“↓”表示生成沉淀,“↑”表示生成气体,“-”表示无明显现象或生成微溶物。请你结合上表,将推断的可能情况填写出来。
①写出A、C的化学式:A_____________、C_______________;
②B可能是________________________________;
③写出A和D反应的化学方程式______________________________________。
【归纳总结】
一、原子结构:
1.原子组成:原子由原子核和核外电子构成的。原子核又由质子和中子组成,但氢原子(11H)核内没有中子。
2.两个关系:原子序数=核电荷数=质子数=(原子)核外电子数
相对原子质量(质量数)=质子数+中子数
3.三种微粒的本质区别:
a. 分子是保持物质化学性质的最小微粒,在化学变化中分子可再分。[来源:Zxxk.Com]
b. 原子是化学变化中的最小微粒,在化学变化中原子不能再分。
c. 离子是带电的原子和原子团。
二、常见元素及原子团的化合价。
(1)氢元素一般是+1价,氧元素是-2价。
(2)金属元素一般是正价;非金属元素在与氧元素形成的化合物中显正价,与金属元素及氢元素形成的化合物中显负价(氟只显-1价)。
(3)原子团的化合价:
(4)常用元素化合价口诀:一价钾钠氯氢银,二价氧钙钡镁锌;二三铁二四碳,三铝四硅五价磷。
有些元素有许多可变化合价:如Cu +1、+2 ;Hg +1、+2 ;Cl -1、+1、+3、+5、+7 ;S -2、+4、+6
N -3、+1、+2、+3、+4、+5等
(注:氧 -2,氯化物中的氯为 -1,氟 -1,溴为-1;单质中元素的化合价为0 ;化合物里各元素化合价的代数和为0)
三、离子化合物、共价化合物:
1、离子化合物:由阴、阳离子相互作用而构成的化合物叫离子化合物。常见的离子化合物有:强碱:NaOH、KOH、Ba(OH)2;活泼金属的氧化物:Na2O、K2O、CaO;大多数盐:NaCl、Na2CO3、NH4Cl、BaSO4等。
2、共价化合物:由不同元素的原子间以共用电子对形成的化合物叫共价化合物。常见的共价化合物有:酸:如HCl、H2S、H2SO4、HNO3、H3PO4;非金属之间形成的化合物(氧化物、氢化物等):CO、CO2、SO2、SO3、NO、NO2;NH3、CH4、PCl5等。(某些金属化合物也是共价化合物,如:AlCl3、SnCl4等)
四、必需掌握的常见化合物或离子的化学式:
1、常见金属、非金属单质的化学式:Ba、K、Ca、Na、Mg、Al、Zn、Fe、Cu、Ag;H2、O2、O3、N2、Cl2、F2、Br2、I2、C、Si、P、S
2、常见气体的化学式:NH3(氨气)、CO(一氧化碳)、CO2(二氧化碳)、CH4(甲烷)、SO2(二氧化硫)、SO3(三氧化硫)、NO(一氧化氮)、NO2(二氧化氮)、H2S(硫化氢)、HCl(氯化氢)
3、常见的酸根离子或简单离子:SO42-(硫酸根)、NO3-(硝酸根)、CO32-(碳酸根)、ClO3-(氯酸根)、MnO4-(高锰酸根)、MnO42-(锰酸根)、PO43-(磷酸根)、Cl-(氯离子)、HCO3-(碳酸氢根)、HSO4-(硫酸氢根)、HPO42-(磷酸氢根)、
H2PO4-(磷酸二氢根)、OH-(氢氧根)、HS-(硫氢根)、S2-(硫离子)、NH4+(铵根离子)、K+(钾离子)、Ca2+(钙离子)、Na+(钠离子)、Mg2+(镁离子)、Al3+(铝离子)、Zn2+(锌离子)、Fe2+(亚铁离子)、Fe3+(铁离子)、Cu2+(铜离子)、Ag+(银离子)、Ba2+(钡离子)
4、常用物质的化学名称、俗名和化学式
汞(水银)Hg 硫(硫磺)S 氧化钙(生石灰)CaO
固体二氧化碳(干冰)CO2 氧化铁(铁锈的主要成分)Fe2 O 3
碳酸钙(大理石、石灰石的主要成分)CaCO3
碱式碳酸铜(铜绿)Cu2 (OH)2 CO3
氯化钠(食盐)NaCl 甲烷(天然气、沼气的主要成分)CH4
乙醇(酒精)C2 H5 OH 乙酸(醋酸)CH3 COOH
碳酸钠(纯碱)Na2 CO3 硫酸铜晶体(蓝矾、胆矾)CuSO4·5H2O
氢氧化钠(烧碱、火碱、苛性钠)NaOH 氢氧化钙(熟石灰、消石灰)Ca(OH)2
水煤气:氢气和一氧化碳的混合物 爆鸣气:氢气和氧气的混合物
【单元检测】 主题一 物质构成的奥秘单元检测题
一、选择题:每小题只有一个正确选项。(每题3分,共30分)
1. 下列对分子、原子、离子的认识,其中正确的是( )
A. 氢原子是最小的粒子,不可再分 B. 镁原子的质子数大于镁离子的质子数
C. 钠原子易失电子形成带负电的阴离子 D. 分子、原子、离子都可以直接构成物质
2.医学上常用“笑气”(N2O)作麻醉剂,N2O中N元素的化合价为( )
A.+1 B.+2 C.+3 D.+4
3.最近美国某玻璃公司研制出一种“自洁玻璃”,该玻璃因穿上40纳米厚的二氧化钛(TiO2)外套,从而具有自洁、不断分解有害气体以及消灭细菌、病毒等作用。关于二氧化钛,你认为以下说法中错误的是( )
A.二氧化钛中钛元素显+4价 B.二氧化钛中的钛元素为非金属元素[来源:学科网]
C.二氧化钛是一种氧化物 D.纳米技术的应用使二氧化钛产生神奇的作用
4.Y2BaCu6O10是一种高温超导材料。该化合物中,Y、Ba、O三种元素的化合价依次为+3、+2、-2价,则铜元素的化合价为( )
A.0价 B.+1价 C.+2价 D.+3价
5. 为了保持载人飞船的太空舱内、气体含量的相对稳定,可用作催化剂将航天员呼出的转化为。中铁元素的化合价为+3价,则Ni元素的化合价为( )
A. +1 B. +2 C. +3 D. +4
6.最近科学家制造出原子序数为112号的新元素,其相对原子质量为277,下列有关112号元素的说法正确的是( )
A.该元素原子的中子数为112 B.该元素原子的质子数为165
C.该元素原子的核外电子数为112 D.该元素原子的核电荷数为277
7.某矿泉水标签上印有的主要矿物质成分及含量如下(单位mg/L):Ca~20、K~3 Zn~0.06、F~0.02等。这里Ca、K、Zn、F是指( )
A.元素 B.原子 C.单质 D.离子
8.下列说法中正确的是( )
A.金属都能和酸发生置换反应生成盐和氢气 B.有盐和水生成的反应一定是中和反应
C.所有物质的溶解度都随着温度的升高而增大 D.原子、分子和离子都是构成物质的粒子
9.近年来发现海底蕴藏着大量天然气水合物----“可燃冰”,其贮藏量超过已知天然气、石油和煤蕴藏量总合的2倍,是目前开发前景十分诱人的新能源。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼内可容纳1个甲烷分子或1个游离的水分子。若晶体中每8个笼有6个容纳了甲烷分子,另外两个被水分子填充。则“可燃冰”的平均分子组成为( )
A CH4•5H2O B CH4•6H2O C CH4•7H2O D CH4•8H2O
10.Cu20与硫酸反应的化学方程式为Cu2O+H2SO4=Cu+ CuSO4+H2O。氧化铜与氢气反应后得到的Cu中常常混有少量Cu2O。现将10 g Cu和Cu2O的混合物放入足量的稀硫酸中充分反应,过滤得到9.5g固体,则原混合物中含Cu2O的质量为( )
A.0.9 g B.9.5 g C.0.5 g D. 0.45 g
二、填空题:(4小题,共30分)
11.(8分)从Ca 、C 、 S 、H 、O 、N六种元素中选择适当的元素按要求填空。
(1)用适当的数字和符号填空:
①二个钙离子 ;②三个硫酸根离子 ;③一氧化氮中氮显+2价
(2)写出符合下列要求的物质的化学式:
①能作为燃料的是 ; ②充入食品包装袋中可防腐的单质
③用作食物调味品的是 ;④能形成硫酸型酸雨的空气污染物
⑤属于化石燃料的是 。
12.(5分)图6是两种元素在元素周期表中的信息,图7是氟原子的原子结构示意图。
(1)图6方框的横线上填的是 ;图7方框横线上的数字是 ;
(2)钠元素属于 (填“金属”或“非金属”)元素;图六所示两种元素形成化合物的化学式为:
,属于 (填“离子”或“共价”)化合物。
13.生活中处处有化学:(10分)
(1)现国家提倡食用加碘盐,在食盐中加入一定量的碘酸钾(KIO3 ),则碘酸根离子的符号为 ;
(2)高温、碱性溶液、高锰酸钾或次氯酸钠等都可以杀死禽流感病毒。农村用石灰水消毒,是因为石灰水中含有 (填化学式)碱性物质可杀菌消毒;也可以用次氯酸钠杀菌消毒,则次氯酸钠(NaClO)中氯元素的化合价为________;如果用加热高锰酸钾的方法熏蒸鸡舍,则其受热分解的化学方程式为: 。
(3)某营养口服液的主要成分为:葡萄糖酸亚铁、葡萄糖酸锌、鸡蛋蛋白粉、蔗糖等。该营养液能为人体补充的微量元素是 (填元素符号)
(4)青少年缺铁会造成贫血。动物肝脏、瘦肉、豆类等食物中含铁量丰富,通过食物补铁可促进青少年的健康发育,这里的铁是指 ;
(5)碳酸氢钠可用做治疗胃酸过多的药物,写出碳酸氢钠的化学式__________。
14.(7分)(1)影响物质性质的因素有:A.离子的种类不同;B.分子的构成不同;C.溶质的质量分数不同等,请从中选择导致下列物质性质差异的因素(填序号)。
①一氧化碳具有可燃性而二氧化碳不具有可燃性 ;
②FeSO4为绿色而Fe2(SO4)3为黄色: ;
③浓硫酸有吸水性而稀硫酸没有: 。
(2)写出具有下列用途的物质(或其主要成分)的化学式。请从以下物质中选择:甲烷、食盐、熟石灰、氧气、碳酸氢铵、石灰石
①可作为燃料 ; ②可作为化肥 ;
③可作为调味品 ; ④可作为火箭助燃剂 。
三、推断题:(10分)
15.(10分)合金A由四种单质组成,已知:①合金A中不含K、Ca、Na;②气体B可燃;③气体G为人体新陈代谢的主要产物之一,请据图回答以下问题:
(1)合金A由哪些单质组成(用化学式表示): 、 、 、 ;
(2)写出反应①的化学方程式: ;
(3)写出反应②的化学方程式: 。
四、应用题:(12分)
16.(12分)2007年2月5日凌晨,南京某地铁工地发生天然气管道破裂和爆炸事故,造成附近5400户居民断水、断电、断天然气。同学们得知这一消息,展开讨论:
(1)天然气的主要成分是CH4,下列有关CH4的说法正确的是________(填序号)。
(2)充分燃烧时产生的热量高且产物无毒,是一种比较理想的燃料,请写出燃烧的化学方程式___________________ 。
(3)在家中使用天然气时,为安全起见,应在厨房安装天然气泄漏报警器。报警器安装的正确位置应选择下图中的________。如果报警器显示漏气,下列应急措施可行的有________ (填序号)。
①关闭气源阀门 ②打开门窗 ③立即打开抽油烟机
(4)使用天然气热水器应注意安全,如果使用不当容易造成CO中毒。CO虽然有毒,但有很多重要用途,请用化学方程式表示下列用途:①作气体燃料________________ ;
②用于冶炼金属________________________________________________。
五、探究题:(12分)
17.(12分)以下是水环境监测中心2006年4月发布的某省地表水资源质量状况中的一部分:
(1)主要污染指标表述的文字中,涉及到的元素有N、_______ _______等。(用元素符号表示)
(2)属于重金属污染的河段是___________。(填编号)
(3)造成总磷超标的主要来源可能是______________________
(4)水中的藻类生长繁殖过快能导致水质恶化并发生“水华”现象。已知藻类含有化学式为C106H2630110N16P的物质,请你分析:上述哪个河段最有可能出现藻类大量繁殖?___________________。(填编号)
(5)请你举出一种防止水体污染的措施:________________________。
六、计算题:(6分)
18.(6分)学习了酸和碱的知识后,小强知道了白醋的主要成分是醋酸(CH3COOH)。为了测定白醋中醋酸的质量分数,他把4%的NaOH溶液滴加到30 g白醋中,待反应恰好完全时(假定其他成分不参加反应),共用去NaOH溶液25 g。
(1)已知反应的化学方程式为:CH3COOH+NaOH=CH3COONa+H20,该反应的类型是____________。
(2)请计算白醋中醋酸的质量分数。
【趣味化学】
“新龟兔赛跑”巧记元素名称
同学们,你们都熟悉“龟兔赛跑”的故事吧。兔子在比赛中大意失荆州,输给了乌龟。从此,兔子在众人的嘲笑声中艰难度日,他卧薪尝胆,刻苦训练,发誓一定要在第二场比赛中赢回来。乌龟也不敢怠慢,他比以前训练得更认真了。可是,意想不到的事情发生了,在一次训练中,乌龟脚腱断裂,他再也无法上训练场去训练了,整天只能靠轮椅度日。兔子听说了这个消息后,非常难过,由于失去了竞争对手,他也宣布退役了。于是它们不再竞争了,却成为了最好的朋友,他们互相关爱对方,都为曾经嘲笑过对方而感到羞愧,并真诚地向对方道歉。乌龟虽然瘫痪了,可由于兔子的精心照料,身体还是养得棒棒的;兔子呢,一刻也没闲着,每天都把乌龟家打扫得干干净净,水缸里、米缸里总是装得满满的。乌龟很是过意不去,执意要把自家专门拉米的那头驴子送给兔子。兔子心疼乌龟,揉着他那失去知觉的腿,说:“别的事您就别操心了,以后你下不了水,陆地上的风吹雨晒,您的皮肤哪能吃得消呢?得加个盖儿才行啊。”从此,乌龟身上就背上了重重的壳。
人们被深深地感动了,他们忘情地写出了一首诗来歌颂龟兔的友情:侵害礼陪朋,瘫但养弗赖;拉米驴归您,留陆要加盖。潭水千尺深,不及龟兔情。”转换成元素名称就是:“氢氦锂铍硼,碳氮氧氟氖,钠镁铝硅磷,硫氯氩钾钙。”而就恰恰就是1到20号元素的名称和顺序。同学们,你记住了吗?
【主题一:参考答案】
[基础训练]:1A、2B、3.C ;SiO2 ;Ag+ ;OH- 4.(1)Ar ( 2) Cl- (3) K+ (4) S2-
5.(1)混合物 (2)N2 ; O2 ; CO2 大量燃烧化石燃料
[能力测试]:1C、2A、3B、4B、5A 6. (1) (2) (3)K (4)
(5)HCl (6)
7.(1)AgCl(合理答案均给分) (2)CuSO4+Ba(OH)2=BaSO4↓+Cu(OH)2↓
(3)①A:Na2CO3 C:Na2SO4 ②Ba(OH)2或BaCl2或Ba(NO3)2
③Na2CO3+2HCl=2NaCl+CO2↑+H2O Na2CO3+2HNO3=2NaNO3+CO2↑+H2O
[单元检测]:1D、2A、3B、4C、5B、6C、7A、8D、9D、10A、
11.(每空1分,共8分。)
+2
(1)①2Ca2+ ②3SO42- ③ NO
(2)①CO、H2、C、CH4 ②N2 ③ CH3COOH ④ SO2 ⑤C、CH4
△
12.(5分)(1)Na ;7 ;(2)金属 ;NaF ;离子 。
13.(10分)(1)(2分)IO3- (2)Ca(OH)2(2分)2KMnO4===K2MnO4 + MnO2 + O2↑(2分)
(3)Zn(1分)(4)铁元素(1分)(5)NaHCO3(2分)
14.(7分) (1)①B ②A ③C(各1分) (2)①CH4 ②NH4HCO3 ③NaCl ④O2(各1分)
15.(1)Fe、Cu、C、Mg(本小题全对给4分,对2个或3个给2分)
(2)2Al+3FeCl2=3Fe+2AlCl3(3分) (3)CuO+H2SO4=CuSO4+H2O(3分)
16. (12分)(1)A、B、C(漏答不得分)(2分) (2)
(3)A(2分);①、②(2分)(4)① ②
17.(12分)(1)Hg、P、H、O (2)(B) (3)大量使用含磷洗涤剂或磷肥使用不当等;(4)C (5)工业污水或生活废水要处理达标后排放;合理使用农药、化肥;不使用含磷洗涤剂等等合理答案均可。
18.(6分)(1)中和反应(或复分解反应)(1分);
(2)解:设白醋中醋酸的质量分数为X
CH3COOH+NaOH=CH3COONa+H20
60 40
30g×X 25g×4%
X=60×25g×4%÷(40×30g)=5 % 答:(略)(共5分)
相关学案
这是一份30.初高中化学衔接——元素族的学习,共4页。学案主要包含了教材编排的意图分析,学习方法指导等内容,欢迎下载使用。
这是一份17.初高中化学衔接——实验的设计与评价,共11页。
这是一份31.初高中化学衔接——原子结构,共8页。学案主要包含了课程目标,学海导航,例题解析,强化训练,参考答案等内容,欢迎下载使用。