6.初高中化学衔接——核外电子排布的初步知识-学习元素周期律的基础
展开这是一份6.初高中化学衔接——核外电子排布的初步知识-学习元素周期律的基础,共4页。学案主要包含了选择题,核外电子是分层排布的等内容,欢迎下载使用。
初高中化学衔接——核外电子排布的初步知识-学习元素周期律的基础
第一部分:知识点讲解
知识点1:了解核外电子排布的初步知识
氢原子的原子核有一个质子,核外有一个电子,它在核外一定距离的空间内高速运动。在含有多个电子的原子里,电子的能量并不相同。能量低的,通常在离核近的区域运动。能量高的,通常在离核远的区域运动。我们把电子在核外远近不同的运动区域叫做电子层,能量最低、离核最近的叫第一层,能量稍高、离核稍远的叫第二层,由里往外依次类推,分别叫做第三、四、五……层。由此可见,核外电子是在能量不同的电子层上运动的,也就是说:核外电子是分层排布的。
知识点2:掌握1—18号元素原子结构示意图的书写
用圆圈表示原子核,在圆圈内用正数表示质子数(或核电荷数),用弧线表示电子层,用弧线上的数字表示该电子层的电子数。
第二部分:教材分析和处理建议
初中教材要求:1.知道原子是由原子核和核外电子构成的。
2.能根据原子序数在元素周期表中找到指定的元素。
高中要求:
在高中化学第一册第五章第一节中,要求学生熟悉1—18号元素原子结构示意图,从而顺利得出核外电子排布规律。
建议:
补充核外电子排布的初步知识及1—18号元素原子结构示意图的书写,使学生熟练掌握1—18号元素原子结构示意图,以便顺利转入核外电子排布规律的学习。
第三部分:教案
知识目标:
1.了解原子的核外电子是分层排布的。
2.了解原子结构示意图的涵义,掌握1—18号元素原子结构示意图的书写
能力目标:培养学生的观察能力和抽象思维能力。
情感、态度与价值观:1、展现自我 2、互相讨论,学会合作
教学重点 :原子的核外电子是分层排布的
教学难点:1—18号元素原子结构示意图的书写
教学方法:问题解决法和讨论法。
教学过程:
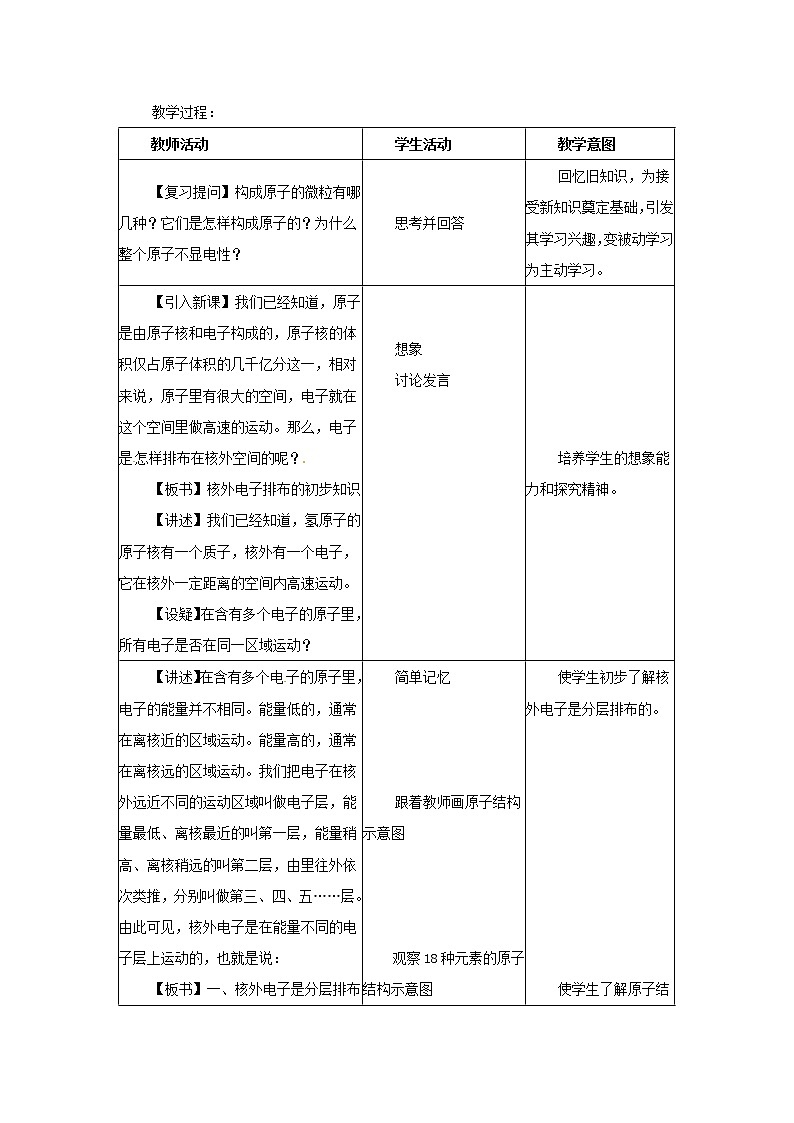
教师活动 [来源:Zxxk.Com] | 学生活动 | 教学意图 |
【复习提问】构成原子的微粒有哪几种?它们是怎样构成原子的?为什么整个原子不显电性? | 思考并回答 | 回忆旧知识,为接受新知识奠定基础,引发其学习兴趣,变被动学习为主动学习。 |
【引入新课】我们已经知道,原子是由原子核和电子构成的,原子核的体积仅占原子体积的几千亿分这一,相对来说,原子里有很大的空间,电子就在这个空间里做高速的运动。那么,电子是怎样排布在核外空间的呢? 【板书】核外电子排布的初步知识 【讲述】我们已经知道,氢原子的原子核有一个质子,核外有一个电子,它在核外一定距离的空间内高速运动。 【设疑】在含有多个电子的原子里,所有电子是否在同一区域运动? | 想象 讨论发言
| 培养学生的想象能力和探究精神。 |
【讲述】在含有多个电子的原子里,电子的能量并不相同。能量低的,通常在离核近的区域运动。能量高的,通常在离核远的区域运动。我们把电子在核外远近不同的运动区域叫做电子层,能量最低、离核最近的叫第一层,能量稍高、离核稍远的叫第二层,由里往外依次类推,分别叫做第三、四、五……层。由此可见,核外电子是在能量不同的电子层上运动的,也就是说: 【板书】一、核外电子是分层排布的。 【引入】如何表示核外电子的分层排布? 【板书】二、原子结构示意图 【讲述】用圆圈表示原子核,在圆圈内用正数表示质子数(或核电荷数),用弧红表示电子层,用弧线上的数字表示该电子层的电子数 【投影】核电荷数从1到18的元素的原子结构示意图
讨论 1. 每一电子层上最多容纳的电子数是多少? 讨论2.最外层电子数是多少? 【板书】 1.每一电子层上最多容纳电子2n2 2.最外层电子数不能超过8个(K层不超过2个),次外层不能超过18个,倒数第三层不能超过32个 练习: 根据观察所得结论,书写1—18 号元素原子结构示意图 课堂练习一 1.原子核外电子是按__________、________排布的。 3.下列微粒中,最外电子层不是稳定结构的是 ( ) C.镁离子 D.硫离子 4.某元素的微粒最外电子层有8个电子,该微粒 ( ) C. 是阴离子 D. 无法确定 | 简单记忆
跟着教师画原子结构示意图 [来源:学|科|网Z|X|X|K]
观察18种元素的原子结构示意图
讨论并回答 | 使学生初步了解核外电子是分层排布的。
[来源:学§科§网]
使学生了解原子结构示意图的涵义
培养学生的观察能力。
培养学生的应用能力 |
第四部分 练习题
一、 填空题
1.核外电子是按能量高低的不同 排布的。能量高的,通常在离核 运动。把能量最低,离核最近的叫 。
2 C原子L层上的电子数等于次外层上的电子数、电子层数,C是 元素。
3.质子数为13,核外有10个电子的微粒的符号和结构示意图是 。
二、选择题
1.某原子的原子核外第三电子层与第一层电子数相等,则该原子的质子数为( )
A. 20 B.14 C.12 D.10
2.某元素的核电荷数为Z,其带2个单位负电荷的阴离子的核外电子数为m,下列关系中正确的是()
A.Z=m B.Z=m+2 C.Z=m-2 D.Z+m=2
3元素X的最外层有3个电子,元素Y的最外层有7个电子,由这两种元素组成的化合物的化学式可能是()[来源:学科网ZXXK][来源:学&科&网]
4原子核外的M电子层和L电子层最多容纳的电子数的关系是
A、大于 B、小于 C、等于 D不能确定
相关学案
这是一份30.初高中化学衔接——元素族的学习,共4页。学案主要包含了教材编排的意图分析,学习方法指导等内容,欢迎下载使用。
这是一份28.初高中化学衔接——氧化物-对比学习过氧化钠,共5页。
这是一份31.初高中化学衔接——原子结构,共8页。学案主要包含了课程目标,学海导航,例题解析,强化训练,参考答案等内容,欢迎下载使用。