


高中化学人教版 (2019)选择性必修2第一节 原子结构图文ppt课件
展开思考:宏观物体与微观粒子(电子)的运动区别
可以准确测出宏观物体在某一时刻所处的位置及速度;可以描画出其运动轨迹。
微观粒子(电子)的运动特征:
电子质量很小,运动速度很大(接近光速);无确定的运动轨道;不可能同时准确地测定电子在某一瞬间所处的位置和速度。但可以用统计的方法讨论电子在核外空间某处出现的概率大小。
测不准原理:Δx●Δp≥h/4π
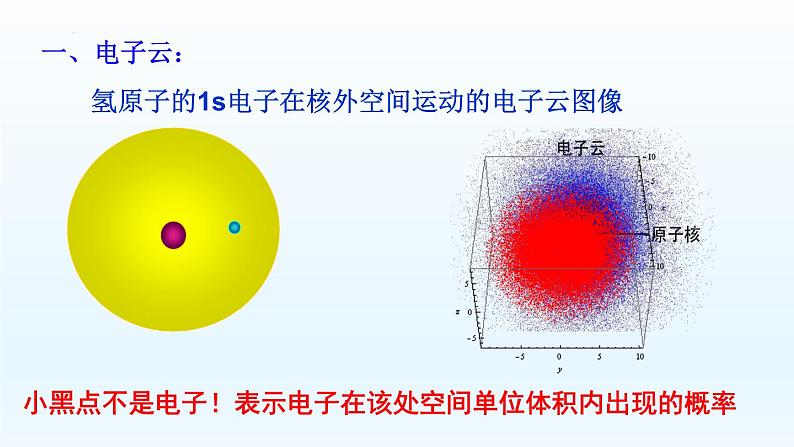
1.概念: 核外电子的运动没有确定轨道,电子在核外空间各处都可能出现,但出现的概率不同。 电子在核外空间某处单位体积内出现的概率大小叫概率密度,用ρ表示,则电子在某处出现的概率P = ρ×V。 如果用小黑点的疏密表示电子在核外空间各处的概率密度大小,所得的图形为电子云。电子云越浓密,说明电子在该处出现的概率越大,因此电子云是电子在核外空间出现概率密度分布的形象化描述。
氢原子的1s电子在核外空间运动的电子云图像
小黑点不是电子!表示电子在该处空间单位体积内出现的概率
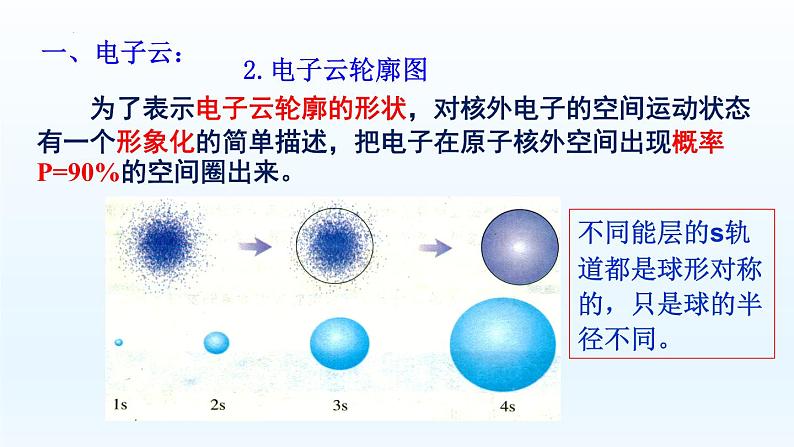
为了表示电子云轮廓的形状,对核外电子的空间运动状态有一个形象化的简单描述,把电子在原子核外空间出现概率P=90%的空间圈出来。
不同能层的s轨道都是球形对称的,只是球的半径不同。
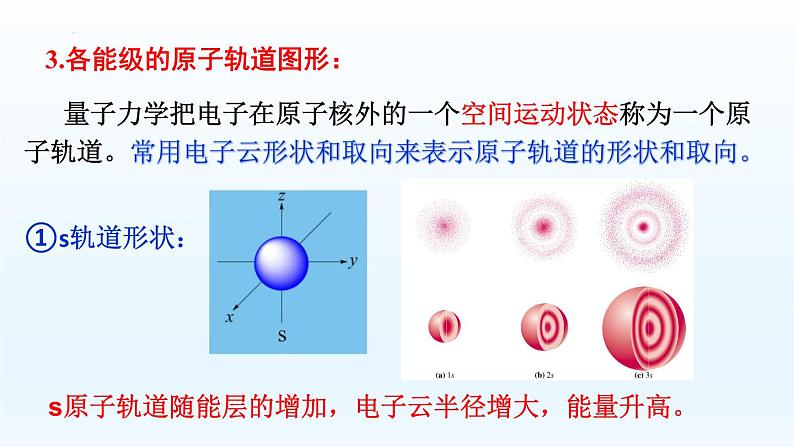
3.各能级的原子轨道图形:
量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。常用电子云形状和取向来表示原子轨道的形状和取向。
s原子轨道随能层的增加,电子云半径增大,能量升高。
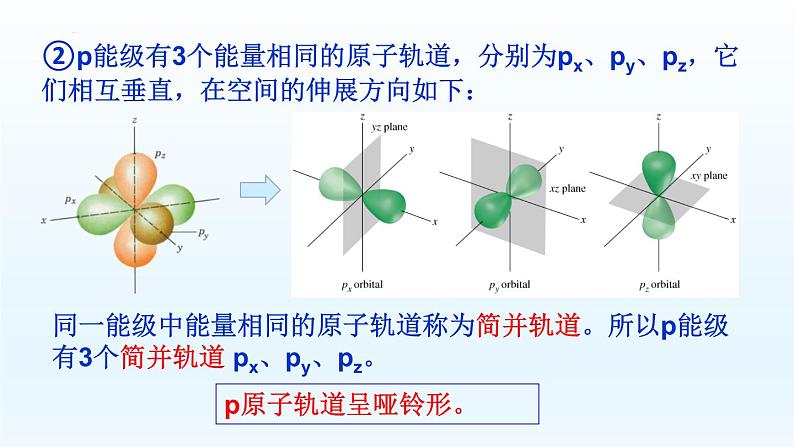
②p能级有3个能量相同的原子轨道,分别为px、py、pz,它们相互垂直,在空间的伸展方向如下:
同一能级中能量相同的原子轨道称为简并轨道。所以p能级有3个简并轨道 px、py、pz。
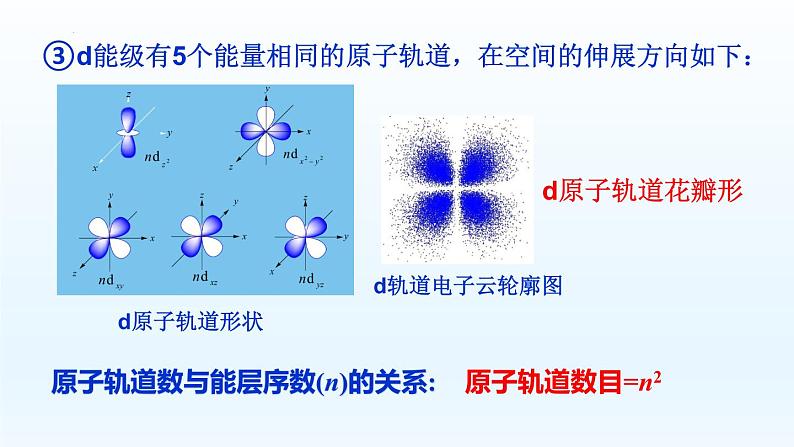
③d能级有5个能量相同的原子轨道,在空间的伸展方向如下:
原子轨道数与能层序数(n)的关系:
一个原子轨道最多只能容纳2个电子,且自旋方向相反。
即在同一个原子中没有运动状态完全相同的2个电子。
1925年乌伦贝克和古兹密特提出电子的自旋假设,认为电子除了绕核运动外,还有自旋运动且具有自旋角动量。 电子自旋是电子的基本性质之一,属于电子的内在属性。但不能作经典理解,如把电子自旋看成绕轴旋转,则得出与相对论矛盾的结果。
电子自旋在空间有顺时针和逆时针两种取向,简称自旋相反,常用上下箭头(↑和↓)表示自旋相反的电子。
电子的运动状态由能层、能级、原子轨道和自旋状态四个因素共同决定;电子能量与能层、能级有关;电子运动的空间范围与原子轨道有关 。
一个原子中不可能存在运动状态完全相同的2个电子
基态原子中,电子排布到能量相同的简并轨道时,尽可能分别占据不同轨道,且自旋平行。
这种排布方式总能量最低。
洪特规则的补充:能量相同的简并轨道在全充满、半充满或全空的状态是比较稳定的。体系的能量最低。
洪特规则是对电子填入简并轨道而言的
电子尽可能占据能量最低的原子轨道,使整个原子的能量最低。
所有电子排布规则都需要满足能量最低原理。
相邻能级能量相差很大时,电子填入能量低的能级即可使整个原子能量最低(如所有主族元素的基态原子);而当相邻能级能量相差不太大时,有1~2个电子占据能量稍高的能级可能反而降低了电子排斥能而使整个原子能量最低(如所有副族元素的基态原子)。
六、电子排布的轨道表示式:
轨道表示式(又称电子排布图)是表述电子排布的一种图式。
电子在核外的排布要遵循三个原则,即泡利不相容原理、洪特规则和能量最低原理。
①在轨道表示式中,用方框(或圆圈)表示原子轨道;②能量相同的原子轨道(简并轨道)的方框相连;③箭头表示一种自旋状态的电子,“↑↓”称电子对,“↑”或“↓”称单电子(或称未成对电子)。箭头同向的单电子称自旋平行。通常应在方框下方或上方标记能级符号
练习1:写出B、C、N、O、O2-的轨道表示式。
练习2:Si、P、S、Cl-的价层电子的轨道表示式。
练习3:Cr、Fe、Cu、Fe2+和Zn2+的价层电子的轨道表示式。
练习4:写出碳原子的电子式、原子结构示意图、核外电子排布式、电子排布图(轨道表示式)。
5.正误判断,正确的打“√", 错误的打“x"。(1)从空间角度看,2s轨道比1s轨道大,其空间包含了1s轨道( )(2) P能级能量一定比s能级的能量高( )(3) 2p、3p、4p能级的轨道数依次增多( )(4) 2p和3p轨道形状均为哑铃形( )(5) 2px、2py、 2pz轨道相互垂直,但能量相等( )(6) p轨道呈哑铃形,因此p轨道上的电子运动轨迹呈哑铃形。( )
6.下列电子排布式或轨道表示式正确的是( )A.C的轨道表示式:B.Ca的电子排布式:1s22s22p63s23p63d2C.N的轨道表示式:D.Br-的电子排布式:[Ar]3d104s24p6
高中化学人教版 (2019)选择性必修2第一章 原子结构与性质第一节 原子结构课前预习课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第一章 原子结构与性质第一节 原子结构课前预习课件ppt,共19页。PPT课件主要包含了情境导入,宏观物体的运动轨迹,核外电子的运动,很快接近光速,不可确定,核外电子的运动特点,薛定谔方程,目标一电子云,概率密度,电子云概念等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第一节 原子结构教学ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第一节 原子结构教学ppt课件,共48页。PPT课件主要包含了课前·新知导学,概率密度,哑铃状,空间运动状态,原子轨道,单独分占,课堂·重难探究,重难突破,典例精练,课堂小结等内容,欢迎下载使用。
化学选择性必修2第一节 原子结构优秀习题ppt课件: 这是一份化学选择性必修2第一节 原子结构优秀习题ppt课件,共26页。PPT课件主要包含了电子云,原子轨道,知识回顾,电子云与原子轨道,微观运动的不同,S能级的原子轨道,P能级的原子轨道,d能级原子轨道有5个,f能级原子轨道有7个等内容,欢迎下载使用。













