



2021学年第一章 原子结构与性质第二节 原子结构与元素的性质图文课件ppt
展开
这是一份2021学年第一章 原子结构与性质第二节 原子结构与元素的性质图文课件ppt,共30页。PPT课件主要包含了非金属性逐渐增强,金属性逐渐增强,非金属区,金属区,族元素,思考讨论等内容,欢迎下载使用。
问题1:什么是元素周期律?本质是什么?
概念:元素的性质随着原子序数递增发生周期性递变的规律。
本质:元素原子核外电子排布的周期性变化。 元素周期表是元素周期律的表现。
问题2:元素的性质包含哪些?
元素化合价、金属性和非金属性、原子半径、电离能、电负性
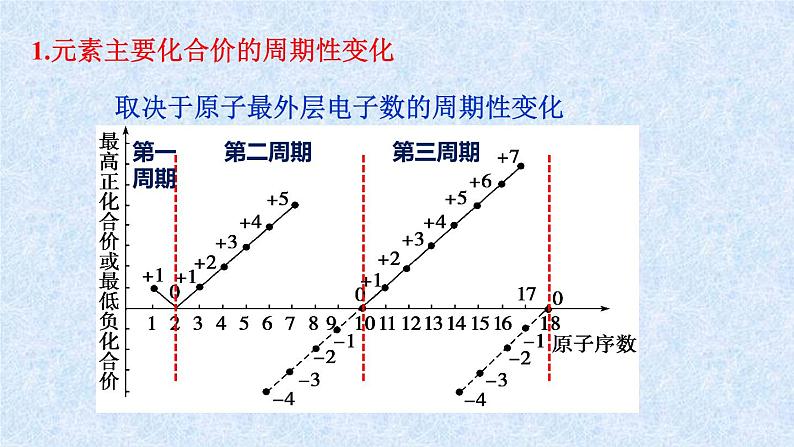
1.元素主要化合价的周期性变化
取决于原子最外层电子数的周期性变化
①同周期从左到右:最高正价+1→+7;最低负价-4 → -1 → 0; (O和F无最高正价)
③非金属:最高正价+|最低负价|=8 (H、O、F除外)
②最高正价=主族序数=最外层电子数(O、F除外)
金属无负价;H最高价为+1最低价为-1;O无最高正价,最低价为-2;F无正化合价,最低价为-1。
写出ⅣA、ⅤA、ⅥA、ⅦA族元素的氢化物和最高价氧化物对应的水化物的通式。
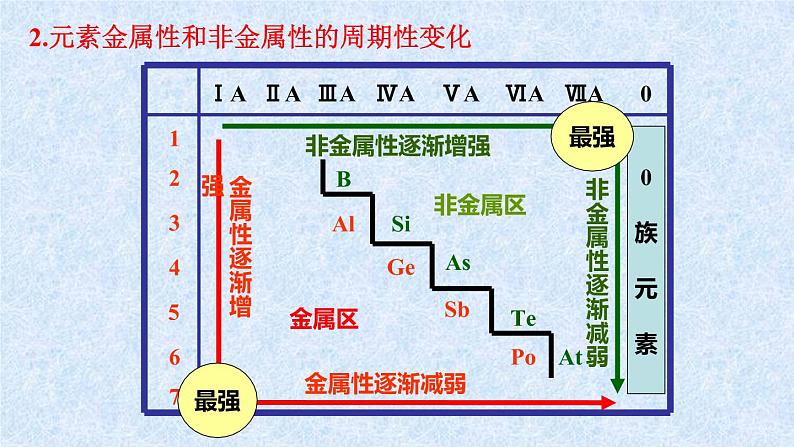
金属性逐渐减弱
非金属性逐渐减弱
2.元素金属性和非金属性的周期性变化
3.原子半径的周期性变化
电子在核外运动没有固定轨道,只是概率分布不同,因此原子没有一个明确的界面。人们假定原子呈球体,借助相邻原子的核间距来确定原子半径。根据原子之间的作用力不同,将原子半径分为共价半径、金属半径、范德华半径。
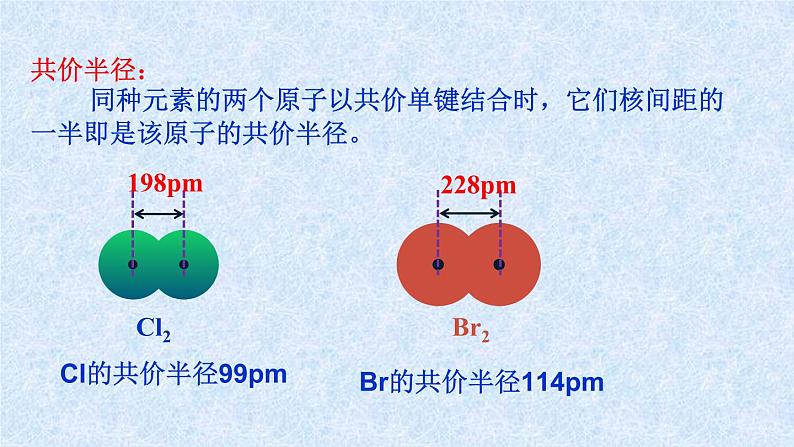
共价半径: 同种元素的两个原子以共价单键结合时,它们核间距的一半即是该原子的共价半径。
Cl的共价半径99pm
Br的共价半径114pm
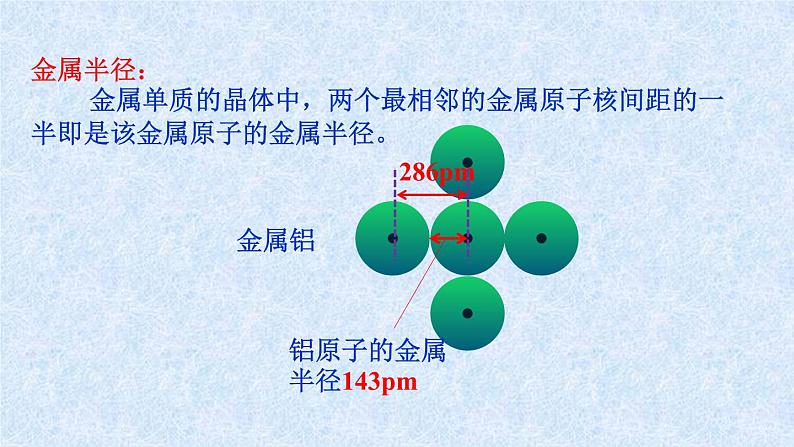
金属半径: 金属单质的晶体中,两个最相邻的金属原子核间距的一半即是该金属原子的金属半径。
范德华半径: 稀有气体原子之间以范德华力相互接近,低温下稀有气体单质在以晶体存在时,两个相邻原子核间距的一半即是范德华半径。
同一周期能层数相同,核电荷数增加占主导因素,电子的增加不足以完全屏蔽所增加的核电荷。
能层数增加占主导因素,核电荷的增加不足以抵消能层数的增加。
1.先看能层数,一般能层数越多,半径越大。
原子半径:Cs>Rb>K>Na>Li>H 离子半径:Cs+>Rb+ > K+>Na+>Li+>H+
2.若能层数相同,核电荷数越大,半径越小。
如原子半径:Na >Mg>Al>Si
3.核外电子排布(或电子层结构)相同时,核电荷数越大,半径越小。
N3->O2->F->Na+>Mg2+>Al3+
4.同种元素的单核微粒,电子数越多半径越大。
Fe>Fe2+>Fe3+
4.电离能的周期性变化
气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫第一电离能。用I1表示。
从+1价离子再失去一个电子形成+2价离子时,所需要的能量叫第二电离能,用I2表示。以此类推。 同一元素原子的各电离能大小:I1 < I2 < I3 电离能的单位:KJ/ml
衡量元素原子失电子难易程度。第一电离能I1越小,原子越容易失去一个电子;元素的金属性也越强。
M(g)= M+ (g) + e- I1(第一电离能)
M+(g)= M2+ (g) + e- I2(第二电离能)
③元素第一电离能变化规律
同一族,从上到下第一电离能逐渐减小。
原因:同一族从上到下原子半径逐渐增大,原子核对外层电子的吸引力减弱,电子逐渐易于失去,电离能减小。
同一周期,第ⅠA族的第一电离能最小,稀有气体的第一电离能最大。即同一周期从左到右,第一电离能整体上呈增大趋势。
原因:同一周期从左到右,随着核电荷数增多和原子半径减小,原子核对外层电子的吸引力增大,第一电离能呈增大趋势。
同一周期从左到右,第一电离能整体上呈增大趋势,但有反常现象出现。
反常的原因:ⅡA族元素的价电子排布为ns2,p轨道为全空状态,比较稳定。ⅤA族元素的价电子排布为ns2np3,p轨道为半充满状态,比较稳定。这使得它们不易失去电子,第一电离能较大。
第一电离能反常:ⅡA>ⅢA ;ⅤA>ⅥA
为什么原子的逐级电离能越来越大?
原子失去电子形成阳离子后,有效核电荷数增加,且半径减小,使得原子核对外层电子的吸引力更强,所以原子的逐级电离能越来越大。
这些数据与钠、镁、铝的化合价有什么关系?
钠的第一电离能较小,为496KJ/ml ,但第二电离能增大了接近十倍,为4562KJ/ml,说明Na容易失去一个电子形成Na+;镁的第一、第二电离能较低且相差不多,但第三电离能比第二电离能大了数倍,说明Mg容易失去两个电子形成Mg2+;铝的第一、第二、第三电离能相差不多,但第四电离能比第三电离能大数倍,说明Al容易失去三个电子形成Al3+。
Na→Na+ Mg→Mg2+ Al→Al3+
练习1.正误判断(1)第一电离能越大的原子失电子的能力越强( )(2)第三周期所含元素中钠的第一电离能最小( )(3)铝的第一电离能比镁的第一电离能大( )(4)H的第一电离能大于C的第一电离能( )(5)在所有元素中,氟的第一电离能最大( )(6)同一周期中,主族元素原子的第一电离能从左到右越来越大( )(7)同一周期典型金属元素的第一电离能总是小于典型非金属元素的第一电离能( )
练习2.根据右列五种元素的电离能数据判断下列说法不正确的是( )A.Q元素可能是0族元素B.R和S均可能与U在同一主族C.U元素可能在元素周期表的s区D.原子的价电子排布式为ns2np1的可能是T元素
若In→In+1的值出现突跃,说明最外层有n个电子
5.电负性的周期性变化
①键合电子:元素相互化合时,原子之间产生的化学作用力,叫化 学键,原子中用于形成化学键的电子称为键合电子。
②电负性:用来描述不同元素的原子对键合电子吸引力的大小。 电负性越大,原子对键合电子的吸引力越大。
③衡量标准:以氟的电负性为4.0,锂的电负性为1.0作为相对标准, 得出了各元素的电负性(稀有气体未计)。 电负性是相对值,没单位。
①同一主族:从上到下,元素的电负性逐渐减小,说明原子吸电子能力减弱。
②同一周期:从左到右,元素的电负性逐渐增大,说明原子吸电子能力增强。
③金属元素的电负性较小,一般小于1.8; 非金属元素的电负性较大,一般大于1.8。
位于非金属三角区边界的“类金属”,电负性在1.8左右,既有金属性,又有非金属性。
④用电负性判断元素的金属性和非金属性强弱
电负性越大,元素的非金属性越强,电负性越小,元素的非金属性越弱。
⑤用电负性判断化合物中元素的化合价
电负性小的元素在化合物中显正价。电负性大的元素在化合物中显负价
⑥用电负性判断化学键的类型
一般电负性差值>1.7为离子键;电负性差值
相关课件
这是一份化学选择性必修2第二节 原子结构与元素的性质授课ppt课件,共60页。PPT课件主要包含了知识点一,知识点一原子半径,知识点二,知识点二电离能,气态电中性基态,一个电子,最低能量,知识点三,知识点三电负性,化学键等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修2第一章 原子结构与性质第二节 原子结构与元素的性质教学演示课件ppt,共23页。PPT课件主要包含了学习目标等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修2第二节 原子结构与元素的性质教学ppt课件,共23页。PPT课件主要包含了旧知回顾,卤素的化学性质,元素非金属性减弱,元素金属性逐渐增强,元素非金属性逐渐减弱,键合电子,电负性,第二周期,第三周期,第四周期等内容,欢迎下载使用。










