



所属成套资源:【新教材】-2022学年高一下学期化学人教版(2019)必修二同步习题(有答案)
- 【2019新人教版化学】(拔高篇)必修二5.3(化学) 课件 课件 0 次下载
- 【2019新人教版化学】(拔高篇)必修二5.2.2(化学) 课件 课件 0 次下载
- 【2019新人教版化学】(拔高篇)必修二5.2.1(化学) 课件 课件 0 次下载
- 5.3 无机非金属材料-2021-2022学年高一化学同步精品课件+教学设计+学案+课堂练习+课后练习+同步习题2套(有答案)(新教材19年人教版必修第二册) 课件 5 次下载
- 5.2.3 硝酸 酸雨及防治-2021-2022学年高一化学同步精品课件+教学设计+学案+课堂练习+课后练习+同步习题2套(有答案)(新教材19年人教版必修第二册) 课件 2 次下载
人教版 (2019)必修 第二册第二节 氮及其化合物教学演示ppt课件
展开
这是一份人教版 (2019)必修 第二册第二节 氮及其化合物教学演示ppt课件,共60页。PPT课件主要包含了溶液变,NO2,②强氧化性的表现,SO2等内容,欢迎下载使用。
一、硝酸的性质1.物理性质
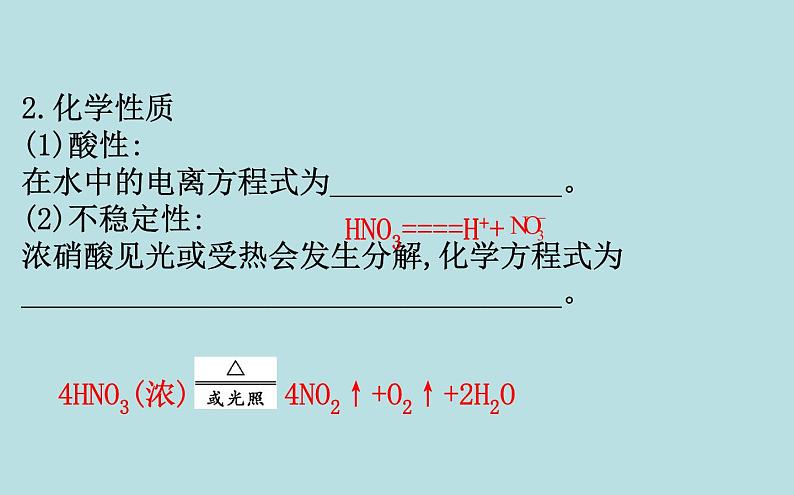
2.化学性质(1)酸性:在水中的电离方程式为_______________。(2)不稳定性:浓硝酸见光或受热会发生分解,化学方程式为___________________________________。
HNO3====H++
4HNO3(浓) 4NO2↑+O2↑+2H2O
【微思考】根据浓硝酸的性质分析浓硝酸应该如何保存?提示:浓硝酸见光或受热易分解,故浓硝酸应保存在棕色试剂瓶中,并放置在阴凉处。
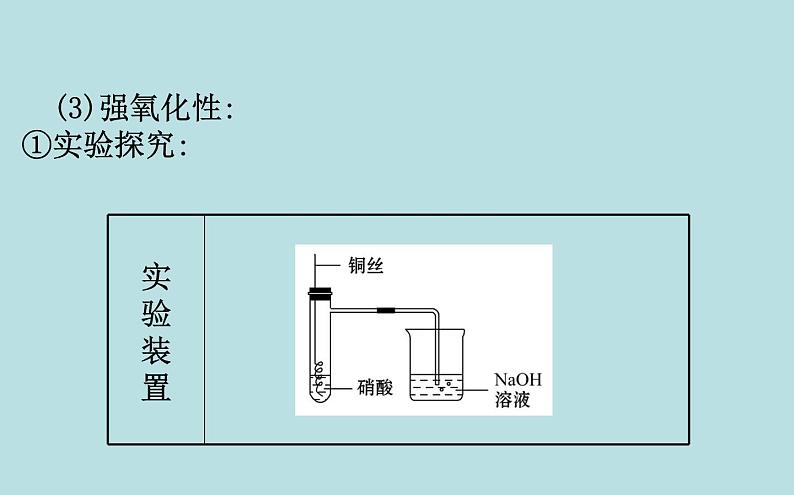
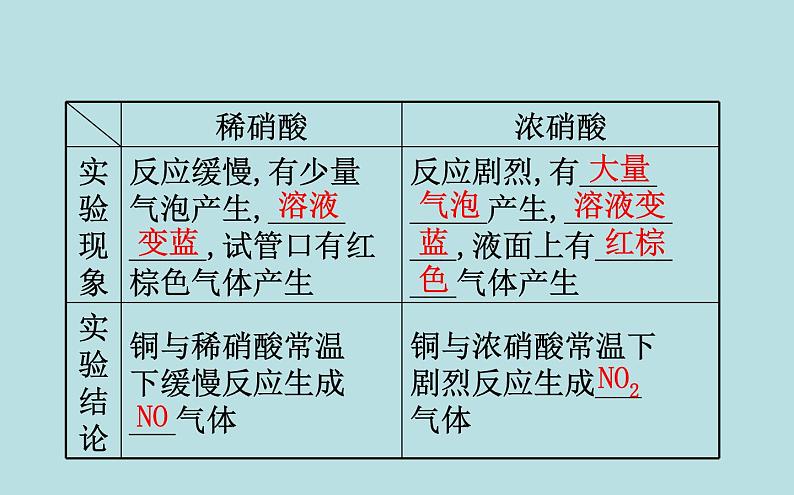
(3)强氧化性:①实验探究:
【巧判断】(1)硝酸的浓度越大,其氧化性越强。( )提示:√。由铜与浓、稀硝酸反应的剧烈程度可知,硝酸的浓度越大氧化性越强。(2)铜与浓硝酸反应只能生成二氧化氮气体。( )提示:×。铜与浓硝酸反应开始生成NO2气体,但随硝酸浓度减小,会生成NO气体。
(3)在铜与硝酸的反应中硝酸只表现氧化性。( )提示:×。铜与硝酸反应中有NO2(或NO)生成,又有硝酸铜生成,硝酸既表现氧化性又表现酸性。
写出下列有关反应的化学方程式:a.与金属反应:稀硝酸与铜反应:_____________________________________。浓硝酸与铜反应:___________________________________。
3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O
b.与非金属反应:浓硝酸与红热的C(被氧化为CO2)的反应为___________________________________________。
C+4HNO3(浓) CO2↑+4NO2↑+2H2O
【情境·思考】某同学在实验室取出一瓶浓硝酸,发现溶液显黄色,与教材中关于硝酸的描述出现偏差。
(1)你能帮助该同学解释一下原因吗? 提示:浓硝酸不稳定,见光或受热会分解生成NO2,NO2溶于浓硝酸使溶液显黄色。
(2)你能帮助该同学去除硝酸的黄色吗?提示:向浓硝酸中通入氧气(或空气),发生反应4NO2+O2+2H2O====4HNO3,消除黄色。
【情境·思考】 《本草纲目拾遗》记载:(硝酸)西洋人所造,性最猛,能蚀五金。王怡堂先生云:其水至强,五金八石皆能穿滴,惟玻璃可盛。
上述描述体现了硝酸的哪些性质呢?提示:酸性。
3.硝酸的用途与工业制法(1)用途:
(2)工业制法:①工业流程:
②写出有关化学方程式:N2→NH3: ____________________。NH3→NO: _______________________。NO→NO2: ______________。NO2→HNO3: ____________________。
N2+3H2 2NH3
4NH3+5O2 4NO+6H2O
2NO+O2====2NO2
3NO2+H2O====2HNO3+NO
二、酸雨及防治1.SO2与NO2的主要来源、危害和防治
2.酸雨(1)概念:pH
相关课件
这是一份高中化学人教版 (2019)必修 第二册第二节 乙烯与有机高分子材料备课ppt课件,共44页。PPT课件主要包含了空间结构,酸性高锰酸钾溶液褪色,原子或原子团,加成反应,聚合度,实验2,实验4等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第二册第二节 化学反应的速率与限度授课ppt课件,共60页。PPT课件主要包含了不再改变,最大程度,实际可能性,2一等一不变,课堂回眸,2具体实例等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第二册第一节 化学反应与能量变化背景图ppt课件,共60页。PPT课件主要包含了镁条逐渐溶解,有气泡产生,温度计的示数,木片黏,在烧杯上,放出热量,吸收热量,热量的释放和吸收,释放热量,2实例等内容,欢迎下载使用。









