




高中化学人教版 (2019)必修 第二册第一节 硫及其化合物教案配套ppt课件
展开
这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物教案配套ppt课件,共34页。PPT课件主要包含了0+4+6,硫单质,1物理性质,2化学性质,化合价,物质的类别,氢化物,氧化物,H2S,SO2等内容,欢迎下载使用。
【课程标准要求】 1.能从物质类别和硫元素化合价的角度认识硫和二氧化硫的性质。2.了解二氧化硫与水反应的可逆性,二氧化硫的漂白性及其与氯气漂白原理的不同。
S—硫 构成万臭之源的非金属
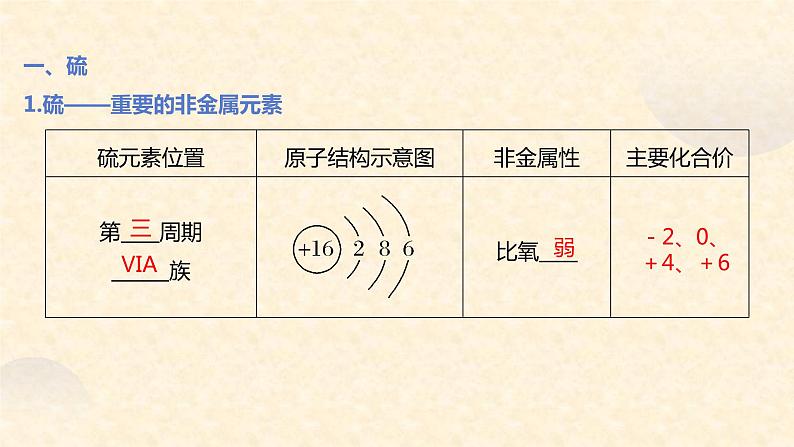
一、硫1.硫——重要的非金属元素
熔点:113℃沸点:445℃密度:2.06g/cm3
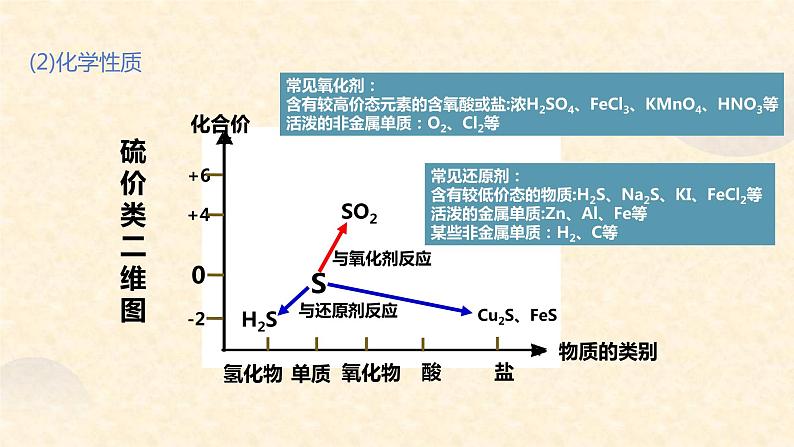
常见氧化剂:含有较高价态元素的含氧酸或盐:浓H2SO4、FeCl3、KMnO4、HNO3等活泼的非金属单质:O2、Cl2等
常见还原剂:含有较低价态的物质:H2S、Na2S、KI、FeCl2等活泼的金属单质:Zn、Al、Fe等某些非金属单质:H2、C等
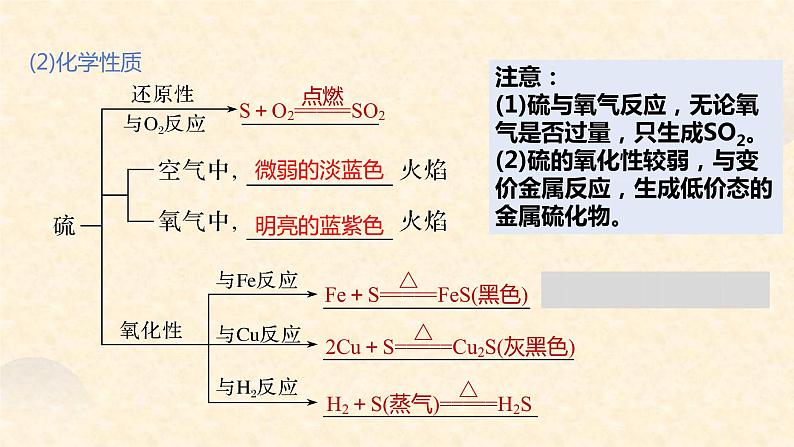
注意:(1)硫与氧气反应,无论氧气是否过量,只生成SO2。(2)硫的氧化性较弱,与变价金属反应,生成低价态的金属硫化物。
元素周期表中,S、Cl位于同一周期左右相邻,对比氯气与氢氧化钠溶液反应,从物质类别和化合价角度推测硫与氢氧化钠溶液的反应
S元素价态: -2 0 +4 +63S+6NaOH==2Na2S+Na2SO3+3H2O
(3)与碱反应(歧化反应)
Cl元素价态:-1 0 +1 +3 +5 +7Cl2+2NaOH==NaCl+NaClO+H2O
0 -1 +1
0 -2 +4
【微自测】1.下列描述中正确的打“√”,错误的打“×”。
(1)硫元素在自然界中只存在化合态,没有游离态( )(2)单质硫在纯氧中燃烧,其氧化产物为SO3( )(3)硫是一种非金属单质,与其他单质反应,只能作氧化剂( )(4)高价态的含硫物质要实现向低价态含硫物质转化,一定发生还原反应( )(5)硫和铁、铜在加热条件下生成Fe2S3和CuS( )(6)要洗涤试管壁上附着的硫单质,不能用水洗,可以用酒精洗涤( )
二、二氧化硫1.物理性质
2.二氧化硫的“四种性质”
SO2+Cl2+2H2O===2HCl+H2SO4
5SO2+2KMnO4+2H2O===2MnSO4+K2SO4+2H2SO4
SO2+2Fe3++2H2O===SO42-+2Fe2++4H+
二氧化硫常用作漂白剂、杀菌消毒剂、食品添加剂。
注意:(1)可逆反应中用可逆号“⇌”代替等号;(2)可逆反应中反应物与生成物同时存在。
【微自测】2.下列关于SO2的说法中,不正确的是( )
A.使某些有色物质褪色B.无色,有刺激性气味,无毒C.既有氧化性,又有还原性D.既可溶于水,又可与水反应
一、二氧化硫水溶液的性质实验探究
实验1:实验操作:把充满SO2、塞有橡胶塞的试管倒立在水中,在水面下打开橡胶塞,观察试管内液面的上升。取出试管,用pH试纸测定试管中溶液的酸碱度。实验装置:
———————【活动探究】———————
pH试纸变红,说明SO2溶于水显酸性
实验2:实验操作:用试管取2mL在实验1中得到的溶液,向其中滴入1~2滴品红溶液,振荡,观察溶液的颜色变化。然后加热试管,注意通风,再观察溶液的变化。实验装置:
品红溶液褪色,说明SO2有漂白性
溶液恢复红色,说明SO2的漂白是暂时性的
1.把充满SO2、塞有橡胶塞的试管倒立在水中,为什么在水下打开橡胶塞?提示:防止SO2逸出,保障实验效果。2.把充满SO2的试管倒立在水中,为什么试管内液面会上升?提示:试管内SO2易溶于水,使试管内压强减小,在大气压的作用下试管内液面上升。3.实验中用pH试纸测定试管中溶液的酸碱度,能否用石蕊溶液测定溶液的酸碱性?提示:能。SO2的水溶液能使石蕊变红,说明溶液呈酸性。4.SO2的水溶液中滴入品红溶液后加热试管时为什么要注意通风?提示:加热试管中的溶液时会逸出SO2,SO2有毒。
2.二氧化硫的化学性质
(1)SO2具有酸性氧化物的通性
(2)从元素化合价变化角度分析SO2性质(3)SO2的特性——漂白性
它能与某些有色物质(如品红溶液)生成不稳定的无色物质。这些无色物质容易分解而使有色物质恢复原来的颜色。
1.将SO2气体分别通入下列四种溶液中,有关现象及结论的说法正确的是( )
A.试管①中有淡黄色沉淀生成,说明SO2有氧化性B.试管②中溶液褪色,说明SO2有漂白性C.试管③中能产生白色沉淀,说明SO2有酸性D.试管④中溶液颜色变浅,说明SO2有还原性
———————【实践应用】———————
2.将SO2分别通入下列五种溶液中:
回答下列问题:(1)试管①中的实验现象:KMnO4溶液________,证明SO2具有________性。(2)试管②中的实验现象:溶液________,证明SO2具有________性。
(3)试管③中的实验现象:溶液________,证明SO2能与NaOH反应,写出该反应的离子方程式:_____________________________。(4)试管④中能产生________沉淀,该沉淀是________。(5)试管⑤中能产生白色沉淀,该沉淀是________。
SO2+2OH- == SO32-+H2O
二、常见漂白剂及漂白原理
SO2和Cl2的漂白性比较(1) (2)
1.某气体通入品红溶液中,溶液褪色,如何验证该气体是SO2,还是Cl2?提示:将褪色后的溶液加热,若能恢复原来颜色,则该气体是SO2 ;若不能恢复原色,则为Cl2。2.SO2和Cl2都能用于漂白,若将SO2和Cl2等物质的量混合通入品红溶液,能达到“强强联合”的漂白效果吗?提示:不能,因为SO2和Cl2会发生如下反应:SO2+Cl2+2H2O==H2SO4+2HCl,从而失去漂白效果。
3.“将SO2气体通入滴有酚酞的NaOH溶液中,溶液褪色”说明SO2有漂白性吗?提示:SO2不能漂白酸碱指示剂。SO2气体能使滴有酚酞的NaOH溶液褪色的原理是SO2与NaOH溶液反应使碱性变弱,并不是SO2具有漂白性。4.SO2可以使高锰酸钾溶液褪色和SO2使品红溶液褪色原理一样吗?分别体现了SO2的什么性质?提示:不一样;前者表现还原性,后者表现漂白性。
1.二氧化硫和新制氯水的漂白作用比较
———————【核心归纳】———————
2.常见漂白剂的漂白原理
3.下列变化可以说明SO2具有漂白性的是( )A. SO2通入溴水中,溴水褪色B. SO2通入酸性高锰酸钾溶液中,溶液的紫红色褪去C. SO2通入品红溶液中,溶液的红色褪去D. SO2通入滴有酚酞的氢氧化钠溶液中,溶液的红色褪去
4.某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
(1)①反应开始一段时间后,观察到B、D两支试管中的品红溶液出现的现象是B:________________,D:________________。②停止通气后,再给B、D两支试管分别加热,两支试管中的现象分别为B:_________________________,D:________________。
褪色的品红溶液又恢复红色
(2)相同条件下,若将SO2与Cl2按体积比1∶1混合后,再通入品红溶液,品红溶液能否褪色?________(选填“能”“不能”或“不能确定”)。其原因是_________________________________。(用离子方程式表示)
Cl2+SO2+2H2O==4H++2Cl-+SO42-
相关课件
这是一份人教版 (2019)必修 第二册第一节 硫及其化合物集体备课ppt课件,共35页。PPT课件主要包含了游离态,化合态,硫单质的物理性质,黄色晶体易研成粉末,硫单质的化学性质,价态观,与金属反应,与非金属反应,氧化性Cl2>S,硫单质的用途等内容,欢迎下载使用。
这是一份高中化学第一节 硫及其化合物教案配套课件ppt,共27页。PPT课件主要包含了SO2的化学性质,学习目标,重点难点,情景引入,第ⅥA族,物理性质,目标一硫,化学性质,②③④⑦⑧⑨⑩,沸点低易液化等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物课文配套ppt课件,共30页。PPT课件主要包含了学习目标,核心素养,1游离态,硫的存在,物理性质,原子结构,化学性质,Hg+SHgS,二氧化硫,SO2等内容,欢迎下载使用。









