




高中化学第2章 化学键 化学反应规律第1节 化学键与物质构成课文配套ppt课件
展开2.旧化学键破坏时要吸收能量(E1),新化学键形成时要释放能量(E2)。3.若E1>E2,则反应吸收能量;若E1
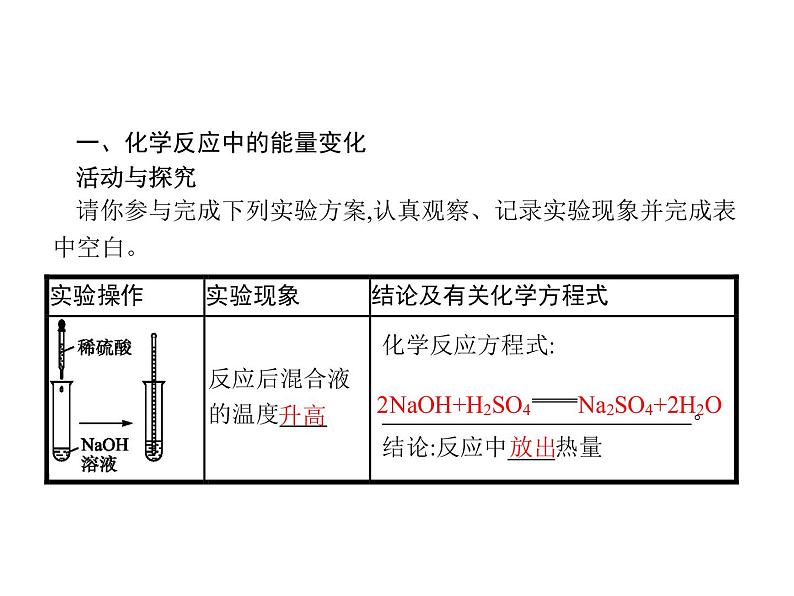
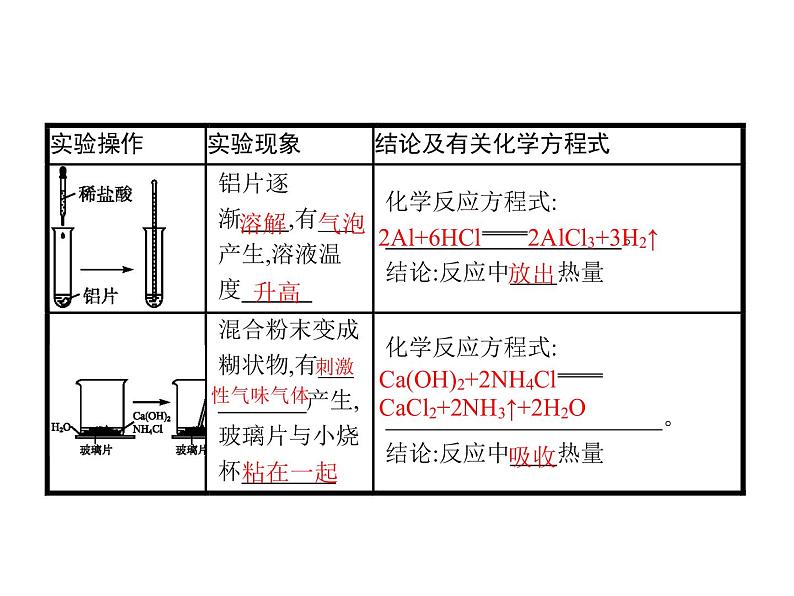
一、化学反应中的能量变化活动与探究请你参与完成下列实验方案,认真观察、记录实验现象并完成表中空白。
刺激性气味气体
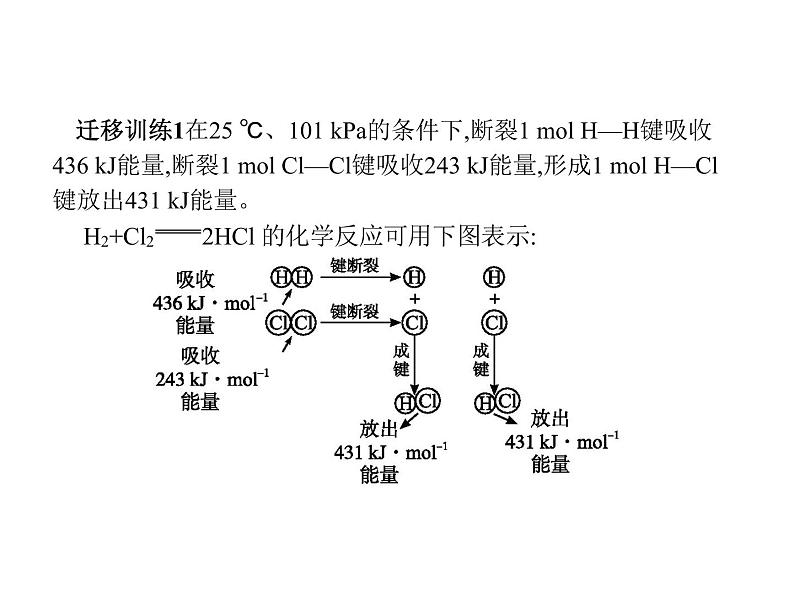
迁移与应用例1氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1 ml氢气中的化学键消耗的能量为Q1 kJ,破坏1 ml 氯气中的化学键消耗的能量为Q2 kJ,形成1 ml氯化氢中的化学键释放的能量为Q3 kJ。下列关系式中,正确的是( )A.Q1+Q2>Q3B.Q1+Q2>2Q3C.Q1+Q2
现有1 ml H2与1 ml Cl2反应生成2 ml HCl。请回答下列有关问题:(1)反应物断键吸收的总能量为 。 (2)生成物成键放出的总能量为 。 (4)反应物总能量 (填“>”或“<”)生成物总能量。 答案:(1)679 kJ (2)862 kJ (3)放热 (4)>
化学反应中能量变化的实质:化学反应是旧化学键断裂和新化学键形成的过程。旧化学键的断裂需要吸收能量,而新化学键的形成需要释放能量,因此,任何化学反应在生成新物质的同时必然都伴随着能量的变化。在化学反应过程中,最终是吸收能量还是释放能量,要看破坏旧化学键吸收的能量总和与形成新化学键释放出能量总和的相对大小。若破坏旧化学键吸收的能量总和大于形成新化学键释放出的能量总和,该反应表现为吸收能量;反之,该反应则表现为释放能量。如图:E1>E2,反应吸收能量;E1
二、吸热反应与放热反应的判断活动与探究思考下列问题:加热条件下进行的反应是否一定是吸收能量的反应?常温下进行的反应是否一定是释放能量的反应?答案:不一定。化学反应是吸热的还是放热的,与反应条件无关,而是取决于反应过程中破坏旧化学键吸收总能量与形成新化学键释放出总能量的相对大小。
迁移与应用例2下列各图中,表示吸热反应的是( )
解析:反应物的总能量大于生成物的总能量的反应为放热反应,反应物的总能量小于生成物的总能量的反应为吸热反应。答案:A
迁移训练2下列反应中,属于吸热反应的是( )A.实验室制H2的反应B.实验室制CO2的反应C.酸碱中和反应D.石灰石的分解反应答案:D
(1)从能量转化的角度认识化学反应:①任何一个化学反应,反应物所具有的总能量与生成物所具有的总能量是不会相等的。在新物质产生的同时总是伴随着能量的变化。②一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。反应物与生成物的能量差若以热能形式表现,即为放热或吸热。如果反应物所具有的总能量高于生成物所具有的总能量,反应为放热反应;如果反应物所具有的总能量低于生成物所具有的总能量,反应为吸热反应。如图:
(2)常见的放热反应:①所有的燃烧反应;②酸碱中和反应;③活泼金属与酸或水发生的置换反应;④大多数化合反应;⑤铝热反应。(3)常见的吸热反应:①Ca(OH)2、Ba(OH)2与NH4Cl固体的反应;②大多数的分解反应;
1.下列说法正确的是( )A.化学反应都伴随着能量的变化,通常表现为热量的变化B.需要加热的反应一定是吸收热量的反应C.水电解生成氢气和氧气的反应是吸热反应,又是分解反应,所以分解反应一定是吸收热量的反应D.放出热量的反应常温下易发生答案:A解析:化学反应中的能量变化通常表现为热量的变化,也可表现为光能或电能的变化,A项正确;反应是吸收还是放出能量,决定于反应物断键吸收的能量与形成生成物中的新键释放的能量的相对大小,与反应时是否加热或反应类型等无必然联系,B、C两项不正确;一个化学反应是否易发生与许多因素有关,放出热量的反应在常温下也不一定易发生,如燃烧反应等,D项不正确。
2.已知反应CH4(g)+2O2(g)CO2(g)+2H2O(g)为放热反应,则下列说法中正确的是( )A.反应过程中的能量变化关系可用右图表示B.甲烷燃烧时化学能转化为热能和光能C.断开反应物中旧化学键吸收的能量大于形成生成物中化学键放出的能量D.该反应发生断裂的化学键有离子键和共价键答案:B解析:此反应为放热反应,图中不能准确表示反应过程中的能量变化情况,A项错误;甲烷燃烧时化学能转化为热能和光能,B项正确;放热反应断开反应物中旧化学键吸收的能量小于形成生成物中化学键放出的能量,C项错误;该反应中只有共价键断裂,D项错误。
3.下列变化中属于吸热反应的是( )①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰A.①④B.②③C.①④⑤D.②④答案:D解析:①、③都不是化学反应;⑤是放热反应。特别注意:有些过程涉及热量变化,但不是化学反应。
5. 已知断开1 ml H—H键吸收的能量为436 kJ,形成1 ml H—N键放出的能量为391 kJ,根据化学方程式N2+3H2 2NH3,反应完1 ml N2放出的能量为92.4 kJ,则断开1 ml N≡N键需吸收的能量是( )A.431 kJB.945.6 kJC.649 kJD.869 kJ答案:B解析:设断开1 ml N≡N键需吸收的能量为x,根据反应放出的能量=形成新键放出的能量-断开旧键吸收的能量,代入数据:92.4 kJ=6×391 kJ-3×436 kJ-x,x=945.6 kJ。
高中化学鲁科版 (2019)必修 第二册第1节 化学键与物质构成评课课件ppt: 这是一份高中化学鲁科版 (2019)必修 第二册第1节 化学键与物质构成评课课件ppt,共30页。PPT课件主要包含了填写下表等内容,欢迎下载使用。
鲁科版 (2019)必修 第二册第1节 化学键与物质构成评课课件ppt: 这是一份鲁科版 (2019)必修 第二册第1节 化学键与物质构成评课课件ppt,共57页。PPT课件主要包含了NO1,NO2,学习任务1学习任务2,NO3等内容,欢迎下载使用。
化学必修2第三节 化学键教学演示课件ppt: 这是一份化学必修2第三节 化学键教学演示课件ppt,共38页。PPT课件主要包含了概念要点,a相邻,b原子之间,c强烈作用,化学键主要类型,a离子键,b共价键,钠在氯气中燃烧,氯化钠的形成过程,Cl-等内容,欢迎下载使用。













