





- 1.4《离子反应》课件+教案 课件 54 次下载
- 1.5《氧化还原反应》课件+教案 课件 62 次下载
- 1.7《氧化还原反应的配平》课件+教案 课件 42 次下载
- 2.1《金属钠的性质和应用》课件+教案 课件 39 次下载
- 2.2《碳酸钠和碳酸氢钠》教案+课件 课件 40 次下载
化学必修 第一册第二节 离子反应课前预习ppt课件
展开人教版化学科高一年必修一
《氧化剂和还原剂》教学设计
课题 | 氧化还原反应(第二课时) | 课型 | 新授课 |
教学目标 | 1认识并建立氧化剂和还原剂的概念。 | ||
2能正确判断电子的转移,用单线桥和双线桥进行表示。 | |||
3通过对氧化还原反应规律的认识,掌握氧化还原反应的应用。 | |||
教学重难点 | 重点:氧化剂和还原剂的判断、双线桥 | ||
难点:氧化还原反应的一些规律 | |||
教学环节 | 教学过程 | ||
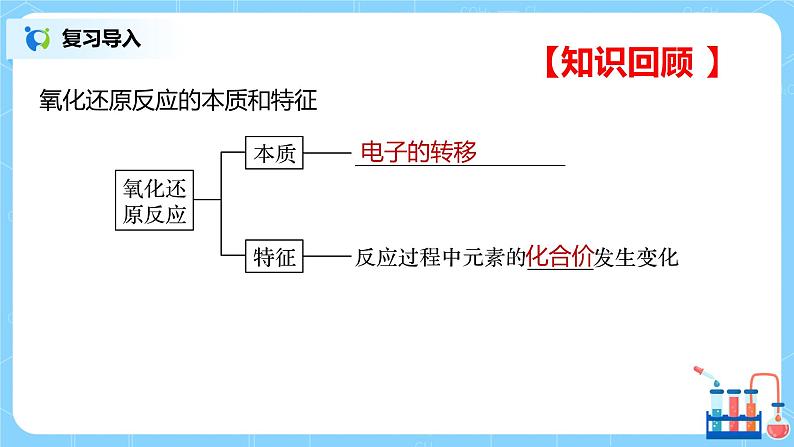
课堂导入 | 【导入】知识回顾:氧化还原反应的本质和特征 | ||
课
程
学
习
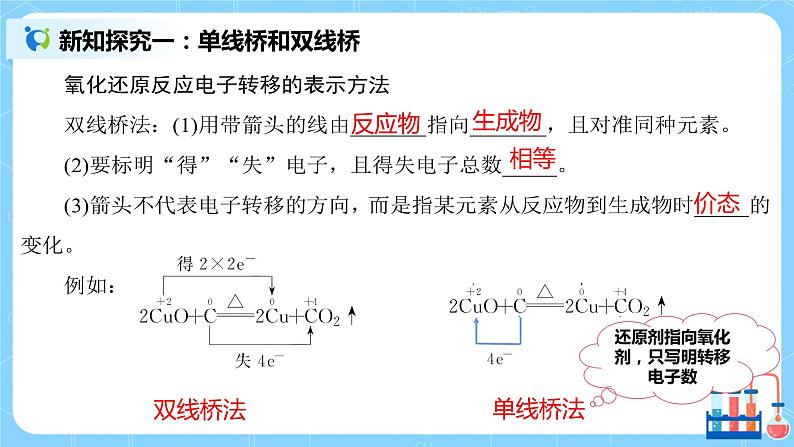
| 一、 单线桥和双线桥 双线桥法 单线桥法 【巩固提升】用双线桥表示下列反应的电子转移方向和数目 ①2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O ②MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 二、氧化剂和还原剂 1.
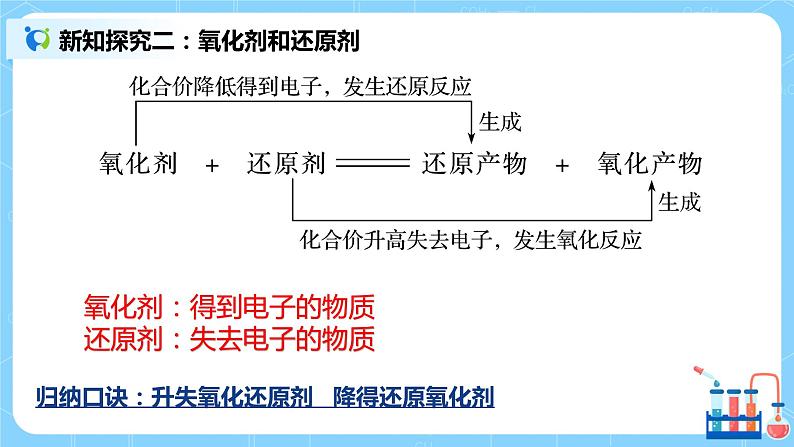
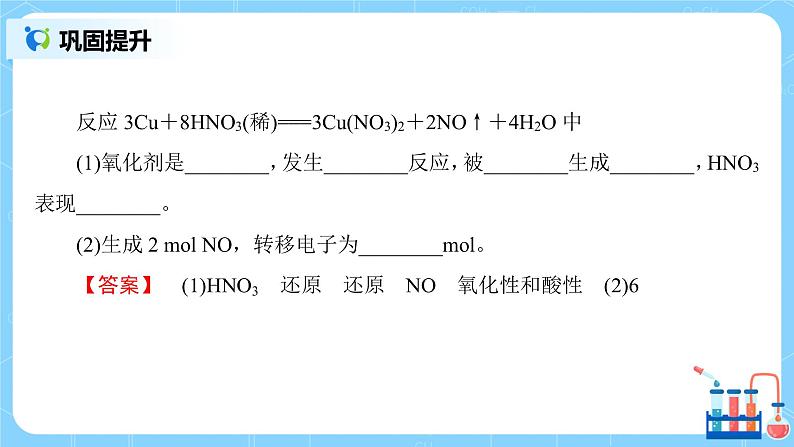
氧化剂:得到电子的物质 还原剂:失去电子的物质 归纳口诀:升失氧化还原剂 降得还原氧化剂 2【巩固提升】 反应3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O中 (1)氧化剂是________,发生________反应,被________生成________,HNO3表现________。 (2)生成2 mol NO,转移电子为________mol。
三、氧化还原反应的一些规律 1 性质强弱规律 2反应先后规律(强者优先) ① 一种氧化剂和多种还原剂发生反应,还原性强的先反应 ② 一种氧化剂和多种还原剂发生反应,还原性强的先反应 3 价态规律 最高价:只有氧化性;最低价:只有还原性; 中间价:既有氧化性又有还原性 同种元素化合价变化:不交叉只靠拢 KClO3+6HCl(浓) = KCl+ 3Cl2↑+ 3H2O 归中反应 注意:在同一个反应中,同种元素化合价的升降变化“过程不交叉”,例如,标为KClO3中+5价氯降到-1价,而HCl中 -1价氯升高到0价,则它们的化合价变化过程在-1到0之间就有交叉。 Cl2+H2O = HCl+ HClO 歧化反应 【巩固提升】在数轴上画出价态变化情况,并判断氧化剂、还原剂、氧化产物、还原产物 H2SO4(浓) +H2S= S + SO2+ 2H2O
四、课堂练习
| ||
课堂 小结 | 一、单线桥和双线桥 二、氧化剂和还原剂 三、氧化还原反应的一些规律 | ||
板书设计 | 氧化剂和还原剂 一、 单线桥和双线桥 双线桥法:①箭头跨过边,指向同种元素 ②标明得与失 ③ 标明电子数 二、 氧化剂和还原剂 氧化剂:得到电子的物质 还原剂:失去电子的物质 三、氧化还原反应的一些规律 | ||
教学反思 | 初步掌握氧化还原反应的概念及其本质后,氧化剂和还原剂的概念判断,需要反复练习进行巩固,其中结合氧化还原反应的一些规律,让学生能有拔高,进行深度挖缺,增加学习兴趣。 | ||
沪科技版(2020)必修第一册氧化剂和还原剂完整版ppt课件: 这是一份沪科技版(2020)必修第一册<a href="/hx/tb_c4025826_t3/?tag_id=26" target="_blank">氧化剂和还原剂完整版ppt课件</a>,文件包含222氧化剂和还原剂同步课件pptx、222氧化剂和还原剂分层练习原卷版docx、222氧化剂和还原剂分层练习解析版docx等3份课件配套教学资源,其中PPT共20页, 欢迎下载使用。
人教版 (2019)必修 第一册第三节 氧化还原反应优秀课件ppt: 这是一份人教版 (2019)必修 第一册<a href="/hx/tb_c161975_t3/?tag_id=26" target="_blank">第三节 氧化还原反应优秀课件ppt</a>,共34页。PPT课件主要包含了神奇的铁元素,对应训练等内容,欢迎下载使用。
苏教版 (2019)必修 第一册第一单元 氯气及氯的化合物精品ppt课件: 这是一份苏教版 (2019)必修 第一册第一单元 氯气及氯的化合物精品ppt课件,共24页。PPT课件主要包含了知识回顾,双线桥,单线桥,学习目标,氧化剂和还原剂,氧化剂,还原剂,新知探究,氧化反应被氧化,还原产物等内容,欢迎下载使用。














