





2020-2021学年第二节 水的电离和溶液的pH教学课件ppt
展开人教版化学选修一
《电离平衡常数》教学设计
课题名 | 电离平衡常数 | ||||||||||||||||||
教学目标 | 1.知道水的电离模型 2.能说出影响水的电离的因素 3.能利用水的离子积进行相关计算 | ||||||||||||||||||
教学重点 | 1.能说出影响水的电离的因素 2.能利用水的离子积进行相关计算 | ||||||||||||||||||
教学难点 | 能利用水的离子积进行相关计算 | ||||||||||||||||||
教学准备 | 教师准备:课件、例题 学生准备:复习弱电解质的电离知识 | ||||||||||||||||||
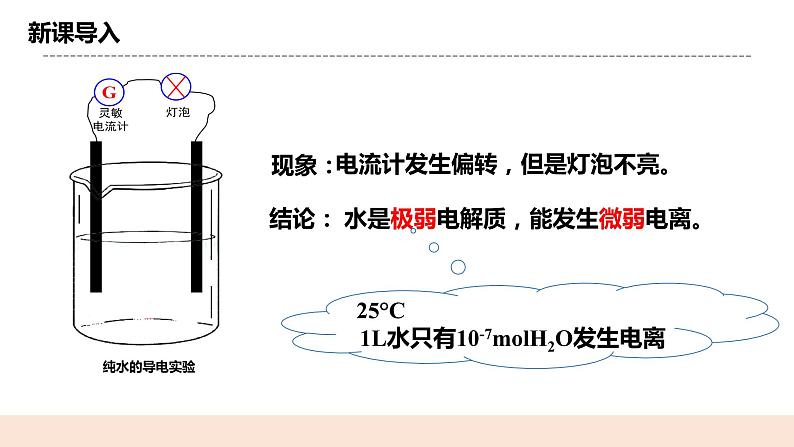
教学过程 | 一.新课导入 在水溶液中,酸、碱和盐全部或部分以离子形式存在,那么,其中的溶剂水是全部以分子形式存在,还是部分以离子形式存在呢?怎样验证你的猜想?
现象:电流计发生偏转,但是灯泡不亮。 结论:水是极弱电解质,能发生微弱电离。
25°C,1L水只有10-7molH2O发生电离
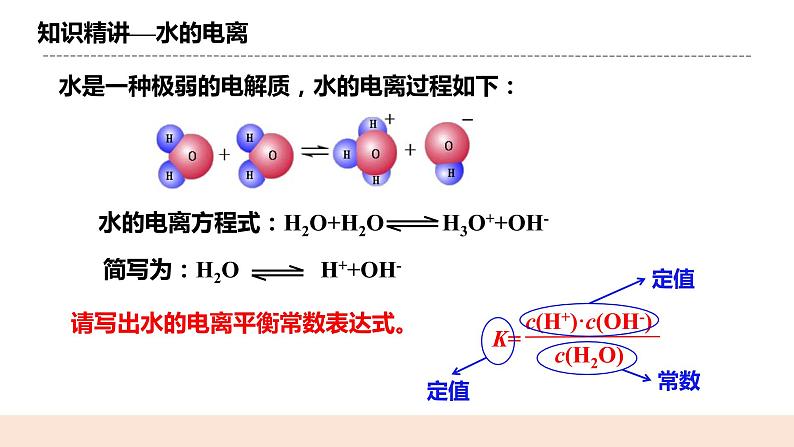
二.知识精讲 水是一种极弱的电解质,水的电离过程如下:
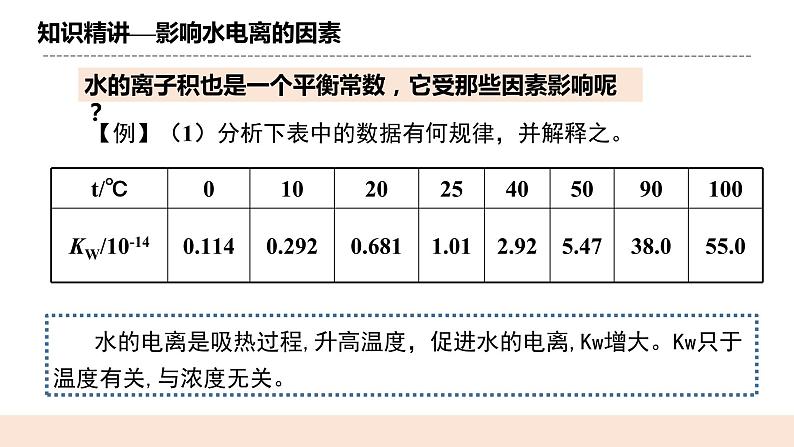
水的电离方程式:H2O+H2O H3O++OH- 简写为:H2O H++OH- (一)水的离子积常数 1.定义 当水的电离达到平衡时,电离产物H+和OH-浓度之积是一个常数,叫做水的离子积常数,记作KW,简称水的离子积。 2.表达式 Kw =c(H+)·c(OH-) 3.应用范围 纯水、稀的电解质水溶液。 Q:水的离子积也是一个平衡常数,它受那些因素影响呢? 【例】(1)分析下表中的数据有何规律,并解释之。
结论:水的电离是吸热过程,升高温度,促进水的电离,Kw增大。Kw只于温度有关,与浓度无关。
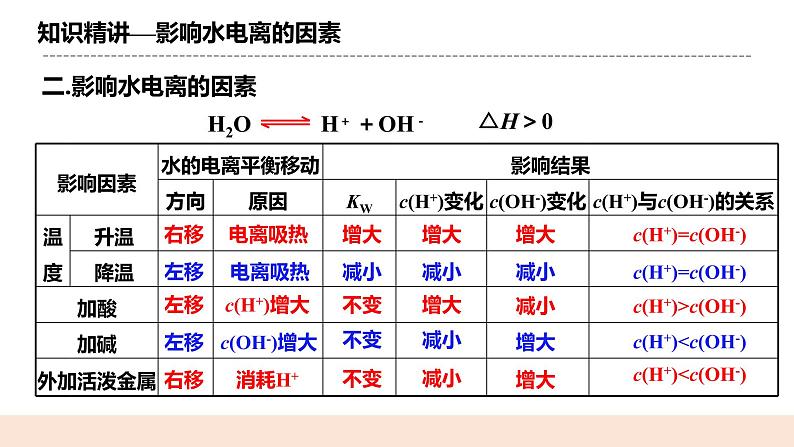
(二)影响水电离的因素 H2O H+ +OH- △H>0 总结归纳 1. 温度升高,促进水的电离,Kw增大; 2. 酸、碱抑制水的电离,Kw不变; 3. 外加能与H+、OH- 反应的物质,会促进水的电离,Kw不变。
(三)水电离出的c(H+)或者c(OH-)的计算 【例2】常温下,浓度为0.01 mol·L-1的盐酸溶液中,c(H+)和c(OH-)各是多少? 溶液中存在两个电离:HCl === H+ + Cl-和H2O H+ + OH- (1) c(H+) c(H+)来源于 HCl 电离(多),以及 H2O 电离(少,忽略) c(H+) ≈ 0.01 mol/L (2) c(OH-) 室温下, Kw = 1.0×10-14 c(OH-) = Kw /c(H+)= 1.0×10-13 由水电离产生的c(H+)=由水电离产生的c(OH-) = 1.0×10-13 【例3】室温下,由水电离产生的 c(H+) = 10-13 mol/L,该溶液是酸性还是碱性? 可能是酸性(如0.1mol/L的稀盐酸), 也可能是碱性(如0.1mol/L的烧碱) 水的电离平衡曲线的理解与识别 (1)曲线上的任意点(如a,b,c)的Kw 都 相等 即c(H+)·c(OH-) 相等 , 温度 相等 。 (2)曲线外的任意点(如d)与曲线上 任意点的Kw 不同 ,温度 不同 。 (3)实现曲线上点之间的转化需保持温度不变,改变 酸碱性 ; 实现曲线上点与曲线外点之间的转化一定改变 温度 。 【例4】一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是
A.该温度下,a点溶液呈碱性 B.该温度下,0.01 mol·L-1NaOH溶液中c(H+) =1.0×10-12 mol·L-1 C.该温度下,加入NaOH可能引起由d向b的变化 D.b点时,升高温度,可能引起由b向c的变化 总结归纳 (1)酸溶液中Kw=c酸(H+)·c水(OH-)(忽略水电离出的H+的浓度)。 (2)碱溶液中Kw=c水(H+)·c碱(OH-)(忽略水电离出的OH-的浓度)。 (3)由水电离出的c(H+)与水电离出的c(OH-)一定相等。 (4)室温下,由水电离出的c(H+)=1×10-13 mol·L-1的溶液可能呈酸性, 也可能呈碱性。
三.课堂小结 一.水的离子积常数 二.影响水电离的因素 三.水电离出的c(H+)或者c(OH-)的计算
四.随堂练习 1.判断正误(正确的打“√”,错误的打“×”) (1)升高温度,水的电离平衡右移,溶液中的c(H+)和c(OH-)均增大,但Kw不变。( × ) (2)25 ℃时,水的离子积Kw=1.0×10-14,35 ℃时水的离子积Kw=2.1×10-14,则35 ℃时纯水中的c(H+)>c(OH-)。( × ) (3)任何水溶液中均存在H+和OH-,且水电离出的c(H+)和c(OH-)相等。 ( √ ) (4)向水中加入酸抑制水的电离,向水中加入碱促进水的电离。( × ) 2.在100 ℃时,100 mL蒸馏水中c(OH-)=1×10-6mol·L-1,当改变下列 条件之一时,c(OH-)仍然等于1×10-6mol·L-1的是( B) ①温度降低到25 ℃ ②加入10-6mol烧碱固体,保持100 ℃ ③加入10-6mol氯化钠,保持100 ℃ ④蒸发掉50 mL水,保持100 ℃ A.①② B.③④ C.①③ D.②④
| ||||||||||||||||||
布置作业 | 化学课时作业《水的电离》 | ||||||||||||||||||
板书设计 | 一.水的离子积常数 1.定义 2.表达式:Kw =c(H+)·c(OH-) 3.应用范围:纯水、稀的电解质水溶液。 二.影响水电离的因素 1. 温度升高,促进水的电离,Kw增大; 2. 酸、碱抑制水的电离,Kw不变; 3. 外加能与H+、OH- 反应的物质,会促进水的电离,Kw不变。 三.水电离出的c(H+)或者c(OH-)的计算
| ||||||||||||||||||
教学反思 | 本节课要求学生理解知识,并能够用所学知识解决问题,难度较大。教师在教学中应注重学生的理解,多用例题,讲练结合。 |
高中化学第二节 金属材料优秀课件ppt: 这是一份高中化学第二节 金属材料优秀课件ppt,共23页。PPT课件主要包含了学习目标,第1课时水的电离,认识水的电离,了解水的离子积常数等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH优秀ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH优秀ppt课件,共23页。PPT课件主要包含了学习目标,第1课时水的电离,认识水的电离,了解水的离子积常数等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH教学ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH教学ppt课件,共16页。PPT课件主要包含了溶液中存在哪些微粒,问题情境,水的电离,v电离,等动定变,温度越高Kw越大,①中性溶液时,②酸性溶液时,③碱性溶液时,《金版》P76等内容,欢迎下载使用。














