





- 3.2金属材料(第二课时)课件+教案+练习 课件 77 次下载
- 4.1原子结构与元素周期表(第一课时)课件+教案+练习 课件 84 次下载
- 4.1原子结构与元素周期表(第二课时)课件+教案+练习 课件 84 次下载
- 4.3化学键(第一课时)课件+教案+练习 课件 79 次下载
- 4.3化学键(第二课时)课件+教案+练习 课件 81 次下载
人教版 (2019)必修 第一册第四章 物质结构 元素周期律第二节 元素周期律备课课件ppt
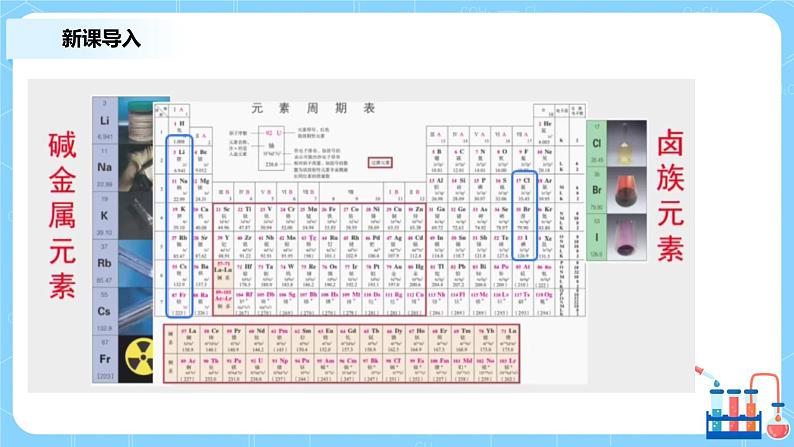
展开一、新课导入二、分析各周期元素的变化三、预测第三周期元素金属性的变化规律四、预测第三周期元素非金属性的变化规律五、课堂练习六、课堂总结
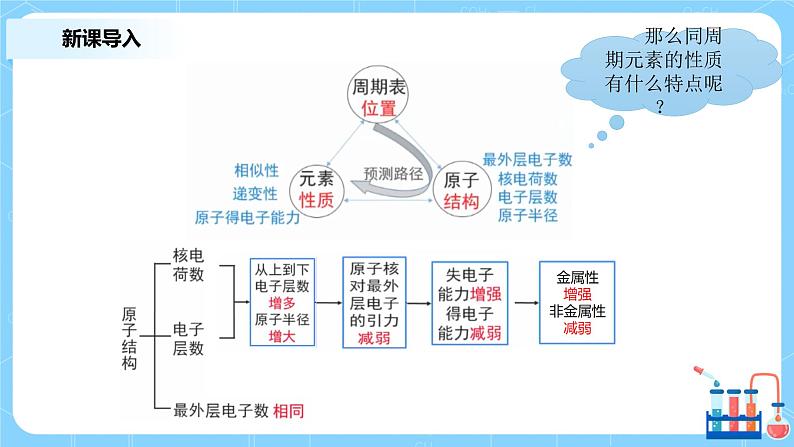
那么同周期元素的性质有什么特点呢?
第一周期:+1 0第二周期:+1 +5 -4 -1 0
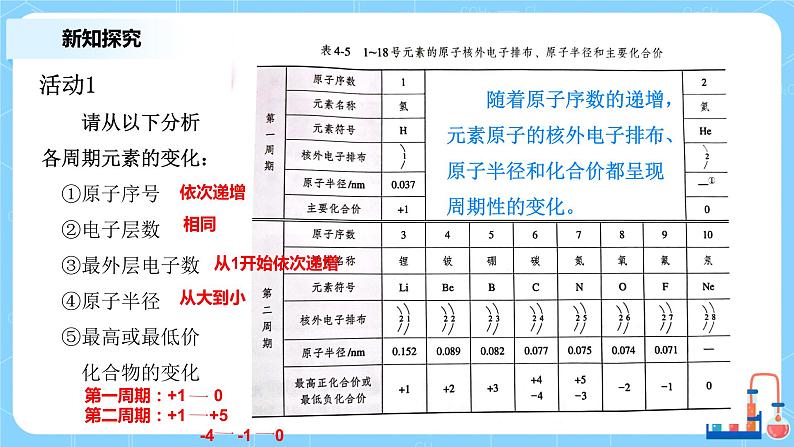
请从以下分析各周期元素的变化: ①原子序号 ②电子层数 ③最外层电子数 ④原子半径 ⑤最高或最低价 化合物的变化
随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价都呈现周期性的变化。
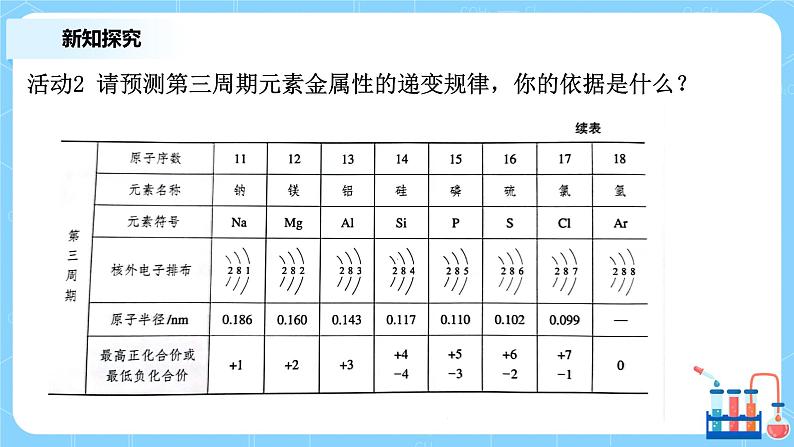
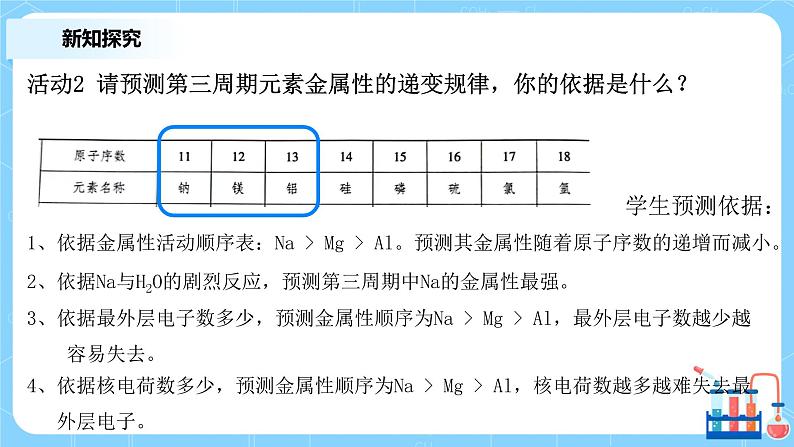
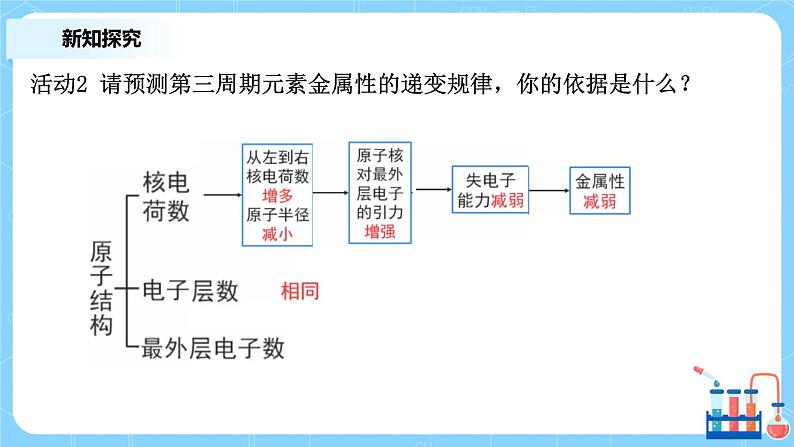
活动2 请预测第三周期元素金属性的递变规律,你的依据是什么?
1、依据金属性活动顺序表:Na > Mg > Al。预测其金属性随着原子序数的递增而减小。
2、依据Na与H2O的剧烈反应,预测第三周期中Na的金属性最强。
3、依据最外层电子数多少,预测金属性顺序为Na > Mg > Al,最外层电子数越少越 容易失去。
4、依据核电荷数多少,预测金属性顺序为Na > Mg > Al,核电荷数越多越难失去最 外层电子。
活动3 请设计实验验证金属性Na > Mg > Al ,实验设计依据是什么?
判断元素金属性强弱的依据:(1)金属单质与水(或酸)反应置换出氢的难易程度(2)金属元素最高价氧化物对应的水化物——氢氧化物的碱性强弱
活动3.1 根据金属单质与水(或酸)反应置换出氢的难易程度 验证金属性Na > Mg > Al
活动3.2 根据金属元素最高价氧化物对应的水化物——氢氧化物的 碱性强弱验证金属性Na > Mg > Al
设计实验证明Mg(OH)2和Al(OH)3的碱性的强弱
Al(OH)3在酸或强碱溶液中都可以溶解,表面它既能与酸反应,又能与强碱溶液反应。
说明Al(OH)3是两性氢氧化物。 表明金属铝已表现出一定的非金属性。
实验结论:NaOH是强碱,Mg(OH)2 是中强碱,Al(OH)3是两性氢化物碱性强弱:NaOH > Mg(OH)2 > Al(OH)3金属性:Na > Mg > Al
活动4 请继续设计实验验证第三周期元素的非金属性的递变规律
非金属性强弱的判断:(1)与H2化合越容易,气态氢化物越稳定,非金属性越强。(2)最高价氧化物对应水化物的酸性越强,非金属性越强。
活动4.1 根据与H2化合越容易,气态氢化物越稳定,非金属性越强来判断
非金属性:Si < P < S < Cl
酸性依次增强非金属也依次增强
活动4.2 最高价氧化物对应水化物的酸性越强,非金属性越强来判断
金属性逐渐减弱,非金属性逐渐增强
(2)元素周期律 含义:元素的性质随着原子序数的递增而呈周期性的变化。 本质:元素原子的核外电子排布呈周期性变化。
1、阅读门捷列夫的预言,深入了解元素周期律的 应用。2、已知34号硒(Se)元素,在周期表中的位置是 第四周期ⅥA族元素,依据你所学的元素周期表 的知识,预测该元素及其化合物的性质。
高中化学人教版 (2019)必修 第一册第二节 元素周期律优质课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律优质课课件ppt,共23页。PPT课件主要包含了熔球响红,请同学们课后去探讨,沉淀溶解,沉淀不溶解,SiPSCl,电子层数,阅读教材P104,元素周期律,课程结束等内容,欢迎下载使用。
高中人教版 (2019)第二节 元素周期律优质课件ppt: 这是一份高中人教版 (2019)第二节 元素周期律优质课件ppt,共49页。PPT课件主要包含了原子结构,元素性质,元素周期表,表中位置,学习目标,结构与位置,结构与性质,位置与性质,问题解决,原子序数=核电荷数等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 元素周期律公开课ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律公开课ppt课件,共60页。PPT课件主要包含了元素周期律,法国的古名为,“家里亚”,核外电子排布,原子半径,主要化合价,金属性和非金属性,元素性质,金属性与非金属性,Na>Mg>Al等内容,欢迎下载使用。














