

【通用版】2023届高考化学考点剖析专题卷 专题十三 物质的结构与性质
展开【通用版】专题十三 物质的结构与性质
考点41 原子结构与性质(1~5、9、19、26~28题)
考点42 分子结构与性质(7、10、12~14、17、18、25~28题)
考点43 晶体结构与性质(6、8、11、15、16、20~24、26~28题)
考试时间 :90分钟 满分:100分
一、选择题(本题共25小题,每小题2分,共50分。在每小题给出的四个选项中,只有一项是最符合题目要求的。)
1.下列说法正确的是( )
A.表示3p能级上有两个轨道
B.M层中的原子轨道数目为3
C.同一原子中,2p、3p、4p能级的原子轨道数相同
D.基态Cl原子的轨道表示式为
2.港珠澳大桥是世界上最长的跨海大桥,桥受力部件采用高强度拉力钢索(如图所示)。钢索表面的合金保护层含有锌、铝和少量钒,下列说法错误的是( )
A.锌位于元素周期表的d区
B.基态铝原子中占据最高能级的电子的电子云轮廓图为哑铃形
C.钒位于元素周期表中第四周期第VB族
D.基态钒原子的价层电子排布式为
3.已知某原子结构示意图为,下列有关说法正确的是( )
A.结构示意图中
B.该原子的核外电子排布式为
C.该原子的核外电子排布图为
D.该原子结构中共有5 个能级上填充电子
4.如图是s能级和p能级的原子轨道,下列说法正确的是( )
A.s能级和p能级的原子轨道形状相同
B.每个p能级都有6个原子轨道
C.s能级的原子轨道的半径与能层序数有关
D.Na原子的电子在11个原子轨道上高速运动
5.下列是几种基态原子的电子排布图,失去1个电子需要能量最高的是( )
A.
B.
C.
D.
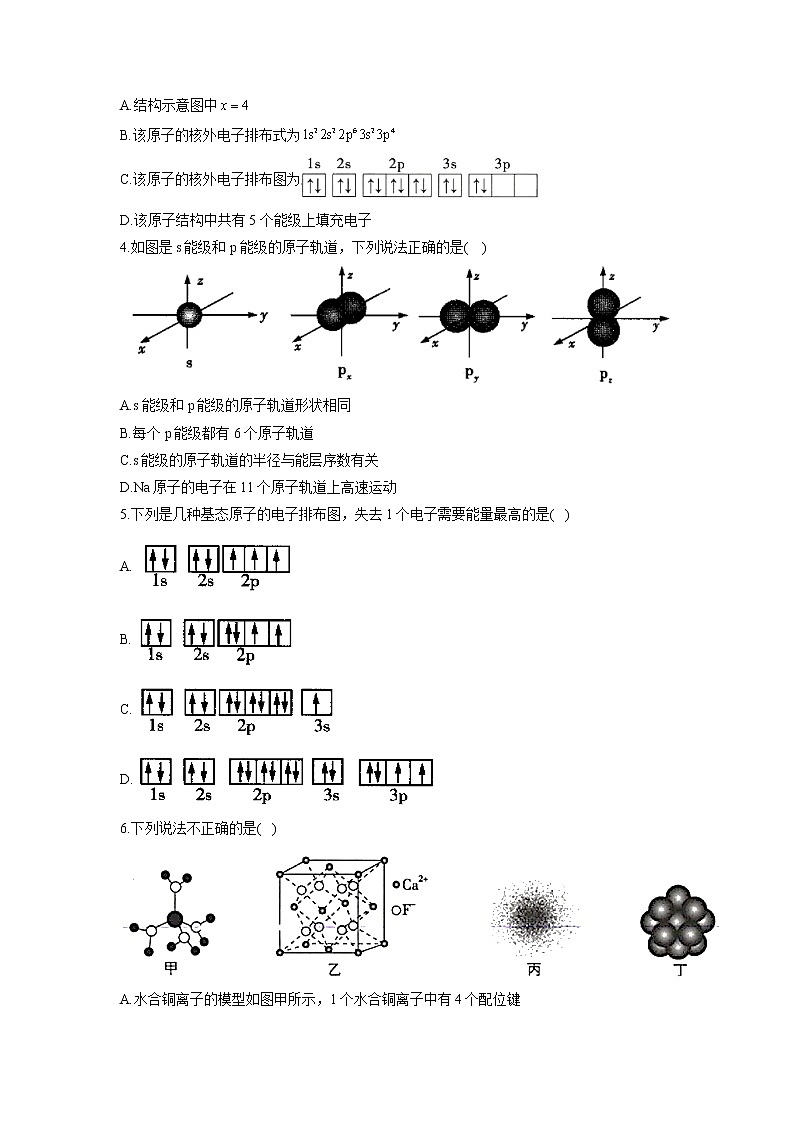
6.下列说法不正确的是( )
A.水合铜离子的模型如图甲所示,1个水合铜离子中有4个配位键
B.晶体的晶胞如图乙所示,每个晶胞平均占有4个
C.H原子的电子云如图丙所示,H原子核外的大多数电子在原子核附近运动
D.金属Ag的原子堆积模型如图丁所示,该金属晶体为最密堆积,每个Ag原子的配位数均为12
7.在含铬催化剂作用下,利用二氧化碳可以合成甲醇或甲醛,化学方程式分别是,,下列说法正确的是( )
A.电负性:O>H>C
B.铬原子的价电子排布式是
C.甲醛的分子结构为三角锥形,分子中碳原子采取杂化
D.水结冰时体积膨胀、密度减小的反常现象与水分子之间能形成氢键有关
8.铋合金可用于自动喷水器的安全塞,一旦发生火灾时,安全塞会“自动”熔化,喷出水来灭火。铋的晶胞结构如图乙所示,下列有关铋的说法错误的是( )
A.已知铋位于第六周期第ⅤA族,其价电子排布式为
B.铋与氮同主族,Bi的第一电离能小于N
C.配合物中Bi的化合价为+3价,内界为
D.金属铋的原子堆积方式为体心立方堆积
9.Ga和Al均为第ⅢA族元素,下列有关Al、Ga及其化合物的结构与性质的说法错误的是( )
A.基态镓原子的价电子排布式为
B.铝的熔点低于镓
C.AlN键键能大于GaN键
D.属于共价化合物
10.环戊二烯可用于制备二茂铁,二茂铁(结构如图所示)是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。下列说法正确的是( )
A.1mol环戊二烯中含有5molσ键 B.环戊二烯分子中所有原子共平面
C.二茂铁中存在配位键 D.的价电子排布式为
11.镍铜合金是制造行波管和航空发动机的结构材料。下列有关镍和铜的说法正确的是( )
A.基态铜原子的价电子排布式是
B.元素铜的第二电离能大于镍的第二电离能
C.图甲为铜晶体中铜原子堆积模型图中未标号的铜原子形成晶体后周围最紧邻的铜原子数为8
D.NiO的晶胞结构(如图乙)类型与氯化钠相同,NiO晶胞中和的配位数分别为8
12.在中国古代,雌黄经常用来修改错字,其结构如图所示。下列说法错误的是( )
A.As原子的杂化方式为
B.简单氢化物的沸点:
C.与As同周期且基态原子核外未成对电子数目与As相同的元素只有V
D.已知分子中各原子均满足8电子结构,分子中键和键的个数比为3:1
13.一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示。下列说法错误的是( )
A.基态Zn原子的价电子排布式是
B.该物质中存在的化学键有配位键、共价键、氢键
C.该物质中部分元素的第一电离能N>O>C
D.甘氨酸易溶于水,原因是甘氨酸和水都是极性分子,且甘氨酸分子中的羧基和氨基都能与水形成分子间氢键
14.碳是地球上组成生命的最基本元素之一,与其他元素结合成众多无机物和有机化合物,构成了丰富多彩的世界。下列说法不正确的是( )
A.基态碳原子的外围电子轨道表示式为
B.碳的同素异形体金刚石、石墨和晶体中,能溶于有机溶剂的是
C.金刚石质硬但脆,金刚石能被砸碎的原因是共价键具有方向性
D.碳原子与相邻碳原子形成的键角
15.钙钛矿最初单指图(a)钛酸钙这种矿物,此后,把结构与之类似的晶体(化学式与钛酸钙相同)统称为钙钛矿物质.某钙钛矿型太阳能光伏电池的有机半导材料的结构如图(b)所示,其中A为,另两种离子为I-和。下列说法错误的是( )
A.钛酸钙的化学式为
B.晶胞中的配位数为12
C.图(b)中,X为
D.图(b)立方晶胞的密度为,则晶胞边长
16.下列对一些实验事实的理论解释正确的是( )
选项
实验事实
理论解释
A
氧原子的第一电离能小于氮原子
氮原子2p能级半充满
B
为直线形分子
分子中C=O之间的夹角为
C
金刚石的熔点低于石墨
金刚石是分子晶体,石墨是原子晶体
D
HF的沸点高于HCl
HF的相对分子质量小于HCl
A.A B.B C.C D.D
17.正氰酸(H—O—C≡N)与异氰酸(H—N=C=O)、雷酸(H—O—N≡C)互为同分异构体,均可以与氨水形成相应铵盐。下列说法错误的是( )
A.三种酸的分子均能形成分子间氢键
B.三种酸的分子中,氧原子的杂化方式相同
C.三种酸的组成元素中,碳的第一电离能最小
D.三种酸的铵盐中,只有雷酸铵的阴、阳离子均含有配位键
18.氢气是清洁能源之一,解决氢气的存储问题是当今科学界需要攻克的课题。是新型环烯类储氢材料,利用物理吸附的方法来储存氢分子,其分子结构如图所示,下列相关说法正确的是( )
A.的熔点由所含的化学键键能决定
B.完全燃烧的产物均为极性分子
C.分子中的键和键的数目比为4:1
D.储氢时与间的作用力为氢键
19.短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是( )
X
Y
Z
W
分子式
溶液对应的pH(25℃)
1.00
13.00
1.57
0.70
A.元素电负性:Z
A.位于元素周期表d区
B.晶胞中白球表示铜原子
C.O周围的能构成正四面体,O周围的O能构成立方体
D.若氧原子间的最短距离为,则该晶体的密度为
21.下列关于C、Si及其化合物结构与性质的论述错误的是( )
A.键能,因此稳定性大于
B.立方型SiC是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度
C.中Si的化合价为+4,中C的化合价为-4,因此还原性小于
D.Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成键
22.X原子M层电子数是Y原子L层电子数的3倍,Y原子2p能级电子数是X原子N层电子数的4倍,X与Y形成的一种离子化合物晶胞结构如图所示,晶胞参数为。下列叙述错误的是( )
A.正负离子的半径比和电荷比决定离子的配位数
B.该化合物是红色难溶于水的固体
C.晶胞中与Y原子最邻近的Y原子数为8
D.晶体密度为
23.下列说法中错误的是( )
①H2O汽化成水蒸气破坏分子间作用力、H2O分解为H2和O2,需要破坏共价键
②C4H10的两种同分异构体因为分子间作用力大小不同,因而沸点不同
③因为晶体硅的摩尔质量比金刚石的摩尔质量大,所以晶体硅的熔点比金刚石的高
④SiO2与CO2的分子结构类似,所以化学性质类似
⑤分子晶体中,共价键键能越大,该分子晶体的熔、沸点越高
A.①②⑤ B.①②③ C.②④⑤ D.③④⑤
24.下列说法正确的是( )
A.中的氧原子满足最外层8电子稳定结构
B.葡萄糖、二氧化碳和足球烯()都是共价化合物,它们的晶体都属于分子晶体
C.溶于水只需克服离子键
D.HF比HCl稳定,是由于HF分子间存在氢键
25.下列有关共价键和键参数的说法不正确的是( )
A.1个乙烯分子中含有5个键和1个键
B.C—C键比C—O键的键长更长
C.三种分子的键角依次增大
D.碳碳双键比碳碳单键的键能更大,故碳碳双键更稳定
二、非选择题(本题共3小题,共50分。)
26.(14分)与、有机分子等形成的化合物具有广泛的应用。
(1)C、N、O原子的第一电离能由大到小的顺序是 。
(2)基态核外电子排布式为 。
(3)乙酰基二茂铁是常用汽油抗震剂,其结构如题图-1所示。此物质中碳原子的杂化方式是 。
(4)配合物可用于电子传感器的制作。与配体互为等电子体的一种分子的化学式为 。
已知是直线型分子,并具有对称性,则中π键和σ键的个数比为 。
(5)不仅可与形成,还可以与形成一种立方晶系的离子晶体,此晶体应用于激光领域,结构如题图-2所示。该晶体的化学式为 。
27.(18分)碳是地球上组成生命的最基本元素之一,可以和杂化轨道成共价键,具有很强的结合能力,与其它元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态碳原子核外有__________种运动状态不同的电子,其价电子排布图为 。
(2)光气的分子式为,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为 ,其碳原子杂化轨道类型为 杂化。
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
碳酸盐
SrCO3
热分解温度/
402
900
1172
1360
阳离子半径/pm
66
99
112
135
试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?
(4)碳的一种同素异形体,又名足球烯,是一种高度对称的球碳分子。立方烷(分子式:,结构是立方体:)是比约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为
(5)碳的另一种同素异形体——石墨,其晶体结构如上图所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为 个。已知石墨的密度为,C-C键长为rcm,阿伏加德罗常数的值为,计算石墨晶体的层间距为 cm。
28.(18分)科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为________________。
(2)下列关于CH4和CO2的说法正确的是_______(填序号)。
a.固态CO2属于分子晶体
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2.
①基态Ni原子的电子排布式为_______,该元素位于元素周期表的第_____族。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有___molσ键。
(4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。
分子\参数
分子直径/nm
分子与H2O的结合能E/kJ·mol-1
CH4
0.436
16.40
CO2
0.512
29.91
①“可燃冰”中分子间存在的2种作用力是________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0. 586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是________。
答案以及解析
1.答案:C
解析:表示3p能级上填充了2个电子,A项错误。M层中有3s、3p、3d三个能级,原子轨道数目为9,B项错误。同一原子中,2p、3p、4p能级的原子轨道数相同,均为3,C项正
确。基态Cl原子的轨道表示式应为,D项错误。
2.答案:A
解析:锌位于元素周期表的ds区,A项错误;基态铝原子的价层电子的轨道表示式为,占据最髙能级的电子为3p电子,其电子云轮廓图为哑铃形,B项正确;钒位于元素周期表中第四周期第V B族,其基态原子的价层电子排布式为,C、D项正确。
3.答案:D
解析:本题考查原子的结构及核外电子排布式书写。在原子结构示意图中第一能层上只能排2个电子,故,A错误;, 故最外层有4 个电子,该元素为Si,Si原子的核外电子排布式为,B错误;根据洪特规则可知,该原子3p能级上的2 个电子应分别占据不同的轨道,而且自旋状态应相同,C错误;该原子的核外电子排布式为,共有5 个能级上填充电子,D正确。
4.答案:C
解析: s轨道为球形,p轨道为哑铃形,A项错误;每个p能级只有3个原子轨道,B项错误;能层序数越小,s能级的原子轨道的半径越小,C项正确;Na原子的电子在6个原子轨道上高速运动,D项错误。
5.答案:A
解析:根据电子排布图,A、B、C、D分别表示N、O、Na、S四种原子。四种原子第一电离能从大到小排序为:N>O>S>Na,A正确。
6.答案:C
解析:本题考查物质的结构与性质。水合铜离子中铜离子的配位数为4,配位体是,分子中的氧原子提供孤对电子与铜离子形成配位键,1个水合铜离子中有4个配位键,A正确;根据均摊法可知,在晶体的晶胞中,每个晶胞平均占有的个数为,B正确;电子云密度表示电子在某区域出现的概率的大小,H原子最外层只有1个电子,所以不存在“大多数电子”一说,只能说H原子核外的1个电子在原子核附近运动的概率大,C错误;在金属晶体的最密堆积模型中,对于每个原子来说,在其周围的原子有与其同一层的6个原子和上一层的3个原子及下一层的3个原子,所以每个原子周围都有12个原子与其等距且最近,所以每个Ag原子的配位数均为12,D正确。
7.答案:D
解析:C、H、O的非金属性强弱顺序为O>C>H,则电负性:O>C>H,A错误;Cr为24号元素,基态Cr原子的电子排布式是,B错误;甲醛分子中碳原子是杂化,其分子结构为平面三角形,C错误;水结冰时由于氢键的存在迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引,这一排列使冰中水分子之间空隙变大,其密度比液态水的小,D正确。
8.答案:D
解析:本题考查铋及其化合物的结构与性质。Bi位于元素周期表中第六周期第VA族,Bi的价电子排布式为,A项正确;同主族元素从上到下第一电离能逐渐减小,则第一电离能:Bi
解析:本题考查化学键和化合物类型。Ga位于第四周期第ⅢA族,其基态原子的核外价电子排布式为,A项正确;一般情况下,金属的原子半径越小,价电子数越多,金属键越强,铝约原子半径小于镓,故铝的金属键强,熔点更高,B项错误;原子半径:Al
10.答案:C
解析:本题考查物质的结构与性质。1个环戊二烯分子中有3个碳碳单键为σ键,2个碳碳双键中含有2个σ键,此外还有6个碳氢单键为σ键,1mol环戊二烯中含有11molσ键,故A错误;环戊二烯中有饱和碳原子,与饱和碳原子相连的4个原子形成四面体结构,所有原子不可能共面,故B错误;含有空轨道,环戊二烯离子含孤电子对,二茂铁中与环戊二烯离子之间的化学键类型是配位键,故C正确;是由Fe原子失去最外层两个电子形成的,价电子排布式为,故D错误。
11.答案:B
解析:本题考查金属及其化合物的结构与性质。铜元素的原子序数为29,位于元素周期表第四周期第ⅠB族,价电子排布式为,A项错误;铜原子的价电子排布式为,失去一个电子后3d能级形成全充满的稳定结构,镍原子的价电子排布式为,失去一个电子后价电子排布式为,的电子结构容易再失去一个电子,则铜元素的第二电离能大于镍元素,B项正确;由题图甲晶体模型可知,未标号的铜原子形成晶体后周围最紧邻的铜原子为上层1、2、3,同层4、5、6、7、8、9,下层10、11、12,共有12个,C项错误;氯化钠晶体中,钠离子和氯离子的配位数均为6,NiO晶胞结构类型与氯化钠的相同,则氧化镍晶体中,氧离子和镍离子的配位数也均为6,D项错误。
12.答案:C
解析:由雌黄的结构可知,黑球代表As,白球代表S,雌黄 中砷原子形成3个单键,有1个孤电子对,采用杂化,A项正确;和均为分子晶体,其沸点高低与相对分子质量的大小有关,但因氨气分子间存在氢键导致其沸点偏高,B项正确;基态As原子核外电子排布式为,未成对电子数为3,与其同周期且基态原子核外未成对电子数目相同的元素有V(核外电子排布式为)、Co(核外电子排布式为),C项错误;分子中各原子均满足8电子结构,则其结构式为F,单键均为键,1个双键中有1个键、1个键,该分子中键和键的个数比为3:1,D项正确。
13.答案:B
解析:基态Zn原子的价电子排布式是,A项正确;氢键不是化学键,B项错误;第一电离能N>O>C,C项正确;甘氨酸易溶于水,原因是甘氨酸和水都是极性分子,且甘氨酸分子中的羧基和氨基都能与水形成分子间氢键,D项正确。
14.答案:D
解析:基态碳原子核外电子排布式为,外围电子轨道表示式为,A项正确;是分子晶体,能溶于有机溶剂,B项正确;金刚石为共价晶体,金刚石能被砸碎的原因是共价键具有方向性,导致金刚石不具有延展性等性质,C项正确;石墨烯中的碳原子杂化轨道类型均为杂化,为平面结构,键角为120°,被氧化后碳原子形成3个CC键及1个CO键,碳原子的杂化轨道类型为杂化,与周围原子形成四面体形结构,碳原子与相邻碳原子形成的键角,D项不正确。
15.答案:C
解析:A.由晶胞结构可知,位于顶点、位于体心、位于面心,个数比为,则钛酸钙的化学式为,故A说法正确;B.由顶点和面心看,与紧邻的在面心上,则晶胞中与每个紧邻的的个数个,即配位数为12,故B说法正确;C.图b中A为,另两种离子为和,A的个数为,由正负化合价的代数和为0可知,和的个数分别为3、1,结合均摊法可知X为,B为,故C说法错误;D.晶胞中含1个,3个和1个,由,得晶胞边长,故D说法正确;答案为C。
16.答案:A
解析:N原子2p能级半充满,稳定性强,所以氮元素的第一电离能大于氧元素的,A周期;B不正确,键角是180°;石墨是混合型晶体,C不正确;D不正确,HF分子间存在氢键,所以沸点高于氯化氢的,D不正确,答案选A。
17.答案:B
解析:A.分子间的氢键是指H与NO、F等的相互作用,三种酸中都含有H与N、O间的作用,所以可以形成分子间氢键,故A正确;B.正氰酸与雷酸中的氧原子都是单键,采取杂化,异氰酸中的氧原子是双键,采取杂化,故B错误; C.首先电离能有:N>O>C,C与H比较,H原子较小且只有1个电子,引力强难电离,所以电离能:H>C,故C的第一电离能最小,故C正确; D.中由一个配位键,雷酸中N-O之间还有配位键,而其它酸根中的所有原子均满足8电子结构,不存在配位键,故D正确。
18.答案:C
解析:本题考查影响物质熔点的因素、分子极性的判断等知识。是分子晶体,熔点由范德华力大小决定,A错误;完全燃烧的产物为和,为非极性分子,为极性分子,B错误;由分子结构可知,1个分子中的键和键的数目分别为32和8,C正确;分子中没有能形成氢键的原子,也为分子晶体,二者之间的作用力为范德华力,D错误。
19.答案:A
解析:本题考查元素的推断及元素周期律。X、Y、Z、W为原子序数依次增大的短周期元素,X的最高价氧化物的水化物浓度为0.1时pH为1.00,说明为一元强酸,则X只能为N元素,对应的最高价氧化物的水化物为一元强酸;Y的最高价氧化物的水化物浓度为0.1时pH为13.00,则为一元强碱,Y为Na元素;Z的最高价氧化物的水化物的分子式为,则Z为P元素;W的最高价氧化物的水化物若为,则0.1溶液的pH为1.00,实际pH小于1.00,则W的最高价氧化物的水化物为二元强酸,W为S元素。综上所述X、Y、Z、W依次为N、Na、P、S。同周期主族元素从左到右电负性逐渐增强,则电负性:P
20.答案:C
解析:位于元素周期表区,A项错误;晶胞中白球表示氧原子,B项错误;晶胞中O周围的能构成正四面体,O周围的O能构成立方体,C项正确;若O原子间的最短距离为,则该晶体的密度为,D项错误。
21.答案:C
解析:本题考查碳、硅及其化合物的结构与性质。碳、硅的氢化物都是共价化合物,键能越大,共价键越牢固,对应的化合物越稳定,A项正确;立方型SiC与金刚石的成键方式、结构都相似,是一种具有空间网状结构的共价晶体,故具有很高的硬度和熔、沸点,B项正确;中Si的化合价为+4价,H的化合价为-1价,中C的化合价为-4价,电负性:C>H>Si,-1价的氢比-4价碳的还原性强,故的还原性强于,C项错误;π键是由两个原子的p轨道“肩并肩"重叠形成的,由于Si的原子半径大于C,故硅原子间难以形成π键,D项正确。
22.答案:D
解析:本题考查晶胞的结构、性质及计算。决定离子的配位数有几何因素(正负离子的半径比)和电荷因素(正负离子的电荷比),A正确;由“Y原子2p能级电子数是X原子N层电子数的4倍”推知,Y原子2p能级的电子数只能为4,X原子N层电子数为1,则Y为O,再结合“X原子M层电子数是Y原子L层电子数的3倍”可知X原子M层电子数为18,则X为Cu,由题图可知,晶胞中黑球与白球的数目比为2:1,则黑球表示Cu原子,白球表示O原子,该化合物是难溶于水的红色固体氧化亚铜(),B正确;Y(O)原子位于晶胞的体心和顶点,晶胞中与Y原子最邻近的Y原子数为8,C正确;氧化亚铜晶胞中有2个O原子和4个Cu原子,则晶体密度为,D错误。
23.答案:D
解析: ①分子之间存在分子间作用力,汽化成水蒸气,破坏了分子间作用力,分解为和,需要破坏共价键H-O键,故①正确;
②丁烷有两种同分异构体,前者为正丁烷、后者为异丁烷,结构不同,分子间作用力大小不同,因而沸点不同,故②正确;
③因原子半径C
④属于原子晶体,结构中没有单个的分子,故④错误;
⑤分子晶体中,物质的熔沸点与其相对分子质量(分子间作用力)成正比,与共价键的强弱无关,故⑤错误;
24.答案:A
解析:A.O原子有6个电子,同时能形成2个共价单键,所以中的氧原子满足最外层8电子稳定结构,故A正确; B,足球烯()是单质,不是化合物,葡萄糖、二氧化碳都是共价化合物,它们的晶体都属于分子晶体,故B错误; C.溶于水,与水发生化学反应,离子键和共价键都被破坏,所以溶于水需克服离子键和共价键,故C错误; D.分子的稳定性与共价键有关,HF比HCl稳定,是由于HF分子中的共价键键能大于HCl的键能,与氢键无关,故D错误;故选:A。
25.答案:D
解析:1个乙烯分子中含有4个C—H键和1个碳碳双键,单键是键,双键中有1个键和1个键,故A正确;原子半径:C>O,则键长:C—C>C—O,故B正确;是Ⅴ形结构,键角为105°,是正四面体形结构,键角为109°28′,是直线形结构键角为180°,三种分子的键角依次增大,故C正确;碳碳双键比碳碳单键的键能大,但碳碳双键中含有1个键和1个键,碳碳单键只含有1个键,碳碳双键中的键易断裂,所以碳碳单键更稳定,故D错误。
26.答案:(1)
(2)或
(3)
(4)CO或;4:3
(5)
解析:
27.答案:(1)6;
(2)平面三角形; sp2
(3)碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解
(4)C8H8·C60
(5)4 ;
解析:(1)碳原子核外有6个电子,原子核外没有运动状态相同的电子,即有6种运动状态不同的电子,碳原子价电子排布式为2s22p2,根据泡利原理与洪特规则,价电子排布图为,故答案为:6;;
(2)光气的分子式为COCl2,其分子中C原子形成3个σ键,没有孤对电子,空间结构为平面三角形,杂化轨道数目为3,C原子采取sp2杂化,故答案为:平面三角形;sp2;
(3)碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解,故答案为:碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解;
(4)晶胞中C60数目为,立方烷分子填充在原C60晶体的分子间空隙中,位于晶胞的棱心和体心,所以晶胞中立方烷数目,则化学式为C8H8·C60,故答案为:C8H8·C60;
(5)由图可知石墨的晶胞结构为,设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为,
则,可得,则底面面积为。根据石墨的晶胞结构,底面图为,欲使角度为60°的顶点排列为无隙并置的结构,每层需要6个(360°÷60°=6),上下两层一共需要12个,所以角度为60°的顶点处原子的占有率为1/12,欲使该顶点对应的侧棱排列成无隙并置的结构只需要一层,所以侧棱处原子的占有率为1/6。欲使角度为120°的顶点排列为无隙并置的结构,每层需要3个(360°÷120°=3),上下两层一共需要6个,所以角度为120°的顶点处原子的占有率为1/6,欲使该顶点对应的侧棱排列成无隙并置的结构只需要一层,所以侧棱处原子的占有率为1/3。所以,晶胞中C原子数目为,晶胞质量为g,则:ρg.cm-3=g÷[(r)2×Sin60°×2d]cm3,整理可得,故答案为:4;。
28.答案:(1)H、C、O;(2)a、d;(3)①1s22s22p63s23p63d84s2或[Ar] 3d84s2;VIII;②8。
(4)①氢键、范德华力;②CO2的分子直径小于笼状空腔直径,且与H2O的结合力大于CH4。解析:(1)元素的非金属性越强,其电负性就越大。在和所含的三种元素中,元素的非金属性由强到弱的顺序是所以元素的电负性从小到大的顺序
(2)a.固态是由分子通过分子间作用力结合形成的分子晶睞,正确。b..在分子中含有极性共价键,由于该分子中各个共价键空间排列对称,因此该反应是非极性分子,错误。c. 和都是由分子构成的分子晶体,分子之间通过分子间作用力结合,分子间作用力越强,物质的熔沸点就越高,与分子内的化学键的强弱无关, 错误。d. 分子中碳原子形成的都是键,碳原子的杂化类型是的杂化,而分子中原子与两个氧原子个形成了两个共价键,一个键,一个键,碳原子的杂化类型是杂化,正确.故答案选a、d;
(3)①28号元素的基态原子的电子排布式为1或; 该元素位于元素周期表的第四周期第VIII族。②能与形成正四面体形的配合物在每个配位体中含有一个键,在每个配位体与中心原子之间形成一个键,所以1中含有8键。
(4)①“可燃冰”中分子间存在的2种作用力是分子间作用力和氢键,分子间作用力也叫范德华力。②根据表格数据可知,笼状空腔的直径是0.586,而分子的直径是0.512,大于分子的直径,而且与水分子之间的结合力大于,因此可以实现用置换的设想。
【通用版】2023届高考化学考点剖析专题卷 专题十四 有机化学基础: 这是一份【通用版】2023届高考化学考点剖析专题卷 专题十四 有机化学基础,共23页。试卷主要包含了22~28题)等内容,欢迎下载使用。
【通用版】2023届高考化学考点剖析专题卷 专题十二 化学实验: 这是一份【通用版】2023届高考化学考点剖析专题卷 专题十二 化学实验,共20页。试卷主要包含了11等内容,欢迎下载使用。
【通用版】2023届高考化学考点剖析专题卷 专题七 物质结构 元素周期律: 这是一份【通用版】2023届高考化学考点剖析专题卷 专题七 物质结构 元素周期律,共13页。试卷主要包含了10~12等内容,欢迎下载使用。












