
所属成套资源:高考专区化学二轮专题习题整册
统考版高考化学复习高频考点分层集训第七单元化学反应与能量课练19原电池化学电源含答案
展开
这是一份统考版高考化学复习高频考点分层集训第七单元化学反应与能量课练19原电池化学电源含答案,共18页。
课练19 原电池 化学电源
———————————— 狂刷小题·夯基础 ————————————
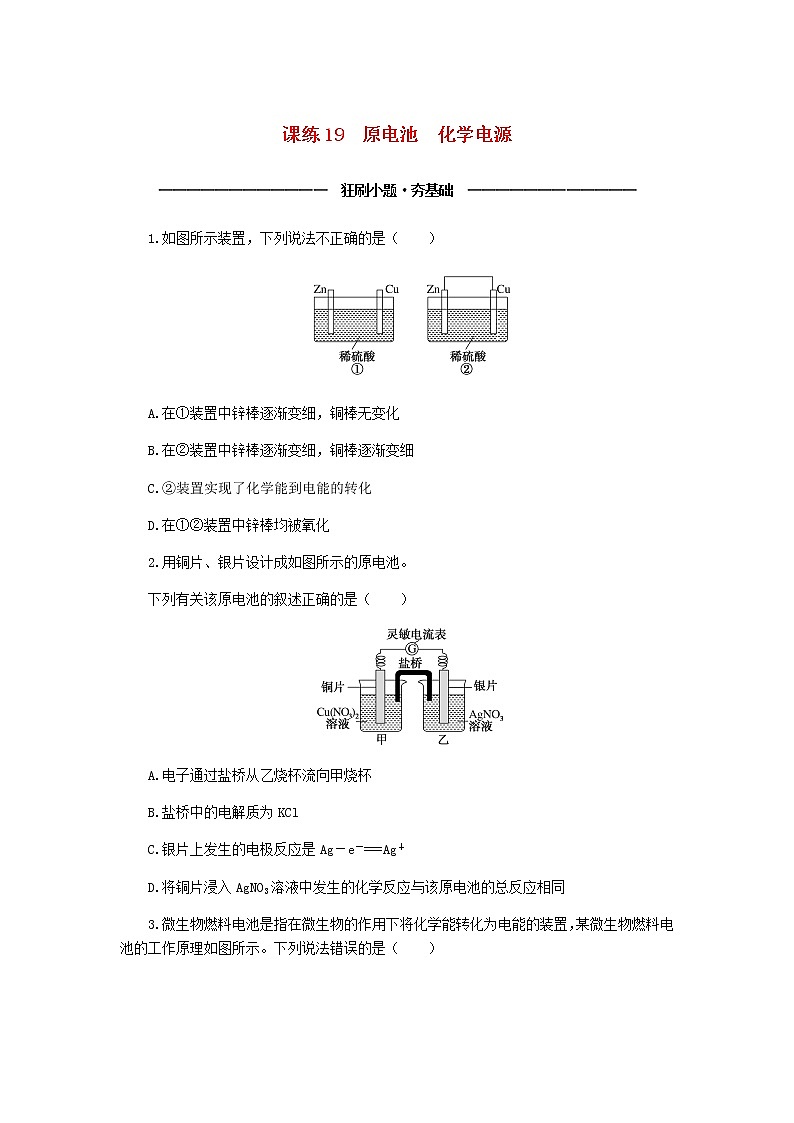
1.如图所示装置,下列说法不正确的是( )
A.在①装置中锌棒逐渐变细,铜棒无变化
B.在②装置中锌棒逐渐变细,铜棒逐渐变细
C.②装置实现了化学能到电能的转化
D.在①②装置中锌棒均被氧化
2.用铜片、银片设计成如图所示的原电池。
下列有关该原电池的叙述正确的是( )
A.电子通过盐桥从乙烧杯流向甲烧杯
B.盐桥中的电解质为KCl
C.银片上发生的电极反应是Ag-e-===Ag+
D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池的总反应相同
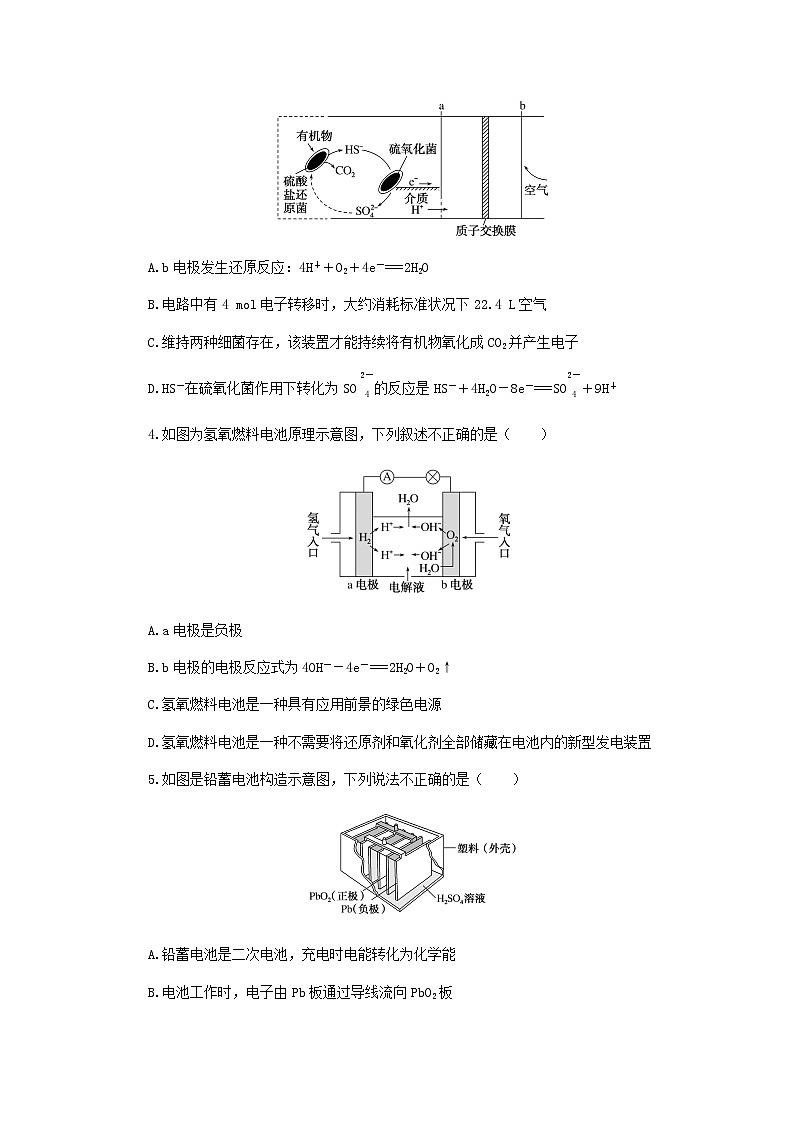
3.微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置,某微生物燃料电池的工作原理如图所示。下列说法错误的是( )
A.b电极发生还原反应:4H++O2+4e-===2H2O
B.电路中有4 mol电子转移时,大约消耗标准状况下22.4 L空气
C.维持两种细菌存在,该装置才能持续将有机物氧化成CO2并产生电子
D.HS-在硫氧化菌作用下转化为SO的反应是HS-+4H2O-8e-===SO+9H+
4.如图为氢氧燃料电池原理示意图,下列叙述不正确的是( )
A.a电极是负极
B.b电极的电极反应式为4OH--4e-===2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
5.如图是铅蓄电池构造示意图,下列说法不正确的是( )
A.铅蓄电池是二次电池,充电时电能转化为化学能
B.电池工作时,电子由Pb板通过导线流向PbO2板
C.电池工作时,负极反应为Pb-2e-+SO===PbSO4
D.电池工作时,H+移向Pb板
6.Mg AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是( )
A.负极反应式为Mg-2e-===Mg2+
B.正极反应式为Ag++e-===Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O===Mg(OH)2+H2↑
7.肼(N2H4)暴露在空气中容易爆炸,但是以其为燃料的燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染等特点,其工作原理如图所示,下列叙述正确的是( )
A.电池工作时,正极附近的pH降低
B.当消耗1 mol O2时,有2 mol Na+由甲槽向乙槽迁移
C.负极反应式为4OH-+N2H4-4e-===N2↑+4H2O
D.若去掉阳离子交换膜,电池也能正常工作
8.[2021·广东卷]火星大气中含有大量CO2,一种有CO2参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠为负极,碳纳米管为正极,放电时( )
A.负极上发生还原反应
B. CO2在正极上得电子
C.阳离子由正极移向负极
D. 将电能转化为化学能
9.[2021·河北卷]K-O2电池结构如图,a和b为两个电极,其中之一为单质钾片。关于该电池,下列说法错误的是( )
A.隔膜允许K+通过,不允许O2通过
B.放电时,电流由b电极沿导线流向a电极;充电时,b电极为阳极
C.产生1 Ah电量时,生成KO2的质量与消耗O2的质量比值约为2.22
D.用此电池为铅酸蓄电池充电,消耗3.9 g钾时,铅酸蓄电池消耗0.9 g水
10.[2021·湖南卷]锌/溴液流电池是一种先进的水溶液电解质电池,广泛应用于再生能源储能和智能电网的备用电源等。三单体串联锌/溴液流电池工作原理如图所示:
下列说法错误的是( )
A.放电时,N极为正极
B.放电时,左侧贮液器中ZnBr2的浓度不断减小
C.充电时,M极的电极反应式为Zn2++2e-===Zn
D.隔膜允许阳离子通过,也允许阴离子通过
11.[2021·山东卷]以KOH溶液为离子导体,分别组成CH3OH-O2、N2H4-O2、(CH3)2NNH2-O2清洁燃料电池,下列说法正确的是( )
A.放电过程中,K+均向负极移动
B.放电过程中,KOH物质的量均减小
C.消耗等质量燃料,(CH3)2NNH2-O2燃料电池的理论放电量最大
D.消耗1 mol O2时,理论上N2H4-O2燃料电池气体产物的体积在标准状况下为11.2 L
12.[2020·全国卷Ⅰ]科学家近年发明了一种新型Zn-CO2水介质电池。电池示意图如下,电极为金属锌和选择性催化材料。放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
下列说法错误的是( )
A.放电时,负极反应为Zn-2e-+4OH-===Zn(OH)
B.放电时,1 mol CO2转化为HCOOH,转移的电子数为2 mol
C.充电时,电池总反应为2Zn(OH)===2Zn+O2↑+4OH-+2H2O
D.充电时,正极溶液中OH-浓度升高
13.[2020·全国卷Ⅲ]一种高性能的碱性硼化钒(VB2)空气电池如图所示,其中在VB2电极发生反应:VB2+16OH--11e-===VO+2B(OH)+4H2O该电池工作时,下列说法错误的是( )
A.负载通过0.04 mol电子时,有0.224 L(标准状况)O2参与反应
B.正极区溶液的pH降低、负极区溶液的pH升高
C.电池总反应为4VB2+11O2+20OH-+6H2O===8B(OH)+4VO
D.电流由复合碳电极经负载、VB2电极、KOH溶液回到复合碳电极
14.[2022·安徽省皖南八校高三临门一卷]微生物燃料电池能将污水中的乙二胺(H2NCH2CH2NH2)氧化成环境友好的物质,示意图如图所示,a、b均为石墨电极。下列说法错误的是( )
A.a电极的电极反应为H2NCH2CH2NH2-16e-+4H2O===2CO2↑+N2↑+16H+
B.电池工作时质子通过交换膜由负极区向正极区移动
C.a电极上的电势比b电极上的电势低
D.电池工作时b电极附近溶液的pH保持不变
15.[2022·四川省成都市第七中三诊模拟]锌—空气燃料电池有比能量高、容量大、使用寿命长等优点,可用作电动车动力电源,电池的电解质溶液为 KOH 溶液,放电时发生反应:2Zn+O2+4OH-+2H2O===2[Zn(OH)4]2-。下列说法正确的是( )
A.放电时,负极反应为 Zn-2e-===Zn2+
B.该隔膜为阳离子交换膜,允许K+通过
C.充电时,当 0.1 mol O2 生成时,流经电解质溶液的电子个数约为 1.204×1022
D.采用多孔炭可提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
16.[2022·宁夏三校高三联考]我国某科研团队设计了一种新型能量存储/转化装置(如图所示)。闭合K2、断开K1时,制氢并储能;断开K2、闭合K1时,供电。下列说法错误的是( )
A.制氢时,溶液中K+向Pt电极移动
B.供电时,Zn电极附近溶液的pH不变
C.供电时,X电极发生还原反应
D.制氢时,X电极反应式为Ni(OH)2-e-+OH-===NiOOH+H2O
———————————— 综合测评·提能力 ————————————
一、选择题
1.[2021·广西桂林、贺州、崇左调研]如图所示原电池的盐桥中装有饱和K2SO4溶液,电池工作一段时间后,甲烧杯中溶液颜色不断变浅。下列叙述中正确的是( )
A.b极是电池的正极
B.甲烧杯中K+经盐桥流向乙烧杯
C.甲烧杯中溶液的pH逐渐减小
D.电池的总反应离子方程式为MnO+5Fe2++8H+===Mn2++5Fe3++4H2O
2.[2022·云南新平一中月考]可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为O2+2H2O+4e-===4OH-
B.以NaOH溶液为电解液时,负极反应为Al+3OH--3e-===Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
3.[2022·陕西榆林第二次质检]联氨(N2H4)是火箭的燃料,一种用联氨制成的燃料电池示意图如下,下列有关该电池的说法正确的是( )
A.该电池工作时,电子从负极经电解质溶液流向正极
B.负极的反应式为N2H4-4e-===N2↑+4H+
C.电池工作一段时间后,溶液的pH减小
D.当电路中通过0.1 mol电子时,负极上消耗0.56 L O2(标准状况)
4.[2022·陕西宝鸡中学月考]某传感器工作原理如图所示,利用该传感器可以测定空气中NO、CO、NH3、SO2等有害气体的含量。下列说法正确的是( )
A.传感器工作中,电子由Pt(Ⅰ)极经电流计传到Pt(Ⅱ)极
B.若M为熔融KOH,X为NH3,Y为N2,则负极的电极反应式为2NH3-6e-===N2+6H+
C.若M是含O2-的固体电解质,X为NO,则正极的电极反应式为O2+4e-===2O2-
D.若X为CO,M为KOH溶液,则电池总反应为2CO+O2===2CO2
5.[2021·北京海淀区模拟]全钒电池以惰性材料作电极,在电解质溶液中发生的原电池反应为:VO(黄色)+V2+(紫色)+2H+===VO2+(蓝色)+H2O+V3+(绿色)。
下列说法不正确的是( )
A.正极反应为VO+2H++e-===VO2++H2O
B.负极附近的溶液由紫色逐渐变为绿色
C.反应每生成1 mol H2O时转移电子的物质的量为0.5 mol
D.原电池使用过程中溶液的pH逐渐增大
6.[2020·山东卷]微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含CH3COO-的溶液为例)。下列说法错误的是( )
A.负极反应为CH3COO-+2H2O-8e-===2CO2↑+7H+
B.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C.当电路中转移1 mol电子时,模拟海水理论上除盐58.5 g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2∶1
7.[2021·广西省南宁市第二次适应性测试]DBFC燃料电池的结构如图,该电池的总反应为NaBH4+4H2O2===NaBO2+6H2O。下列关于电池工作时的相关分析不正确的是( )
A.X极为正极,电流经X流向外电路
B.Y极发生的还原反应为H2O2+2e-===2OH-
C.X极区溶液的pH逐渐减小
D.每消耗1.0 L 0.50 mol/L的H2O2电路中转移1.0 mol e-
二、非选择题
8.由A、B、C、D四种金属按下表中装置进行实验。
装置
现象
二价金属A
不断溶解
C的质
量增加
A上有气
体产生
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是 。
(2)装置乙中正极的电极反应式是 。
(3)装置丙中溶液的pH (填“变大”“变小”或“不变”)。
(4)四种金属活泼性由强到弱的顺序是 。
9.(1)锂锰电池的体积小,性能优良,是常用的一次电池。该电池的反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移进入MnO2晶格中,生成LiMnO2。回答下列问题:
①外电路的电流方向是由 (填“a”或“b”,下同)极流向 极。
②电池的正极反应式为
________________________________________________________________________
________________________________________________________________________。
(2)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下:
①该电池中外电路电子的流动方向为 (填“从A到B”或“从B到A”)。
②工作结束后,B电极室溶液的pH与工作前相比将 (填“增大”“减小”或“不变”,溶液体积变化忽略不计)。
③A电极附近甲醇发生的电极反应为 。
10.[2021·山东济南莱芜一中月考]科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。图甲所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-(O2+4e-===2O2-)。
(1)c电极为 极,d电极上的电极反应式为 。
(2)图乙所示为用惰性电极电解100 mL 0.5 mol·L-1 CuSO4溶液的装置,a电极上的电极反应式为 ;若a电极产生56 mL(标准状况)气体,则所得溶液的pH= (不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入 (填序号)。
a.CuO b.Cu(OH)2
c.CuCO3 d.Cu2(OH)2CO3
(3)用该电池电解KHCO3溶液可使K2CO3溶液再生,其原理如图丙所示。简述再生K2CO3的原理: 。
课练19 原电池 化学电源
狂刷小题 夯基础
[练基础]
1.B A项,在①装置中锌与氢离子反应生成锌离子和氢气,锌棒变细,铜不与氢离子反应,铜棒没有变化。B项,在②装置中锌棒与铜棒通过导线连接形成了闭合回路,构成了原电池,锌失去电子转化为锌离子,锌棒变细,氢离子在铜棒上得电子生成氢气,铜棒不会变细。C项,②装置实现了化学能到电能的转化。D项,在①②装置中,锌均失去电子发生氧化反应。故A、C、D均正确,B不正确。
2.D 电子不能通过电解质溶液,故A项错误;乙烧杯中的电解质溶液为AgNO3溶液,能和KCl反应生成AgCl沉淀,则盐桥中的电解质不能是KCl,故B项错误;铜片是负极,银片是正极,在银片上发生的电极反应是Ag++e-===Ag,故C项错误。
3.B 燃料电池中通入空气(氧气)的电极为正极,则b电极为正极,发生还原反应,再根据题中信息可知电极反应式为4H++O2+4e-===2H2O,A正确;电路中有4 mol电子转移时消耗氧气的物质的量为1 mol,标准状况下体积为22.4 L,则大约消耗标准状况下空气的体积为≈107 L,B错误;由题图可知,SO在硫酸盐还原菌作用下可以将有机物氧化成二氧化碳,自身被还原成HS-,HS-在硫氧化菌的作用下在负极失电子转化为硫酸盐,则维持两种细菌存在,就会持续把有机物氧化成CO2并产生电子,C正确;负极上HS-在硫氧化菌作用下转化为SO,失电子发生氧化反应,电极反应式为HS-+4H2O-8e-===SO+9H+,D正确。
4.B 氢氧燃料电池中,氢气失电子发生氧化反应,通入氢气的a电极为原电池的负极,A正确;氢氧燃料电池中,通入氧气的b电极为原电池的正极,正极上氧气得电子发生还原反应,根据题图可得电极反应式为O2+2H2O+4e-===4OH-,B错误;氢氧燃料电池的产物是水,无污染,是一种具有广泛应用前景的绿色电源,C正确;氢气和氧气可以储存在电池外部的容器中,D正确。
5.D
6.B 根据题意,Mg-海水-AgCl电池总反应式为Mg+2AgCl===MgCl2+2Ag。A项,负极反应式为Mg-2e-===Mg2+,正确;B项,正极反应式为2AgCl+2e-===2Cl-+ 2Ag,错误;C项,对原电池来说,阴离子由正极移向负极,正确;D项,由于镁是活泼金属,则负极会发生副反应Mg+2H2O===Mg(OH)2+H2↑,正确。
7.C 电池工作时,O2在正极发生还原反应:O2+2H2O+4e-===4OH-,由于生成OH-,溶液的pH增大,A错误;当消耗1 mol O2时,电路中转移4 mol电子,生成4 mol OH-,为保持溶液呈电中性,应有4 mol Na+由甲槽向乙槽迁移,B错误;N2H4在负极上失电子发生氧化反应,则负极反应式为4OH-+N2H4-4e-===N2↑+4H2O,C正确。
[练高考]
8.B 金属钠为负极,负极上发生失电子的氧化反应,A错误;碳纳米管为正极,CO2在正极上得电子,发生还原反应,B正确;放电时,阳离子由负极移向正极,C错误;原电池是将化学能转化为电能的装置,D错误。
9.D 由题图可知,b极上O2转化为KO2,则b极为电池正极,a极为电池负极,K+通过隔膜由a极向b极迁移,为避免O2氧化K电极,O2不能通过隔膜,A说法正确;放电时,电流由正极经导线流向负极,即由b极经导线流向a极,充电时,b极接外接电源的正极,b电极为阳极,B说法正确;产生1 Ah电量时,生成KO2与消耗O2的质量比为71∶32≈2.22,C说法正确;消耗3.9 g钾时,转移0.1 mol e-,铅酸蓄电池消耗0.1 mol H2O,其质量为1.8 g,D说法错误。
10.B 在该原电池中,活泼金属锌做负极,则N极为正极,A说法正确;放电时,左侧锌放电产生Zn2+,贮液器中ZnBr2浓度不断增大,B说法错误;充电时,M极为阴极,电极反应式为Zn2++2e-===Zn,C说法正确;放电时Br-通过隔膜进入溶液中与Zn2+结合,充电时Zn2+通过隔膜在双极性碳和塑料电极上沉积,D说法正确。
11.C 原电池放电时,阳离子向正极移动,故K+均向正极移动,A项错误;CH3OH-O2和(CH3)2NNH2-O2放电时产生的二氧化碳与KOH反应,KOH的物质的量减小,N2H4-O2放电时电池总反应式为N2H4+O2===N2+2H2O,放电过程中溶液中KOH的物质的量不变,B项错误;三种燃料转移电子数关系为CH3OH~ 6e-,N2H4~4e-,(CH3)2NNH2~16e-,1 g CH3OH、N2H4、(CH3)2NNH2分别转移mol、 mol、 mol电子,故消耗等质量燃料,(CH3)2NNH2-O2燃料电池理论放电量最大,C项正确;根据N2H4-O2放电时电池总反应式:N2H4+O2===N2+2H2O,可知消耗1 mol O2时,理论上气体产物的体积在标准状况下为22.4 L,D项错误。
12.D A项,放电时Zn极为负极,负极反应式为Zn-2e-+4OH-===Zn(OH),正确;B项,放电时,正极反应为CO2+2e-+2H+===HCOOH,每转化1 mol CO2,转移2 mol电子,正确;C项,充电时,阳极反应式为2H2O-4e-===4H++O2↑,阴极反应式为2Zn(OH)+4e-===2Zn+8OH-,将两极电极反应式相加得总反应,正确;D项,充电时,正极氢氧根离子放电生成O2,溶液中OH-浓度降低,错误。
13.B 由题给信息知VB2电极上发生失电子的氧化反应,则VB2电极为负极,复合碳电极为正极,正极发生还原反应,电极反应式为:O2+4e-+2H2O===4OH-,电池总反应方程式为:4VB2+11O2+20OH-+6H2O===8B(OH)+4VO。由上述分析知,正极的电极反应式为O2+4e-+2H2O===4OH-,则电路中通过0.04 mol e-时,正极有0.01 mol O2参加反应,其在标准状况下的体积为0.224 L,A项正确;由正、负极的电极反应式可知,该电池工作时,负极区溶液的pH降低,正极区溶液的pH升高,B项错误;由上述分析知,该电池的总反应方程式为4VB2+11O2+20OH-+6H2O===8B(OH)+4VO,C项正确;电流与电子的流动方向相反,电流从正极出发,沿负载流向负极,再经过溶液最终回到正极,D项正确。
[练模拟]
14.D 根据原电池装置图分析,H2N(CH2)2NH2在a电极上失电子发生氧化反应,生成氮气、二氧化碳和水,则a为负极,电极反应式为H2N(CH2)2NH2+4H2O-16e-===2CO2↑+N2↑+16H+,氧气在正极b上得电子发生还原反应,电极反应式为:O2+4e-+4H+===2H2O,据此分析解答。
H2N(CH2)2NH2在负极a上失电子发生氧化反应,生成氮气、二氧化碳和水,电极反应式为H2NCH2CH2NH2-16e-+4H2O===2CO2↑+N2↑+16H+,A选项正确;原电池中,阳离子向正极移动,阴离子向负极移动,因此,电池工作时质子(H+)通过质子交换膜由负极区向正极区移动,B选项正确;由上述分析可知,a电极为负极,b电极为正极,故a电极上的电势比b电极上的电势低,C选项正确;电池工作时,氧气在正极b上得电子发生还原反应,发生的电极反应式为O2+4e-+4H+===2H2O,H+浓度减小,故b电极附近溶液的pH增大,D选项错误;故选D。
15.D 由放电时总反应2Zn+O2+4OH-+2H2O===2[Zn(OH)4]2-和装置图可知,金属Zn为负极,放电时发生反应:Zn+4OH--2e-===[Zn(OH)4]2-,多孔碳为正极发生反应:O2+4e-+2H2O===4OH-,充电时总反应为2[Zn(OH)4]2-===2Zn+O2↑+4OH-+2H2O,金属Zn为阴极,多孔碳为阳极,以此分析。
放电时,负极反应为Zn +4OH--2e-===[Zn(OH)4]2-,A项错误;正极发生反应:O2+4e-+2H2O===4OH-,可知该隔膜为阴离子交换膜,允许OH-通过,B项错误;不论放电还是充电,电子不会流经电解质溶液,C项错误;采用多孔炭可提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面,D项正确;故选D。
16.B 闭合K2、断开K1时,制氢并储能,构成电解池,Pt电极发生还原反应,为阴极,X电极发生氧化反应,为阳极;断开K2、闭合K1时,构成原电池,X电极发生还原反应,为正极,Zn电极发生氧化反应,为负极。制氢时,Pt电极为阴极,电子从X电极向Pt电极移动,溶液中K+向Pt电极移动,A正确,不选;供电时,Zn电极发生氧化反应,发生反应Zn-2e-+4OH-===ZnO+2H2O,消耗OH-,pH减小,B错误,符合题意;供电时,X电极发生还原反应,NiOOH转化为Ni(OH)2,C正确,不选;制氢时,X电极为阳极,反应式为Ni(OH)2-e-+OH-===NiOOH+H2O,D正确,不选;故选B。
综合测评 提能力
1.D 由甲烧杯中溶液颜色不断变浅,可知KMnO4中Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极,所以总的电极反应式为2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O。由于Fe2+在b电极失去电子,发生氧化反应,所以b极是电池的负极,A错误;K+向正极移动,所以K+从盐桥流向甲烧杯,B错误;甲烧杯中a电极上MnO获得电子,发生还原反应,Mn元素的化合价降低,电极反应为MnO+8H++5e-===Mn2++4H2O,所以甲烧杯中溶液的pH逐渐增大,C错误;由总的电极反应式可知,反应的离子方程式为MnO+5Fe2++8H+===Mn2++5Fe3++4H2O,D正确。
2.A 电解质溶液显碱性或中性,该燃料电池的正极反应均为O2+2H2O+4e-===4OH-,A正确;铝作负极,铝失去电子变为Al3+,在NaOH溶液中反应生成AlO,则负极反应为Al+4OH--3e-===AlO+2H2O,B错误;该电池在碱性条件下消耗了OH-,生成H2O,总反应式为4Al+3O2+4OH-===4AlO+2H2O,溶液pH降低,C错误;电池工作时,电子从负极流出经过外电路流到正极,D错误。
3.C 电池工作时,电子从负极经导线流向正极,不进入电解质溶液,A错误;N2H4在负极上发生氧化反应生成N2,电解质溶液是KOH溶液,则电极反应式为N2H4+4OH--4e-===N2↑+4H2O,B错误;正极反应式为O2+2H2O+4e-===4OH-,综合两电极反应式可得燃料电池总反应式为N2H4+O2===N2+2H2O,反应生成H2O,c(KOH)逐渐减小,溶液的pH减小,C正确;O2参与正极反应,电路中通过0.1 mol电子时,正极上消耗0.025 mol O2,在标准状况下的体积为0.025 mol×22.4 L·mol-1=0.56 L,D错误。
4.C O2通入Pt(Ⅰ)极,发生还原反应,则Pt(Ⅰ)是正极,Pt(Ⅱ)是负极,故电子由Pt(Ⅱ)极经电流计传到Pt(Ⅰ)极,A错误;X为NH3,Y为N2,M为熔融KOH,则负极反应为2NH3+6OH--6e-===N2+6H2O,B错误;M是含O2-的固体电解质,则正极的电极反应式为O2+4e-===2O2-,C正确;X为CO,M为KOH溶液,则电池总反应为2CO+O2+4KOH===2K2CO3+2H2O,D错误。
5.C 由电池总反应VO(黄色)+V2+(紫色)+2H+===VO2+(蓝色)+H2O+V3+(绿色)可得,VO为正极的活性物质,V2+为负极的活性物质,所以左室为正极室,右室为负极室。正极反应为VO+2H++e-===VO2++H2O,A项正确;负极反应为V2+-e-===V3+,所以负极附近溶液的颜色由紫色逐渐变为绿色,B项正确;由电极反应VO+2H++e-===VO2++H2O可知,反应每生成1 mol H2O时转移电子的物质的量为1 mol,C项错误;由原电池总反应可知,反应过程中H+被不断消耗,所以溶液的pH逐渐增大,D项正确。
6.B 结合图示可知放电时的电极反应如下:
电极名称
电极反应
负极(a极)
CH3COO-+2H2O-8e-===2CO2↑+7H+
正极(b极)
2H++2e-===H2↑
根据上述分析可知,A项正确;该电池工作时,Cl-向a极移动,Na+向b极移动,即隔膜1为阴离子交换膜,隔膜2为阳离子交换膜,B项错误;电路中转移1 mol电子时,向a极和b极分别移动1 mol Cl-和1 mol Na+,则模拟海水理论上可除盐58.5 g,C项正确;电池工作时负极产生CO2,正极产生H2,结合正、负极的电极反应知,一段时间后,正极和负极产生气体的物质的量之比为2∶1,D项正确。
7.A 由工作原理装置图可知,负极发生氧化反应,电极反应式为BH+8OH--8e-===BO+6H2O,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-===2OH-。
由图知X极为负极,电子经X流向外电路流入Y,A错误;Y极为正极,H2O2发生还原反应:H2O2+2e-===2OH-,B正确;X极发生氧化反应:BH+8OH--8e-===BO+6H2O,故X极区溶液的pH逐渐减小,C正确;由电极反应式H2O2+2e-===2OH-知,每消耗1.0 L 0.50 mol/L的H2O2电路中转移1.0 mol e-,D正确;故选A。
8.答案:(1)A-2e-===A2+ (2)Cu2++2e-===Cu (3)变大 (4)D>A>B>C
解析:甲、乙、丙均为原电池装置。依据原电池原理,甲中A不断溶解,则A为负极、B为正极,活泼性:A>B;乙中C极增重,即析出Cu,则B为负极,活泼性:B>C;丙中A上有气体即H2产生,则A为正极,活泼性:D>A,随着H+的消耗,pH变大。
9.答案:(1)①b a ②MnO2+e-+Li+===LiMnO2
(2)①从A到B ②不变 ③CH3OH+H2O-6e-===6H++CO2↑
解析:(1)①结合所给装置图以及原电池反应原理,可知Li作负极,MnO2作正极,所以电子流向是a→b,电流方向则是b→a。②根据题给信息“电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移进入MnO2晶格中,生成LiMnO2”,所以正极的电极反应式为MnO2+e-+Li+===LiMnO2。(2)①甲醇失去电子,作为电池的负极,所以该电池外电路电子的流动方向为从A到B。②B电极上O2得电子消耗H+,同时溶液中的H+移向B电极室,所以B电极室溶液的pH与工作前相比未发生变化。③CH3OH失电子,生成CO2和H+,根据化合价变化和元素守恒配平方程式即可得电极反应式:CH3OH+H2O-6e-===6H++CO2↑。
10.答案:(1)正 CH4+4O2--8e-===CO2+2H2O
(2)4OH--4e-===2H2O+O2↑ 1 ac
(3)HCO存在电离平衡:HCO⇌H++CO,阴极H+放电,使H+浓度减小,导致平衡右移(或溶液中H+放电,增大了OH-浓度,OH-与HCO反应,从而使CO再生)
解析:(1)该装置为原电池,外电路中电流由c极流向d极,则c极为正极,氧气得电子发生还原反应生成O2-,d极为负极,甲烷失电子发生氧化反应;固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-,则d极的电极反应式为CH4+4O2--8e-===CO2+2H2O。(2)电解100 mL 0.5 mol·L-1 CuSO4溶液,总反应为2CuSO4+2H2O2Cu+O2↑+2H2SO4,与电源正极相连的为阳极,溶液中的氢氧根离子失去电子发生氧化反应,则a电极的电极反应式为4OH--4e-===2H2O+O2↑;根据总反应方程式可知,若a电极产生56 mL(标准状况下,n=2.5×10-3mol)氧气,溶液中生成氢离子的物质的量为0.01 mol,c(H+)==0.1 mol·L-1,pH=-lg 0.1=1;电解过程中,每生成2 mol Cu,会生成1 mol O2,为了使CuSO4溶液恢复原浓度,应加入CuO或CuCO3。
相关试卷
这是一份高考化学一轮复习第6章化学反应与能量第19讲原电池化学电源考点1原电池试题PDF版
这是一份统考版高考化学一轮复习课时作业19原电池化学电源含答案,共10页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份统考版高考化学一轮复习课时作业19原电池化学电源含答案,共10页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。








