所属成套资源:暑假专区化学高二年级练习整册
新教材高二化学下学期暑假巩固练习9原子结构与性质含答案
展开
这是一份新教材高二化学下学期暑假巩固练习9原子结构与性质含答案,共10页。试卷主要包含了下列说法正确的是,下列关于原子光谱的说法错误的是,具有下列电子层结构的原子等内容,欢迎下载使用。
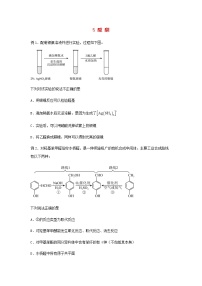
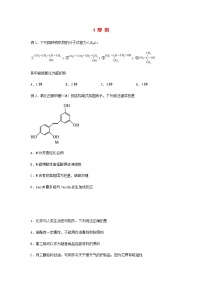
9 原子结构与性质例1.下列说法正确的是A.电负性越大,非金属性越强,第一电离能也越大B.若将基态原子的核外电子排布式写成,则违背了泡利原理C.卤素单质、卤素氢化物、卤素碳化物(CX4)的熔沸点均随相对分子质量的增大而升高D.构造原理告诉我们,随着核电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层例2.短周期元素X、Y、Z、M、W的原子序数依次增大,X、M、W分属不同周期,它们组成的一种分子的结构式如图所示。下列说法正确的是A.简单气态氢化物的稳定性: B.原子半径的大小:C.氧化物对应的水化物的酸性: D.中Z的化合价为价 1.下列表达方式不正确的是A.H2O的电子式:B.基态N原子的价层电子排布图:C.基态s原子的结构示意图:D.基态Fe2+的价层电子排布式为:[Ar]3d44s22.下列说法正确的是A.CH4分子的球棍模型为B.铍原子最外层的电子云图为C.基态Mn2+的价电子轨道表示式为D.某基态原子的核外电子排布为,该表达式违背了洪特规则3.下列与原子核外电子排布规律相关的叙述中(n为能层序数)不正确的是A.前四周期元素的基态原子中,未成对电子数最多的是铬B.电子填入能级的顺序是np→(n+1)s,因此原子核外最外层电子数一般不超过8C.由3d能级有5个轨道可知,元素周期表中第四周期元素比第三周期元素多10种D.基态原子的最外层电子排布为ns2的元素,在元素周期表中均位于第IIA族4.1919年卢瑟福在核反应中用α粒子(即氦核)轰击短周期非金属原子,得到核素和粒子M,其过程为:+→+M。其中元素X、Y、M的质子数之和为16。下列说法正确的是A.粒子M中含有1个中子 B.简单阴离子的还原性:X<YC.第一电离能:X<Y D.XCl3中所有原子均为8电子稳定结构5.已知元素X简单气态氢化物和其最高价含氧酸可化合生成一种盐,基态Y原子最外层电子排布为nsnnpn+2。下列说法错误的是A.原子半径:X>Y B.X、Y均属于p区元素C.X、Y的电负性:X>Y D.X、Y的简单氢化物热稳定性:X<Y6.下列关于原子光谱的说法错误的是A.原子光谱告诉我们原子核外电子的能量是量子化的B.通过原子光谱可以发现新的元素,也可以鉴定某些元素C.焰色试验是电子从激发态跃迁回基态时才有的现象D.原子光谱包括吸收光谱和发射光谱7.在元素周期表中的某些元素之间存在着特殊的“对角线规则”,如Li和Mg、Be和Al、B和Si的一些性质相似。下列说法不正确的是A.氢氧化铍是两性氢氧化物 B.B和Si的电负性数值相近C.Li在N2中燃烧生成Li3N D.Li和Mg的原子半径相近,且核外电子排布相同8.具有下列电子层结构的原子:①3p轨道上只有一对成对电子的原子②最外层电子排布式为的原子③其3p轨道为半充满状态的原子④+3价的阳离子结构与氖相同的原子。则下列有关比较正确的是A.第一电离能:②>③>①>④ B.原子半径:④>③>②>①C.电负性:②>③>①>④ D.最高化合价:②>①>③>④9.已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。根据如表所列数据判断错误的是元素I1I2I3I4X500460069009500Y5801800270011600A.元素X与氢形成化合物XH,X的化合价是+1B.元素X与氯形成化合物时,化学式可能是XClC.元素Y是IIIA族的元素D.若元素Y处于第三周期,它的价电子排布式是3s23p210.2020年12月17日,“嫦娥五号”探测器上的四器之一“返回器”安全着陆。据悉,“嫦娥五号”探测器上所需的铝合金材料要求具有高稳定性,高强度,耐腐蚀,抗恶劣环境强等性能。下列关于铝的说法正确的是A.铝元素在周期表中位于第三周期,第III族B.基态铝原子的最外层电子排布为3s23p1C.铝原子的最外层只有一个电子D.基态铝原子一共有三个能级11.科技发展、生产、生活都离不开化学。2021年是我国人工智能、航空航天、量子通信、生命科学大放异彩的一年。下列说法错误的是A.“祝融号”火星探测器上使用的钛合金具有优良的性能。钛原子的电子排布式为B.“天问一号”中形状记忆合金的两种金属都属于过渡金属元素,在元素周期表中位于ds区C.清华大学打造的世界首款异构融合类脑芯片—天机芯的主要材料与光导纤维不同D.量子通信材料螺旋碳纳米管TEM与石墨烯互为同素异形体12.短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y是金属元素。X原子的最外层电子数是其电子层数的2倍,Z原子的最外层有6个电子,X、Y、W原子最外层电子数之和等于12。下列叙述正确的是A.原子半径:r(Y)<r(Z)<r(W)B.工业上常用电解的方法制备元素Y的单质C.Z分别与X、Y形成的化合物中化学键类型相同D.最高价氧化物对应水化物的酸性:X>W13.X、Y、Z、M、W为五种原子序数依次递增的前36号元素。X、Y是同周期元素,原子序数相差1,价电子数之和为11;Z为第3周期元素,价电子数为2;基态M原子有6个未成对电子;W属于ds区元素,有1个未成对电子。下列说法正确的是A.原子半径:Z>Y>X,电负性:Y>X>ZB.M为VIB族元素,W+价电子排布式为3d94s1C.Z(XY3)2晶体含离子键和共价键,离子半径:Y<ZD.X和Y的简单氢化物分子间均存在氢键
例1.【答案】D【解析】A.如电负性O>N,非金属性O>N,第一电离能N>O,A错误;B.泡利原理为不能有两个或两个以上的粒子处于完全相同的状态,原子的核外电子排布式写成违背了洪特规则,B错误;C.卤素氢化物中HF分子间能形成氢键,其熔沸点最高,C错误;D.构造原理告诉我们,随着核电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层,是能级交错现象,D正确;答案选D。例2.【答案】D【解析】根据短周期元素X、Y、Z、M、W的原子序数依次增大,X、M、W分属不同周期和形成分子的结构,X、M、W都形成1个共价键,Y形成4个共价键,Z形成2个共价键,可得X、Y、Z、M、W分别为H、C、O、F、Cl。A.F的非金属性大于O,故简单气态氢化物的稳定性HF>H2O,故A错误;B.同周期元素随核电荷数的增加原子半径逐渐减小,故C>O>F,故B错误;C.非金属性Cl>C,故最高价氧化物对应水化物的酸性HClO4>H2CO3,但是氧化物对应的水化物的酸性不能比较,如HClO<H2CO3,故C错误;D.OF2中F为-1价,O为+2价,故D正确;故选D。 1.【答案】D【解析】A.水的氢氧键共用电子对,电子式正确,A正确;B.基态氮原子的价层电子排布为2s22p3,价层电子排布图正确,B正确;C.基态S原子序数为16,原子结构示意图正确,C正确;D.亚铁离子的价层电子排布式为3d6,D错误;故选D。2.【答案】D【解析】A.图示为甲烷的比例模型,A错误;B.铍原子的最外层电子占据2s能级,电子云图为球形,B错误;C.Mn2+的价层电子轨道表示式为:,C错误;D.该原子2p轨道中三个单电子,电子应该保持自旋方向相同,图示违反了洪特规则,D正确;故选D。3.【答案】D【解析】A.前四周期元素中未成对电子数最多的元素的价电子排布为3d54s1,是24号元素铬,A正确;B.因为(n+1)s能级的能量略高于np能级,当电子填满能级np后,电子进入(n+1)s能级,所以原子核外最外层电子数一般不超过8,B正确;C.第二周期元素电子排布只进入2p、3p能级,第四周期元素电子逐渐排满3d能级,3d能级有5个轨道,最多容纳10个电子,则元素周期表中第四周期元素比第三周期元素多10种,C正确;D.基态原子的最外层电子排布为ns2的元素,次外层不一定排满电子,(n-1)d轨道容纳电子数可能为1、2、3、5、6、7、8、10,所以最外层电子排布为ns2的元素不一定位于第IIA族,D不正确;故选D。4.【答案】D【解析】由可知,M质子数为1,质量数为1,则M为H,元素X、Y、M的质子数之和为16,即z+z+1+1=16,解得z=7,即X为N,Y为O,据此分析。A.由分析可知,粒子M中含有M质子数为1,质量数为1,故不含1中子,A错误;B.由分析可知,X为N,Y为O,且元素的非金属性越强,单质的氧化性就越强,则对应最简单氢化物的还原性的还原性就越弱,故简单氢化物的还原性:,B错误;C.由分析可知,X为N,Y为O,同一周期从左往右第一电离能呈增大趋势,但ⅡA和ⅢA,ⅤA和ⅥA反常,故第一电离能:,C错误;D. 即NCl3中N形成三个共价键,则最外层电子数为5+3=8,Cl形成一个共价键,则最外层电子数为7+1=8,则所有原子均为8电子稳定结构,D正确;故选D。5.【答案】C【解析】由于元素X简单气态氢化物和其最高价含氧酸可化合生成一种盐,则X为氮元素,根据基态Y原子最外层电子排布为nsnnpn+2可知,Y为氧元素。A.同一周期主族元素从左向右原子半径逐渐减小,原子半径:N>O即X>Y,A正确;B.N的电子排布式为1s22s22p3,O的电子排布式为1s22s22p4,故X、Y均属于p区元素,B正确;C.X为N,Y为O,同一周期主族元素从左往右电负性逐渐增大,电负性:X<Y,C错误;D.X为N,Y为O,元素非金属性越强,其简单氢化物越稳定,非金属性N<O,简单氢化物热稳定性:X<Y,D正确;答案选C。6.【答案】C【解析】A.原子的线状光谱告诉我们原子核外电子的能量是量子化的,故A正确;B.原子光谱用于测定原子种类,通过原子光谱可以发现新的元素,故B正确;C.焰色试验是金属原子或离子从较高能量的激发态跃迁到较低能量的激发态或基态时,将能量以光的形式表现出来的现象,故C错误;D.原子光谱包括吸收光谱和发射光谱,电子由较高能量的激发态跃迁到较低能量的激发态或基态时产生发射光谱,电子由基态或较低能量的激发态跃迁到较高能量的激发态产生吸收光谱,故D正确;选C。7.【答案】D【解析】A.Be~Al为对角线位置,氢氧化铝具有两性,则氢氧化铍是两性氢氧化物,故A正确;B.B~Si为对角线位置,电负性数值相近,故B正确;C.Mg在N2中燃烧生成Mg2N3,则由对角线规则可知,Li在N2中燃烧生成Li3N,故C正确;D.电子层越多,原子半径越大,则Mg的原子半径大于Li的原子半径,且电子排布不同,故D错误;故选D。8.【答案】A【解析】①3p轨道上只有一对成对电子的原子,则该元素为S;②外围电子构型为2s22p5的原子,则该元素为F;③其3p轨道为半充满的原子,则该元素为P;④正三价的阳离子结构与氖相同的原子,即失去3个电子后还有10个电子,所以原子中含有13个电子,即为Al元素。A.不同周期中非金属性越强,第一电离能越大,同周期中从左到右第一电离能增大,但是第VA族大于第VIA族,所以第一电离能:F>P>S>Al,即:②>③>①>④,故A正确;B.电子层越多,半径越大,电子层相同时,原子序数越大,半径越小,所以原子半径:Al>P>S>F,即:④>③>①>②,故B错误;C.元素的非金属性越强,则电负性越强,所以电负性:F>S>P>Al,即:②>①>③>④,故C错误;D.最高正化合价等于最外层电子数,F没有最高正价,所以S>P>Al>F,即:①>③>④>②,故D错误;故选A。9.【答案】D【解析】根据表中数据可知,X元素的I1到I2变化比较大,说明X最外层只有1个电子,属于IA族,Y元素的I3到I4变化比较大,说明Y元素最外层有3个电子,属于IIIA族,据此分析。A.根据上述分析,X元素属于IA族,除H均为活泼金属,与氢形成化合物的化学式为XH,X的化合价为+1价,故A说法正确;B.根据上述分析,X元素属于IA族,最高化合价为+1价,与Cl形成的化合物为XCl,故B说法正确;C.根据上述分析,Y元素属于IIIA族,故C说法正确;D.Y元素属于IIIA族,最外层有3个电子,若Y位于第三周期,其价电子排布式为3s23p1,故D说法错误;答案为D。10.【答案】B【解析】A.Al为13号元素,在周期表中位于第三周期,第IIIA族,故A错误;B.基态铝原子的核外电子排布式为1s22s22p63s23p1,故最外层电子排布为3s23p1,故B正确;C.铝原子结构示意图为,最外层有3个电子,故C错误;D.基态铝原子的核外电子排布式为1s22s22p63s23p1,有5个能级,故D错误;故选B。11.【答案】B【解析】A.钛合金具有密度小、强度高、耐高温的特性,钛原子的电子排布式为,A正确;B.Ti、Ni都属于过渡金属元素,位于元素周期表d区,B错误;C.芯片的主要材料是晶体硅,光导纤维的主要材料是二氧化硅,两者不相同,C正确;D.碳纳米管TEM与石墨烯均是碳单质,互为同素异形体,D正确;故选B。12.【答案】B【解析】X原子的最外层电子数是其电子层数的2倍,则X为C或S,若X为S,则Y、Z、W不可能全为短周期主族元素,所以X为C;Y为金属元素,且原子序数大于C,则Y为第三周期元素;Z原子的最外层有6个电子,原子序数大于Y,为S元素;则W只能为Cl元素;X、Y、W原子最外层电子数之和等于12,则Y的最外层电子数为12-4-7=1,所以Y为Na元素。A.同周期主族元素自左至右原子半径依次减小,所以r(Y)>r(Z)>r(W),故A错误;B.Na为活泼金属,通过电解熔融NaCl制取Na单质,故B正确;C.S与C可以形成化合物CS2只含共价键,S与Na可形成化合物Na2S,只含离子键,化学键类型不同,故C错误;D.C的非金属性弱于Cl,则C的最高价氧化物对应水化物的酸性比Cl的弱,即最高价氧化物对应水化物的酸性:X<W,故D错误;故选B。13.【答案】D【解析】由X、Y、Z、M、W为五种原子序数依次递增的前36号元素,X、Y是同周期元素,原子序数相差1,价电子数之和为11可知,X为N元素,Y为O元素或X为P元素、Y为S元素;Z为第3周期元素,价电子数为2,则Z为Mg元素,则由原子序数依次递增可知X为N元素,Y为O元素。基态M原子有6个未成对电子,则M为Cr元素;W属于ds区元素,有1个未成对电子,则W为Cu元素。A.由分析知X为N元素, Y为O元素,Z为Mg元素,同一周期原子半径从左向右减小,则原子半径:Z>X>Y;元素的非金属性越强,电负性越大,氧元素的非金属性强于氮元素,则电负性Y>X> Z,故A错误;B.由分析知W为Cu元素,位于元素周期表IB族,铜原子失去一个电子形成Cu+,Cu+的价电子排布式为3d10,故B错误;C.由分析知X为N元素, Y为O元素,Z为Mg元素,则Z(XY3)2为Mg(NO3)2,硝酸镁为含有离子键和共价键的离子化合物,离子半径O2->Mg2+,故C错误;D.由分析知X为N元素, Y为O元素,则X和Y的简单氢化物为H2O和NH3,水分子和氨分子分子间均存在氢键,故D正确;故选D选项。
相关试卷
这是一份新教材高二化学下学期暑假巩固练习11晶体结构与性质含答案,共13页。试卷主要包含了下列有关晶体的说法中正确的是,下列关于晶体的分类正确的是,下列说法不正确的是,观察表中数据,下列说法错误的是等内容,欢迎下载使用。
这是一份新教材高二化学下学期暑假巩固练习7有机合成推断含答案,共23页。试卷主要包含了以a为原料制备d的路线如图所示,芳香族化合物有如下的转化关系等内容,欢迎下载使用。
这是一份新教材高二化学下学期暑假巩固练习6羧酸羧酸衍生物含答案,共13页。试卷主要包含了有机物的结构简式如下图等内容,欢迎下载使用。