






所属成套资源:新人教版2019版高中化学选择性必修一
- 3.2.2 酸碱中和滴定(课件)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)(共42张PPT) 课件 3 次下载
- 3.3.1 盐类的水解(课件)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)(共29张PPT) 课件 3 次下载
- 3.4.1 难溶电解质的沉淀溶解平衡(课件)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)(共39页PPT) 课件 3 次下载
- 3.4.2 沉淀溶解平衡的应用(课件)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)(共32页PPT) 课件 3 次下载
- 4.1.2 化学电源(课件)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)(共31页PPT) 课件 4 次下载
3.3.2 影响盐类水解的主要因素 盐类水解的应用(课件)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)(共42页PPT)
展开
这是一份3.3.2 影响盐类水解的主要因素 盐类水解的应用(课件)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)(共42页PPT),共42页。
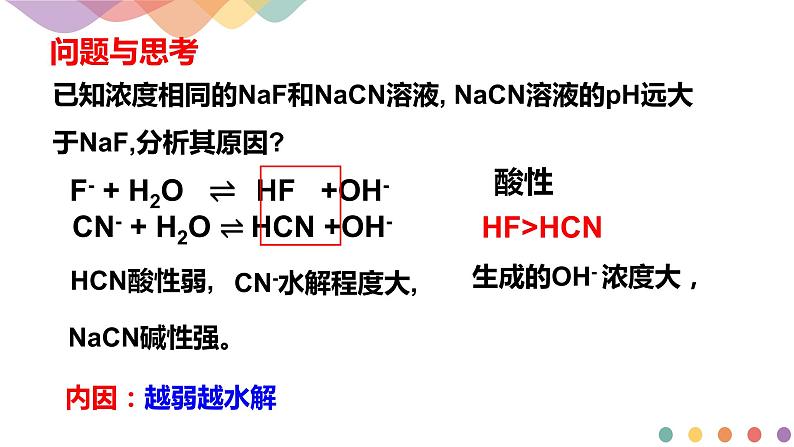
第2课时 影响盐类水解的因素 盐类水解的应用第三节 盐类水解盐类的水解实质1、生成弱电解质2、破坏水的电离平衡 谁弱谁水解 谁强显谁性 越弱越水解 无弱不水解 都弱双水解条件1、盐中必须有弱根2、盐必须溶于水 【知识回顾】规律F- + H2O ⇌ HF +OH- CN- + H2O ⇌ HCN +OH- 已知浓度相同的NaF和NaCN溶液, NaCN溶液的pH远大于NaF,分析其原因?酸性HF>HCNHCN酸性弱,CN-水解程度大,生成的OH- 浓度大,问题与思考内因:越弱越水解NaCN碱性强。影响盐类水解的因素:盐水解生成的弱酸或弱碱越弱,水解程度就越大,溶液相应的碱性或酸性就越强NH4Cl < AlCl3②比较等浓度 NH4Cl溶液与AlCl3溶液的酸性:①已知酸性:CH3COOH>H2CO3>HClO>HCO3-,比较等浓度CH3COONa,Na2CO3,NaHCO3,NaClO碱性 Na2CO3 > NaClO > NaHCO3> CH3COONa1.内因(决定因素):反应物的性质(越弱越水解)同物质的量浓度NaX、NaY、NaZ三种正盐溶液,测得溶液的pH分别是7、9、10,则相对应的酸:HX、HY、HZ的酸性比较。HX>HY>HZ随堂小练2. 外因(外界条件): 盐类的水解程度受到盐的浓度、温度及溶液酸碱度的影响 --符合勒夏特列原理 ①温度:水解是中和反应的逆反应, 放热反应是吸热反应(△H>0)。升高温度,盐类水解平衡向正反应方向移动,有利于盐类的水解。--越热越水解②浓度: a. 加水(减小浓度):越稀越水解b. 加溶质(增大浓度):水解程度减小③外加酸、碱 对强碱弱酸盐,加酸促进水解,加碱抑制水解。 对强酸弱碱盐,加酸抑制水解,加碱促进水解。即:酸可抑制阳离子水解,促进阴离子水解;碱可抑制阴离子水解,促进阳离子水解。 ④盐水解情况相同的离子的水解相互抑制,水解情况相反的离子的水解相互促进(双水解)在0.01mol/LFeCl3溶液中: Fe3++3H2O⇌Fe(OH)3 + 3H+ 正向增大增大减小颜色变深正向增大减小增大颜色变浅逆向减小增大减小颜色变浅正向增大减小增大红褐色↓正向增大减小增大红褐色↓无色↑逆向减小增大减小颜色变浅颜色变深正向增大减小增大正向增大减小增大红褐色↓无色↑比较下列溶液的pH大小(填“>”“c(HCO3-)>c(CO32-)>c(H+)>c(OH-)(B)c(Na+)+c(H+)=c(OH-)+c(CO32-) +c(HCO3-)(C)c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)(D)c(Na+)=c(HCO3-)+c(H2CO3)+c(OH-)(E)c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)CE当堂巩固随堂小练在0.2mol/L的NH4Cl溶液中,下列关系式正确的是( )A.c(Cl-)> c( NH4+ ) >c( H+ ) >c( OH- )B.c( NH4+ ) > c(Cl- ) >c( H+ ) >c( OH- )C. c(Cl- ) =c( NH4+ ) >c(H+ ) =c( OH- ) D.c( NH4+ ) =c(Cl- ) >c( H+ ) >c( OH- )A随堂小练将10mL0.1mol/L氨水和10mL0.1mol/L盐酸混合后, 溶液里各种离子物质的量浓度的关系是 ( )A.C(Cl-)+C(OH-)=C(NH4+)+C(H+) B. C(Cl-)> C(NH4+)> C(H+) > C(OH-)C.C (H+) > C(OH-)>C (Cl-)>C(NH4+) D.C(Cl-)> C(H+) >C (NH4+)>C (OH-)AB随堂小练下列根据反应原理设计的应用,不正确的是( )A.CO32-+H2O⇌HCO3-+OH-热的纯碱溶液清洗油污B.Al3++3H2O ⇌ Al(OH)3+3H+明矾净水C.TiCl4+(x+2)H2O(过量) ⇌ TiO2·xH2O+4HCl用TiCl4制 备TiO2D.SnCl2+H2O ⇌ Sn(OH)Cl+HCl配制氯化亚锡溶液 时加入氢氧化钠D随堂小练影响盐类水解的因素1、决定因素(内因):2、外界条件(外因):(1)浓度:(2)温度:(3)外加酸、碱: 加酸抑制强酸弱碱盐的水解、促进强碱弱酸盐的水解 ; 加碱抑制强碱弱酸盐的水解、促进强酸弱碱盐的水解。课堂小结-- 浓度、温度及溶液酸碱度越热越水解越稀越水解越弱越水解盐类水解的利用课堂小结感谢您的观看
相关课件
这是一份苏教版 (2019)第三单元 盐类的水解试讲课ppt课件,共19页。PPT课件主要包含了随堂反馈,①升温,促进水解,②稀释,③加入物质,盐类水解平衡常数,盐类水解的应用,课堂小结等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡实验活动3 盐类水解的应用精品课件ppt,共35页。PPT课件主要包含了盐类的水解,知识回顾,HCHBHA,盐类水解的特点,CH3COOH,水解平衡常数,盐类水解的应用等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1实验活动3 盐类水解的应用优秀课件ppt,文件包含332影响盐类水解的主要因素盐类水解的应用练习解析版docx、332影响盐类水解的主要因素盐类水解的应用练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。










