





所属成套资源:鲁科版(2019)化学选择性必修2PPT课件整册
高中化学鲁科版 (2019)选择性必修2第2节 原子结构与元素周期表课文内容课件ppt
展开
这是一份高中化学鲁科版 (2019)选择性必修2第2节 原子结构与元素周期表课文内容课件ppt,共58页。PPT课件主要包含了必备知识·素养奠基,价电子数目,价电子排布,ns1~2,ns2np1~5,价电子数,关键能力·素养形成,课堂回眸,课堂检测·素养达标等内容,欢迎下载使用。
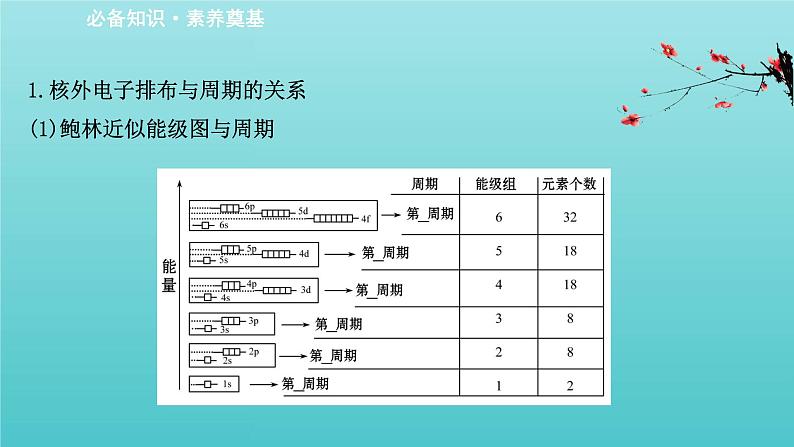
1.核外电子排布与周期的关系(1)鲍林近似能级图与周期
(2)结论:①能级组中n的最大值等于周期数;②能级组中最多容纳的电子数等于该周期中所容纳的元素种类数。
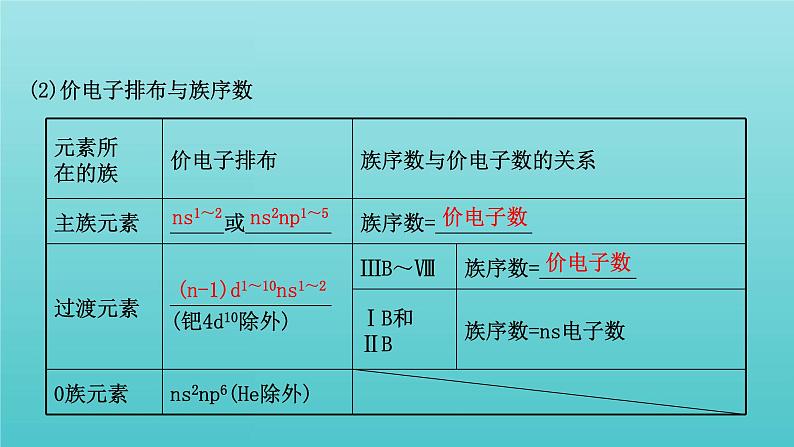
2.核外电子排布与族的关系(1)族①划分依据取决于原子的___________和___________。②特点:同族元素的价电子数目和价电子排布_____。
(2)价电子排布与族序数
(n-1)d1~10ns1~2
【情境·思考】独居石的英文名称mnazite来自希腊文mnazem,意为无伴独居之意,寓意矿物产出稀少。为浅黄色至浅红褐色,强玻璃光泽或松脂光泽至蜡状光泽,微透明至透明。世界上出产宝石级独居石的国家有美国、玻利维亚等。透明宝石个体不大,已知最大者约5克拉。不透明的大晶体用于琢磨弧面型宝石。据国外有关资料报道,在“独居石”中,查明有116号元素。
若116号元素的价电子排布式为7s27p4,试判断该元素应位于周期表中的哪个位置?提示:根据周期数等于电子层数,主族序数等于价电子数,可判断116号元素应位于第7周期ⅥA族。
【巧判断】(1)价电子就是原子的最外层电子。( )提示:×。对于主族元素来说,价电子就是最外层电子,但是对于副族和Ⅷ族元素来说,价电子包含了部分的次外层电子,有的甚至还包括部分的倒数第三层电子。(2)每一周期元素都是以ns1开头,以ns2np6结束。( )提示:×。并不是每一周期元素都是以ns1开头,以ns2np6结束,如:第一周期的元素以1s2结束。
3.元素周期表的分区(1)分区的标准:按电子排布,可把周期表里的元素划分成5个区。除ds区外,区的名称来自按构造原理最后填入电子的能级符号。(2)原子核外电子排布与区的划分
【想一想】最活泼的金属元素、最活泼的非金属元素、常温下呈液态的金属(价电子排布为5d106s2)元素分别位于下面元素周期表中的哪个分区?提示:最活泼的金属元素在ⅠA族,s区;最活泼的非金属元素(是氟)在ⅦA族,p区;汞的价电子排布为5d106s2,在ⅡB族,ds区。
知识点一 核外电子排布与周期与族的划分【重点释疑】1.核外电子排布与周期的划分(1)每一周期元素原子的价电子排布和元素种数的关系。
(2)核外电子排布与周期划分的关系。每一个能级组对应一个周期,且该能级组中最大的电子层数等于元素的周期序数。
2.核外电子排布与族序数之间的关系(1)族序数与核外电子排布的关系。族序数从左向右的排列顺序与核外电子排布的关系如下:①进入ns(ns1~2,1s2除外)为ⅠA族、ⅡA族。
(2)有关规律。由上可知:①主族元素的最外层电子数,即价电子数,为其族序数;②副族元素中ⅢB~ⅦB族元素价电子数为其族序数;③稀有气体单独列为0族。
【思考·讨论】(1)同一族的元素的价电子数相同,价电子排布式也相同吗?提示:不相同。同一主族元素的价电子数相同,其价电子排布式中能级不同,价电子排布式不同。(2)某元素基态原子的最外层电子排布式为ns2,该元素一定是第ⅡA族元素吗?提示:不一定。价电子排布式为ns2的原子可能是第ⅡA族元素也可能是0族元素He。
【案例示范】【典例】(2020·盐城高二检测)已知几种元素原子的核外电子排布情况,分别判断其元素符号、原子序数并指出其在周期表中的位置。
【解题指南】解答本题要注意以下两点:(1)周期数=电子层数(2)主族序数=最外层电子数【解析】由电子排布式判断A为11号元素Na;由原子结构示意图可知x=26,B为26号元素Fe;由价电子排布式判断C为29号元素Cu;由电子排布式判断D为16号元素S;由基态原子的电子轨道表示式判断E为17号元素Cl。答案:A:Na 11 三 ⅠA B:Fe 26 四 ⅧC:Cu 29 四 ⅠB D:S 16 三 ⅥAE:Cl 17 三 ⅦA
【母题追问】(1)根据核外电子排布的表示方法判断上述哪些元素属于主族元素?提示:主族元素的价电子排布往往是ns1~2np1~5,由此可以判断A、D、E均为主族元素。(2)根据核外电子排布的表示方法判断上述哪些元素属于p区元素?提示:p区元素的价电子排布为ns2np1~6,由此判断D、E属于p区元素。
【规律方法】主族元素在元素周期表中位置的判断方法(1)由元素价电子排布式可推知其在元素周期表中的位置及化合价。即:①周期序数=电子层数;②主族序数=价电子数(最外层电子数)=最高化合价(O、F除外);③主族序数-8=最低化合价。(2)由元素在元素周期表中的位置可推知其价电子排布式。
【迁移·应用】1.(双选)(2020·德州高二检测)价电子排布式为3d54s2的元素是( )A.稀有气体 B.过渡元素C.主族元素D.ⅦB族元素【解析】选B、D。由该原子的电子排布式知该原子核外共有25个电子,即为25号元素Mn,是ⅦB族元素。
2.根据下列微粒的最外层电子排布,能确定该元素在元素周期表中位置的是( )A.4s1 D.ns2np3【解析】选C。A项中最外层为4s1的价电子排布包括4s1、3d54s1、3d104s1;B项中3d104sn的电子排布包括3d104s1、3d104s2;C项中n为2,即2s22p6;D项中n可能为2、3、4、5、6、7。
3.有A、B、C、D、E五种元素。其中A为第4周期主族元素,与D可形成1∶1和2∶1原子个数比的化合物;B为第4周期过渡元素,最高化合价为+7;C和B是同周期的元素,具有相同的最高化合价;D的价电子排布式为nsnnpn+2,E元素的基态原子核外有7个原子轨道填充了电子。(1)试写出下面三种元素的元素符号:A________、B________、C________。 (2)写出D2-的电子排布式:____________,基态E原子的电子排布式:____________。 (3)B位于第________族,C位于第________族。
【解析】由B为第4周期过渡元素,最高化合价为+7可推出B是锰元素;C和B是同周期的元素,具有相同的最高化合价,则C是溴元素;D的价电子排布式为nsnnpn+2,D是氧元素;A为第4周期主族元素,与D可形成1∶1和2∶1原子个数比的化合物,A是钾元素;B位于第4周期,最高价为+7价,根据族序数等于价电子数可知B位于第ⅦB族,Br原子最外层也是7个电子,属于主族元素,位于第ⅦA族;E元素的基态原子核外有7个原子轨道填充了电子,其核外电子排布式为1s22s22p63s23p1,该元素应为Al。答案:(1)K Mn Br (2)1s22s22p61s22s22p63s23p1 (3)ⅦB ⅦA
【补偿训练】1.具有以下结构的原子,一定属于主族元素原子的是( )①最外层有3个电子的原子②最外层电子排布为ns2的原子③最外层有3个未成对电子的原子④次外层无未成对电子的原子A.①② B.②③ C.①③ D.②④
【解析】选C。最外层有3个电子的原子,其最外层电子排布为ns2np1,属于ⅢA族,①正确;如Fe的最外层电子排布为4s2,He为1s2,它们都不是主族元素,②错误;因最外层电子数最多不超过8,故最外层有3个未成对电子的原子其最外层电子排布应为ns2np3,该元素一定为主族元素,③正确;有些过渡元素的次外层也可以达到饱和状态,如Zn:1s22s22p63s23p63d104s2,④错误。
2.某元素原子共有三个价电子,其中一个价电子位于第三电子层d能级。 (1)该原子的电子排布式为__。 (2)该元素的原子序数为________,在周期表中处于第________周期________族,属于________区。该元素为________(填“金属”或“非金属”)元素,其最高化合价为____________。 【解析】此题的关键是根据价电子排布写出核外电子排布式。有三个价电子其中一个价电子在3d能级,则其他两个价电子必在4s上,价电子排布为3d14s2,原子序数是21,在第四周期ⅢB族,处于d区,是金属元素,最高化合价是+3。答案:(1)1s22s22p63s23p63d14s2 (2)21 四 ⅢB d 金属 +3
【素养提升】硒是人体不可缺少的微量元素之一。能直接参与机体代谢,也能有效调节和提升人体的免疫功能,可以有效降低各类疾病的发生。而且,硒还有抗突变,促进致癌物质在体内灭活,调节机体免疫力,改善体质,缓解放化疗副作用,以及加快术后刀口恢复和防癌抗癌的作用。另外,硒还有保护眼睛、保护修复细胞、解毒防毒、抗污染和防治心血管类疾病的作用。现有含有元素硒(Se)的保健品已经进入市场,已知硒与氧元素同族,与钾元素同周期。
(1)硒元素原子的价电子排布式如何书写?(2)硒元素在周期表的哪个位置?(3)溴和硒的非金属性哪一个更大?提示:由题给信息可知,Se位于第4周期ⅥA族,主族元素原子最外层电子数与其族序数相等,故Se原子最外层电子数是6,最外层电子排布式为4s24p4;同周期元素,元素的非金属性随原子序数的增大而增强,Br和Se属于同周期元素,且原子序数:Br>Se,所以Br的非金属性比Se强。
知识点二 元素周期表的分区【重点释疑】各区元素化学性质及原子价电子排布特点
【思考·讨论】(1)按构造原理最后填入电子的能级符号就是元素所在的区吗?提示:不一定。He元素最后填入电子是s能级但是该元素却属于p区。(2)有f轨道的元素一定是f区元素吗?提示:f区元素指的是最后一个电子落在f轨道上的元素,而并非是指含有f轨道的原子。
【案例示范】【典例】(2020·济南高二检测)在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起,据此,人们将元素周期表分为五个区,并以最后填入电子的能级符号作为该区的符号,如图所示。
(1)在s区中,族序数最大、原子序数最小的元素,原子的价电子的电子云形状为____________。 (2)在d区中,族序数最大、原子序数最小的元素,常见离子的电子排布式为________________,其中较稳定的是____________________。 (3)在ds区中,族序数最大、原子序数最小的元素,原子的价电子排布式为____________。 (4)在p区中,第二周期ⅤA族元素原子的价电子轨道表示式为____________。 (5)当今常用于核能开发的元素是铀和钚,它们在________区中。
【解题指南】解答本题注意以下两点:(1)元素周期表中分区的依据是最后一个电子进入的轨道(ds区除外);(2)核外电子排布式根据电子层由小到大进行排列。
【解析】(1)s区为ⅠA族、ⅡA族,符合条件的元素为Be,其电子排布式为1s22s2,价电子的电子云形状为球形。(2)d区为ⅢB族~ⅦB族、Ⅷ族,族序数最大且原子序数最小的为Fe,常见离子为Fe2+、Fe3+,电子排布式为1s22s22p63s23p63d6、1s22s22p63s23p63d5,由离子的电子排布式可知Fe3+的3d轨道“半满”,其稳定性大于Fe2+。(3)ds区符合条件的为Zn,其电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2,价电子排布式为3d104s2。(4)该题中符合题意的为N,价电子轨道表示式为 。(5)铀和钚均为锕系元素,位于f区。
答案:(1)球形(2)Fe2+:1s22s22p63s23p63d6,Fe3+:1s22s22p63s23p63d5 Fe3+ (3)3d104s2(4) (5)f
【规律方法】元素周期表中族和分区的关系(1)主族:s区和p区。(ns+np)的电子数=族序数。(2)0族:p区。(ns+np)的电子数=8(或2)。(3)副族:d区+ds区+f区。①d区中[(n-1)d+ns]的电子数=族序数(第Ⅷ族部分元素除外)。②当8≤[(n-1)d+ns]的电子数≤10时,则为第Ⅷ族元素。③ds区中(n-1)d全充满,ns的电子数=族序数。
【迁移·应用】1.已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素在周期表中的位置是( )A.第三周期Ⅷ族,p区 B.第三周期ⅤB族,ds区C.第四周期Ⅷ族,d区D.第四周期Ⅴ族,f区【解析】选C。+3价离子的核外有23个电子,则原子核外有26个电子,26号元素是铁,位于第四周期Ⅷ族,位于d区。
2.(双选)关于元素在周期表中的分区,下列说法中正确的是( )A.在周期表中,最外层电子数为2的元素一定是ⅡA族元素B.过渡元素包含d区,ds区及f区元素C.原子的最外层电子数为8的都是稀有气体元素的原子D.所有非金属元素都分布在p区【解析】选B、C。最外层电子数为2的元素也可能是He或副族元素,故A错误;最外层电子数为8的原子,一定是稀有气体元素的原子,故C正确;非金属元素氢在s区,故D错误。
3.闪烁着银白色光泽的金属钛(22Ti)因具有密度小、强度大、无磁性等优良的机械性能,被广泛应用于军事、医学等领域,号称“崛起的第三金属”。已知钛有48Ti、49Ti、50Ti等核素,下列关于金属钛的叙述中不正确的是( )A.上述钛原子中,中子数不可能为22B.钛元素在周期表中处于第四周期C.钛的不同核素在周期表中处于不同的位置D.钛元素是d区的过渡元素
【解析】选C。48Ti、49Ti、50Ti等核素的中子数分别为26、27、28,A正确;22Ti的价电子排布式为3d24s2,因此钛是d区第四周期的过渡元素,故B、D叙述正确;元素在周期表中的位置由其质子数决定,钛的同位素原子的质子数相同,在周期表中的同一位置,故C叙述不正确。
【补偿训练】按电子排布,可以把周期表中的元素划分为5个区,以下元素属于p区的是( )A.Fe B.Mg C.Br D.Cu【解析】选C。Fe的价电子排布式为3d64s2,属于d区元素,A错误;Mg的价电子排布式为3s2,属于s区元素,B错误;Br的价电子排布式为4s24p5,属于p区元素,C正确;Cu的价电子排布式为3d104s1,属于ds区元素,D错误。
【素养提升】按矿泉水特征组分达到国家标准的主要类型分为九大类: ①偏硅酸矿泉水;②锶矿泉水;③锌矿泉水;④锂矿泉水;⑤硒矿泉水;⑥溴矿泉水;⑦碘矿泉水;⑧碳酸矿泉水;⑨盐类矿泉水。国家标准中规定的九项界限指标包括锂、锶、锌、硒、溴化物、碘化物、偏硅酸、游离二氧化碳和溶解性总固体,矿泉水中必须有一项或一项以上达到界限指标的要求,其要求含量分别为(单位:mg·L-1):锂、锌、碘化物均≥0.2,硒≥0.01,溴化物≥1.0,偏硅酸≥25,游离二氧化碳≥250和溶解性总固体≥1 000。填写下表中元素的价电子排布式及分区。
【解析】写出每种元素的价电子排布式,并根据价电子排布式寻找元素的分区。答案:
1.(2020·杭州高二检测)某元素电子排布式为4f46s2,其应在( )A.s区 B.p区 C.d区 D.f区【解析】选D。元素在周期表中的分区,取决于元素原子的最后一个电子所进入的能级(ds区除外),因最后一个电子进入f能级,所以该元素为f区元素。
【补偿训练】下列各组元素属于p区的是( )A.原子序数为1,2,7的元素B.O,S,PC.Fe,Ar,ClD.Na,Li,Mg【解析】选B。A项中的氢位于s区;C中Fe位于d区;D项均位于s区。
2.价电子排布式为5s25p3的元素是( )A.第5周期ⅢA族B.51号元素C.非金属元素D.Te【解析】选B。5s25p3,5指的是电子层数,即属于第5周期,价电子指的是最外层电子数,主族元素所在族序数等于最外层电子数,即属于第ⅤA族元素,又因为最后一个电子填充在p能级上,属于p区,按照核外电子排布的规律,推出此元素是锑(Sb),B正确。
3.(2020·菏泽高二检测)原子序数为83的元素位于:①第5周期;②第6周期;③ⅣA族;④ⅤA族;⑤ⅡB族,其中正确的组合是( )A.①④ B.②③C.②④ D.①⑤【解析】选C。根据元素的原子序数确定元素在周期表中的位置时,基本方法是依据原子结构示意图,根据电子层数确定其所在周期,根据最外层电子数确定其所在族,但用0族定位法较为方便,即根据与该元素原子序数最邻近的0族元素的位置来确定。与83号元素最邻近的0族元素为86号元素氡,83号元素比氡的原子序数小3,那么它在元素周期表中的位置应该是氡左移3个格,即第6周期ⅤA族。
4.(双选)下列各组原子中,彼此化学性质一定相似的是( )A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子C.2p轨道上有一对成对电子的X原子和3p轨道上只有一对成对电子的Y原子D.最外层都只有一个电子的主族金属元素的X、Y原子【解析】选C、D。本题考查的是核外电子排布的知识。A项,1s2结构的原子为He,1s22s2结构的原子为Be,两者性质不相似;B项,X原子为Mg,N层上有两个电子的Y原子有多种元素,如第4周期中Ca、Fe等都符合,化学性质不一定相似;C项,p轨道有一对成对电子,应是np4,为同主族的元素,化学性质一定相似;D项,符合题意的为碱金属元素,化学性质一定相似。
5.(新思维·新考向)元素X、Y、Z在周期表中的相对位置如图所示,已知Y元素原子的价电子排布式为ns(n-1)np(n+1)。
根据所给的信息及元素在周期表中的相对位置,推测三种元素在周期表中的具体位置,预测其主要化合价。
【解析】Y元素原子的价电子排布式为ns(n-1)np(n+1),由n-1=2可得n=3,Y元素原子的价电子排布式为3s23p4,则Y元素位于第3周期ⅥA族,Z位于第4周期ⅤA族,价电子排布式为4s24p3,X元素位于第2周期ⅦA族,价电子排布式为2s22p5。X、Y、Z最外层电子均填充在p轨道上,故X、Y、Z均位于p区。
相关课件
这是一份化学选择性必修2第2节 原子结构与元素周期表课文配套ppt课件,共60页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。
这是一份鲁科版 (2019)选择性必修2第2节 原子结构与元素周期表评课ppt课件,共45页。PPT课件主要包含了内容索引,知识铺垫,元素周期表的结构,自主梳理,化学性质不活泼,自我检测,问题探究,归纳拓展,应用体验,答案D等内容,欢迎下载使用。
这是一份鲁科版 (2019)选择性必修2第2节 原子结构与元素周期表图文课件ppt,共47页。PPT课件主要包含了内容索引,知识铺垫,自主梳理,能量最低状态,自我检测,问题探究,归纳拓展,应用体验,答案D,答案A等内容,欢迎下载使用。










