






所属成套资源:鲁科版(2019)化学选择性必修2PPT课件整册
高中化学鲁科版 (2019)选择性必修2第3节 离子键、配位键与金属键课文配套ppt课件
展开
这是一份高中化学鲁科版 (2019)选择性必修2第3节 离子键、配位键与金属键课文配套ppt课件,共60页。PPT课件主要包含了必备知识·素养奠基,静电作用,4形成过程,不同方向,相对大小,孤电子对,接受孤电子对的空轨道,A→B,提供孤电子对的原子,sp3等内容,欢迎下载使用。
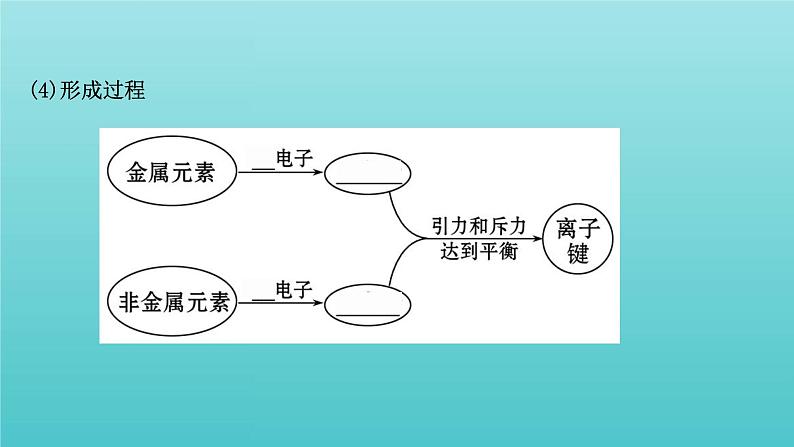
一、离子键1.离子键的形成(1)概念阴、阳离子间通过_________而形成的化学键。(2)成键元素活泼金属与非金属原子之间(3)形成条件一般认为,当成键原子所属元素的电负性差值大于____时,原子间才有可能形成离子键,且成键原子的电负性差值_____,原子之间越容易形成离子键。
2.离子键的特征(1)实质:静电作用。 (2)特征:①无方向性:一种离子可以对_________的带异性电荷的离子产生_____作用。②无饱和性:每个离子周围最邻近的带异性电荷的离子数目的多少,取决于阴、阳离子的_________。
【想一想】(1)金属元素与非金属元素化合时一定形成离子键吗?提示:不一定。金属元素与非金属元素也有可能形成共价键,如Al、Cl两种元素以共价键形成AlCl3。(2)离子键是通过阴、阳离子间的静电吸引形成的吗?提示:不是。离子键是阴、阳离子通过静电作用形成的,这种静电作用是指阴、阳离子之间静电吸引力与电子和电子之间、原子核和原子核之间的排斥力处于平衡时的总效应。
二、配位键1.配位键的形成(1)配位键①概念:成键原子一方提供_________,另一方具有_____________________而形成的特殊的共价键。②表示方法:配位键常用符号_____表示,其中A是___________________,B是___________________________________。
具有能够接受孤电子对的空轨道的原子
③实例:N 的结构式(表示出配位键)可表示为 ,N原子杂化类型为___,N 中的配位键和其他三个N—H的键长和键能_____,N 的空间构型为___________。
(2)配位化合物①概念:组成中含有配位键的物质。②组成:
【情境·思考】向AgNO3溶液中滴入氨水,现象:生成白色沉淀,随氨水的增加,沉淀逐渐溶解,生成了[Ag(NH3)2]+。(1)整个过程中发生了哪些反应?提示:Ag++NH3·H2O ==== AgOH↓+N ,AgOH+2NH3====[Ag(NH3)2]++OH-
(2)利用化学平衡移动原理解释配离子是如何形成的?提示:AgOH水溶液中存在AgOH(s) Ag+(aq)+OH-(aq)平衡,继续滴入氨水时,NH3分子与Ag+形成[Ag(NH3)2]+配离子,且配离子很稳定,促使以上平衡右移,AgOH逐渐溶解。(3)[Ag(NH3)2]+中哪一个提供孤电子对,哪一个提供空轨道?提示:在二氨合银离子中氨分子提供孤电子对,银离子提供空轨道。
2.配合物的制备与应用(1)配合物的制备实验目的:制备简单的络合物,体验配合物的应用。实验用品:(见教材)
[Cu(H2O)4]2+
[Fe(H2O)6]3+
【想一想】指出下列配离子的中心离子和配体。
三、金属键1.金属键及实质
2.金属键与金属性质(1)金属光泽当可见光照射到金属表面上时,固态金属中的“_________”能够吸收所有频率的光并迅速释放,使得金属不透明并具有金属光泽。(2)导电性金属内部自由电子的运动不具有方向性,在外加电场的作用下,金属晶体中的“自由电子”发生_____移动而形成电流。
(3)导热性当金属中有温度差时,通过不停运动着的“自由电子”与______________________,把能量由高温处传向低温处。(4)金属具有良好的延展性当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但排列方式不变,金属晶体中的_______没有被破坏。
【巧判断】(1)金属键具有方向性和饱和性。( )提示:×。金属键不具有方向性和饱和性。(2)金属键是金属阳离子与自由电子间的相互作用。( )提示:√。金属阳离子和自由电子之间的相互作用就是金属键。(3)金属导电是因为在外加电场作用下产生自由电子。( )提示:×。金属导电是因为自由电子的定向移动。(4)金属具有光泽是因为金属阳离子吸收并放出可见光。( )提示:×。金属光泽是因为自由电子吸收光并迅速释放,而非金属阳离子。
知识点一 常见的化学键【重点释疑】1.常见化学键的比较
2.化学键类型与物质类别的关系(1)离子化合物中一定含有离子键,可能含有共价键。简单离子组成的离子化合物中只有离子键,如MgO、NaF等,复杂离子组成的化合物中既有离子键、又有共价键,如NH4NO3、NaOH、Na2O2、NH4Cl等。(2)共价化合物中只有共价键,一定没有离子键。
(3)中学常见物质中的化学键①只有非极性键的物质:H2、O2、N2、P4、S2、S8、金刚石、晶体硅等。②只有极性键的物质:HX、CO、SO2等。③既有极性键、又有非极性键的物质:H2O2、C2H2、C2H4、C6H6、C2H5OH等。④只有离子键的物质:如CaCl2、K2O、KH等(固体)。⑤既有离子键、又有非极性键的物质:Na2O2、Na2S2、CaC2等。⑥既有离子键、共价键,又有配位键的物质:铵盐、配合物如[Cu(NH3)4]SO4等。⑦稀有气体中不存在化学键。⑧金属或合金中存在金属键。
【易错提醒】(1)化学键是相邻原子间的较强的相互作用,既存在相互吸引,又存在相互排斥。(2)稀有气体是单原子分子,其原子已经达到稳定结构,分子内不存在化学键。(3)活泼金属与活泼非金属间能够形成离子键,有些金属和非金属元素间能够形成共价键,如AlCl3。(4)电负性差值大于1.7时,不一定都形成离子键,如H—F中化学键为共价键,但电负性差值为1.9。(5)配合物是含配位键的化合物,不一定含过渡元素,如NH4Cl。
【思考·讨论】(1)所有的化学键都有方向性和饱和性吗?提示:不是。共价键有方向性和饱和性,但是离子键和金属键没有方向性与饱和性。(2)有人说:“金属键就是共价键。”这种说法对吗?提示:不对。从某种意义上来说金属键属于一种特殊的共价键,共价键的共用电子对属于提供电子对的两个原子,但是金属键中的自由电子却属于整个金属。
【案例示范】【典例】(2020·滨州高二检测)下列叙述正确的是( )A.带相反电荷离子之间的相互吸引称为离子键B.金属元素和非金属元素化合时不一定形成离子键C.原子最外层只有1个电子的主族元素与卤素所形成的化学键一定是离子键D.非金属元素形成的化合物中不可能含有离子键【解题指南】解答本题注意以下两点:(1)离子键的含义。(2)离子键形成的本质。
【解析】选B。离子键的本质是阴、阳离子之间的静电作用,静电作用包括静电引力和静电斥力,A不正确;活泼金属与活泼非金属容易形成离子键,一般当成键原子所属元素的电负性差值小于1.7时,原子间不易形成离子键,如AlCl3和BeCl2中金属与非金属原子形成共价键,B正确;原子最外层只有1个电子的主族元素包括H元素和碱金属元素,H元素与卤素形成共价键,碱金属元素与卤素形成离子键,C不正确;由非金属元素形成的化合物中可能含有离子键,如铵盐中N 与阴离子形成离子键,D不正确。
【规律方法】离子键与共价键中的两种特殊情况(1)金属与非金属形成的化学键有可能是共价键。(2)完全由非金属元素形成的化合物中有可能含离子键。
【迁移·应用】1.(2020·新乡高二检测)下列叙述错误的是( )A.离子键没有方向性和饱和性,而共价键有方向性和饱和性B.金属键的实质是在整块固态金属中不停运动的“自由电子”与金属阳离子相互作用,使得体系的能量大大降低C.配位键在形成时,由成键双方各提供一个电子形成共用电子对D.根据元素电负性的差值可以判断化学键类型
【解析】选C。A项为离子键和共价键的特征,正确;B项,金属键为自由电子与金属阳离子所形成的相互作用。C项,配位键在形成时,由成键原子的一方提供孤电子对,另一方提供空轨道,错误;根据形成化学键的元素的电负性差值与1.7的关系可以判断化学键类型,D正确。
2.下列物质中,既含有离子键,又含有非极性共价键的是( )A.Na2O2 B.NaOH C.Na2O D.MgCl2【解析】选A。Na2O2中含有Na+与 的离子键, 中含有O—O非极性键,A项正确;NaOH中含有Na+与OH-的离子键,OH-中含有H—O极性键,B项错误;Na2O中只含有Na+与O2-的离子键,C项错误;MgCl2中只含有Mg2+与Cl-的离子键,D项错误。
3.(2020·三明高二检测)NaF、KI、MgO均为离子化合物,现有下列数据,据此判断这三种化合物熔点高低的顺序( )A.①>②>③B.③>①>②C.③>②>①D.②>①>③
【解析】选B。离子化合物中,离子所带电荷数越多、半径越小,离子键越强,其熔、沸点就越高。因为r(F-)
相关课件
这是一份高中化学鲁科版 (2019)选择性必修2第3节 离子键、配位键与金属键评课ppt课件,共60页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。
这是一份鲁科版 (2019)选择性必修2第3节 离子键、配位键与金属键图片课件ppt,共44页。PPT课件主要包含了内容索引,自主梳理,自我检测,答案A,问题探究,归纳拓展,应用体验,答案B等内容,欢迎下载使用。
这是一份高中化学鲁科版 (2019)选择性必修2第3节 离子键、配位键与金属键集体备课ppt课件,共41页。PPT课件主要包含了内容索引,自主梳理,自我检测,问题探究,归纳拓展,4成键条件,应用体验等内容,欢迎下载使用。










