




高中化学鲁科版 (2019)选择性必修2微项目 青蒿素分子的结构测定——晶体在分子结构测定中的应用课堂教学ppt课件
展开一、共价晶体1.概念相邻原子间以_______结合而形成的具有空间_________结构的晶体。2.结构
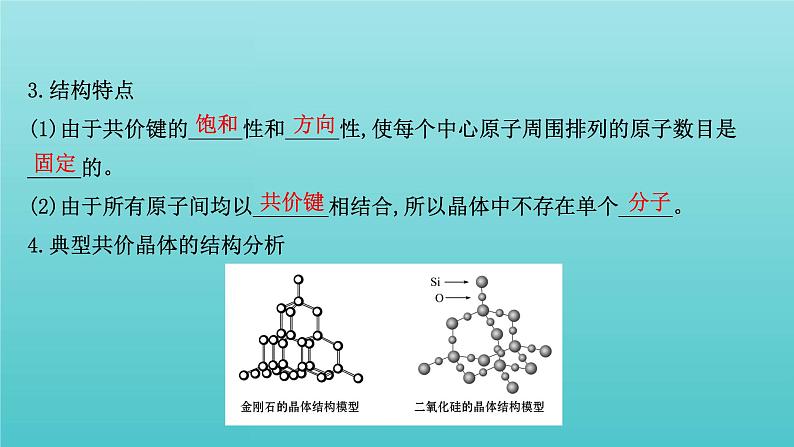
3.结构特点(1)由于共价键的_____性和_____性,使每个中心原子周围排列的原子数目是_____的。(2)由于所有原子间均以_______相结合,所以晶体中不存在单个_____。4.典型共价晶体的结构分析
(1)金刚石(C)①碳原子采取___杂化,C—C键键角为__________。②每个碳原子与周围紧邻的__个碳原子以共价键结合成_________结构,向空间伸展形成空间网状结构。③最小碳环由__个碳原子组成,且最小环上碳原子不在同一平面内。(2)碳化硅(SiC)把金刚石中的C原子换成Si与C原子相互交替,就得到碳化硅的结构。晶体中Si与C原子个数比为_____。
(3)二氧化硅晶体(SiO2)①Si原子采取___杂化,正四面体内O—Si—O键角为__________。②每个Si原子与__个O原子形成__个共价键,___原子位于正四面体的中心,__原子位于正四面体的顶点,同时每个O原子被__个硅氧正四面体共用;每个O原子和__个Si原子形成__个共价键,晶体中Si原子与O原子个数比为_____。③最小环上有___个原子,包括__个O原子和__个Si原子。
【巧判断】(1)含有共价键的晶体都是共价晶体。( )提示:×。共价晶体中都有共价键, 但含有共价键的不一定是共价晶体。如CO2、H2O等分子晶体中也含有共价键。(2)“ SiO2”是二氧化硅的分子式。( )提示:×。共价晶体的原子之间全部以共价键结合,形成空间网状结构。晶体中不存在单个分子,如二氧化硅是共价晶体,SiO2仅代表它的化学式,表示晶体中Si、O原子个数比,并不是分子式。
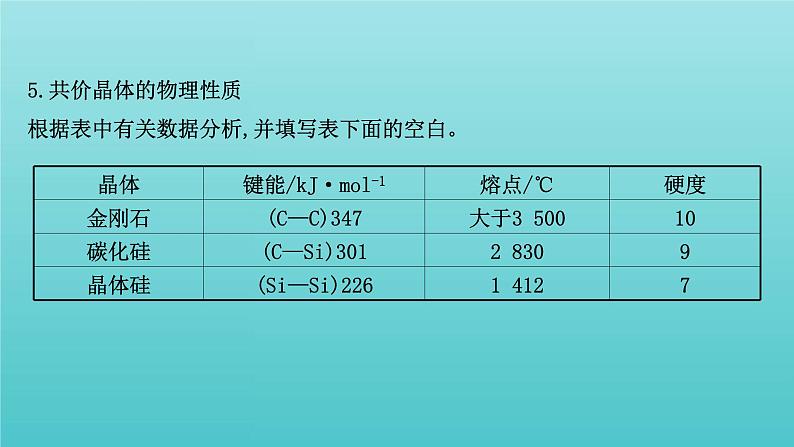
5.共价晶体的物理性质根据表中有关数据分析,并填写表下面的空白。
(1)键能:C—C__C—Si__Si—Si;熔点:金刚石__碳化硅__晶体硅;硬度:金刚石__碳化硅__晶体硅(用“>”或“<”填空)。(2)规律:共价晶体具有_____的熔点,_____的硬度;对结构相似的共价晶体来说,原子半径_____,键长_____,键能_____,晶体的熔点就越高。
【微思考】根据金刚石的结构特点,你能分析其硬度大的原因是什么吗?提示:在金刚石晶体内部,每个碳原子都与周围的4个碳原子紧密结合,形成一种致密的三维结构,破坏这种三维结构中的C—C共价键需要很高的能量,所以金刚石的硬度很大。
二、分子晶体1.分子晶体的结构
2.分子晶体与物质类型的关系
4.分子晶体的物理性质(1)分子晶体由于以比较弱的_____________相结合,因此一般熔点_____,硬度_____。(2)对组成和结构_____,晶体中又不含氢键的分子晶体来说,随着相对分子质量的增大,范德华力_____,熔、沸点_____。
【巧判断】(1)二氧化硅和干冰虽然是同一主族的氧化物,但属于不同的晶体类型。( )提示:√。二氧化硅为共价晶体,干冰为分子晶体。(2)水是一种非常稳定的化合物,这是由于水中存在氢键。( )提示:×。水分子的稳定性是由水分子中氢氧键较稳定决定的。
三、晶体结构的复杂性1.石墨晶体
2.晶体复杂性的影响(1)导致晶体中存在多种微粒以及不同微粒间作用。(2)化学键的过渡状态导致形成晶体的过渡状态,最终导致形成_________。
【情境·思考】硅酸钠,俗称泡花碱,其水溶液俗称水玻璃,是一种矿黏合剂。固态Na2O·nSiO2是一种中间产品,外观大多呈现淡蓝色。硅酸钠与碳酸钠不同,在硅酸钠中不存在简单的Si ,硅酸钠其实是一种过渡晶体。据此,思考以下问题:(1)在硅酸钠中存在那些化学键?提示:存在共价键和离子键两种化学键。
(2)硅酸钠中硅原子和氧原子的连接方式是怎样的?提示:在硅酸钠中,Si原子与4个O原子相连,形成硅氧四面体。(3)硅酸钠内部的结构是怎么样的?提示:硅酸钠中的硅氧四面体通过共用顶角O原子而连成较大的链状硅酸盐单元,然后带负电的链状硅酸盐单元与金属阳离子以离子键相互作用。
知识点一 共价晶体的结构与性质 【重点释疑】1.共价晶体的结构特征(1)在共价晶体中,各原子均以共价键结合,因为共价键有方向性和饱和性,所以中心原子周围的原子数目是有限的,原子不采取密堆积方式。(2)共价晶体的组成微粒是原子,不存在单个分子,其化学式仅代表原子的个数比。(3)空间构型:空间网状结构。
2.共价晶体熔点和硬度的比较共价晶体具有不同的结构类型,对于结构相似的共价晶体来说,原子半径越小,键长越短,键能越大,晶体的稳定性越高,熔、沸点越高,硬度越大。3.判断晶体是否是共价晶体的思路(1)根据共价晶体的构成微粒和微粒间作用力判断。(2)根据共价晶体的物理性质判断。(3)常见的共价晶体。
【关键提醒】(1)1个C原子形成4个C—C键,每个C—C键被两个C原子共用,故每个C原子占用C—C键数目为4× =2,即1 ml金刚石含有2 ml C—C键。(2)金刚石晶体中最小环上有6个碳原子,SiO2晶体中最小环上有12个原子(6个O原子和6个Si原子)。(3)共价晶体的熔、沸点不一定高于金属晶体和离子晶体。如MgO(2 800℃)>SiO2(1 723 ℃)、钨(3 410 ℃)>SiO2(1 723 ℃)。(4)平面网状结构的晶体不属于共价晶体。(5)共价晶体中只存在共价键,不存在离子键和范德华力。(6)稀有气体原子组成的晶体不是共价晶体。
【思考·讨论】为什么共价晶体结构比金属晶体和离子晶体结构松散,但却比金属晶体和离子晶体有更强的稳定性?提示:共价键具有方向性和饱和性,使共价晶体中某个原子周围结合的其他原子是有限的,因此比较松散。由于整个晶体中各原子都以强作用力共价键相互结合,且构成了空间网状结构,所以共价晶体更稳定。
【案例示范】【典例】(2020·南京高二检测)碳化硅和立方氮化硼的结构与金刚石类似,碳化硅硬度仅次于金刚石,立方氮化硼硬度与金刚石相当,其晶胞结构如图所示。
请回答下列问题:(1)碳化硅晶体中,硅原子杂化类型为________,每个碳原子周围与其距离最近的硅原子有________个;设晶胞边长为a cm,密度为b g·cm-3,则阿伏加德罗常数可表示为________________________(用含a、b的式子表示)。(2)立方氮化硼晶胞中有________个硼原子,________个氮原子,硼原子的杂化类型为________,若晶胞的边长为a cm,则立方氮化硼的密度表达式为________g·cm-3(设NA为阿伏加德罗常数的值)。
【解题指南】解答本题注意以下两点:(1)注意杂化类型的判断方法;(2)晶胞的相关计算。
【解析】(1)SiC晶体中,每个Si原子与4个C原子形成4个σ键,故Si采取sp3杂化,每个Si原子距最近的C原子有4个。SiC晶胞中,硅原子数为6× +8× =4个,碳原子位于晶胞内,SiC晶胞中碳原子数为4个,1个晶胞的质量为 ,体积为a3 cm3,因此晶体密度b g·cm-3= ,故 。(2)立方氮化硼晶胞中,含有N原子数为6× +8× =4个,B原子位于晶胞内,立方氮化硼晶胞中含硼原子4个。每个硼原子与4个氮原子形成4个σ键,故硼原子采取sp3杂化,每个立方氮化硼晶胞的质量为 g,体积为a3 cm3,故密度为
答案:(1)sp3 4 (2)4 4 sp3
【规律方法】共价晶体氮化硼晶胞与金刚石、晶体硅、碳化硅晶体相似。如晶胞中原子数目、原子杂化类型、键角都相同,但BN晶体中存在配位键B←N。
【迁移·应用】1.(2020·防城港高二检测)根据下列物质的性质,判断其属于共价晶体的是 ( )A.熔点2 700 ℃,导电性强,延展性强B.无色晶体,熔点3 550 ℃,不导电,质硬,难溶于水和有机溶剂C.无色晶体,能溶于水,质硬而脆,熔点为800 ℃,熔化时能导电D.熔点-56.6 ℃,微溶于水,硬度小,固态或液态时不导电【解析】选B。共价晶体一般不导电,没有延展性,A项错误;共价晶体难溶于水,C项错误;共价晶体一般熔点很高,硬度很大,D项错误。
2.(双选)(2020·合肥高二检测)金刚石具有硬度大、熔点高等特点,大量用于制造钻头、金属切割刀具等。其结构如图所示,下列判断正确的是 ( )
A.金刚石中C—C键的键角均为109°28′,所以金刚石和CH4的晶体类型相同B.金刚石的熔点高与C—C键的键能有关C.金刚石中碳原子个数与C—C键键数之比为1∶2D.金刚石的熔点高,所以在打孔过程中不需要进行浇水冷却
【解析】选B、C。选项A,金刚石是共价晶体,CH4是分子晶体,二者的晶体类型不同;选项B,金刚石熔化过程中C—C键断裂,因C—C键的键能大,断裂时需要的能量多,故金刚石的熔点很高;选项C,金刚石中每个C都参与了4个C—C键的形成,而每个C对每条键的贡献只有一半,故碳原子个数与C—C键键数之比为(4× )∶4=1∶2;选项D,金刚石的熔点高,但在打孔过程中会产生很高的温度,如不浇水冷却钻头,会导致钻头熔化。
【补偿训练】在金刚石的晶体中,含有由共价键形成的碳原子环,其中最小的环上所需碳原子数及每个碳原子上任意两个C—C键间的夹角是( )A.6个;120°B.5个;108°C.4个;109°28′D.6个;109°28′【解析】选D。根据金刚石的结构特点可知最小环上碳原子数为6个,任意两个C—C键间夹角为109°28′。
【素养提升】一种世界上最硬的新材料——β-氮化碳(β-C3N4)问世,迅速引起全世界科学界和工程技术界的强烈反响和巨大震动。氮化碳结构如下图所示,其中β-氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。
据此思考以下几个问题:(1)氮化碳所属的晶体类型是什么?提示:根据β-氮化碳硬度超过金刚石晶体判断,氮化碳属于共价晶体。(2)氮化碳中碳和氮的价态是什么?其结构是什么样的?提示:氮的非金属性大于碳的非金属性,氮化碳中碳显+4价,氮显-3价,分析晶胞结构可知氮化碳的结构是每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连。
知识点二 晶体类型的比较和判断【重点释疑】1.四种晶体类型的比较
2.晶体类型的判断方法(1)依据组成晶体的微粒和微粒间的相互作用判断共价晶体:原子→共价键;分子晶体:分子→分子间作用力;离子晶体:离子→离子键;金属晶体:金属阳离子和自由电子→金属键。
(2)依据物质的分类判断①常见的共价晶体单质有金刚石、晶体硅、晶体硼等,常见的共价晶体化合物有SiC、BN、AlN、Si3N4、C3N4、SiO2等;②分子晶体:大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外);③离子晶体:金属氧化物(如K2O、Na2O2等)、强碱(如NaOH、KOH等)和绝大多数的盐类;④金属晶体:金属单质与合金。
(3)依据晶体的熔点判断①离子晶体的熔点较高,常在数百至1 000余度;②共价晶体熔点很高,常在1 000度至几千度;③分子晶体熔点低,常在数百度以下至很低温度;④金属晶体多数熔点高,但也有少数熔点很低。
(4)依据导电性判断①共价晶体:一般不导电;②分子晶体:
③离子晶体:固态不导电,熔融或溶于水导电;④金属晶体:固态或熔融均导电。
(5)依据硬度和机械性能判断共价晶体硬度大;分子晶体硬度小且较脆;离子晶体硬度较大或较硬、脆;金属晶体多数硬度大,但也有较小的,且具有延展性。
【思考·讨论】(1)所有分子晶体中是否均存在化学键?提示:不是。绝大多数分子晶体的微粒内部都存在化学键,如N2、H2O、SO2等分子内部都有共价键,而稀有气体为单原子分子,分子内部无化学键,分子之间以范德华力结合,所以并非所有分子晶体的分子内部都存在化学键。(2)为什么液态水变为冰时,体积膨胀,密度减小?提示:冰晶体中主要是水分子依靠氢键而形成的,因氢键具有一定的方向性,使水分子间的间距比较大,有很大空隙,比较松散。所以水结成冰后,体积膨胀,密度减小。
【案例示范】【典例】(2020·厦门高二检测)甲烷晶体的晶胞结构如图所示,下列说法正确的是( )A.甲烷晶胞中的球只代表1个C原子B.晶体中1个CH4分子中有12个紧邻的CH4分子C.甲烷晶体熔化时需克服共价键D.1个CH4晶胞中含有8个CH4分子
【解题指南】解答本题注意以下两点:(1)晶胞结构的分析;(2)不同晶体类型的性质比较。【解析】选B。题图所示的甲烷晶胞中的球代表的是1个甲烷分子,并不是1个C原子,A错误;甲烷晶体是分子晶体,熔化时克服范德华力,C错误;甲烷晶胞属于面心立方晶胞,该晶胞中甲烷分子的个数为8× +6× =4,D错误。
【迁移·应用】1.(2020·大连高二检测)AB型化合物形成的晶体结构多种多样。下图所示的几种结构所表示的物质最有可能是分子晶体的是( )
A.①③ B.②⑤ C.⑤⑥ D.③④⑤⑥
【解析】选B。从各图中可以看出②⑤都不能再以化学键与其他原子结合,所以最有可能是分子晶体。
2.(双选)石墨晶体为层状结构,每一层均为碳原子与周围其他3个碳原子相结合而成的平面片层,同层相邻碳原子间距为142 pm、相邻片层间距为335 pm。如图是其晶体结构片层俯视图。下列说法不正确的是( )A.碳原子采用sp2杂化B.每个碳原子形成3个σ键C.碳原子数与σ键键数之比为1∶3D.片层之间的碳形成共价键
【解析】选C、D。每个碳原子形成3个σ键,采取sp2杂化,故A、B正确;每个碳原子平均含有 ×3= 个σ键,所以碳原子数与σ键键数之比为2∶3,故C错误;石墨片层之间的碳以范德华力结合而不是共价键,故D错误。
【补偿训练】1.下列化合物,按其晶体的熔点由高到低排列正确的是( )A.SiO2 CsCl CBr4 CF4B.SiO2 CsCl CF4 CBr4C.CsCl SiO2 CBr4 CF4D.CF4 CBr4 CsCl SiO2
【解析】选A。物质的熔点的高低与晶体的类型有关,一般来说,共价晶体>离子晶体>分子晶体,即SiO2>CsCl>CBr4>CF4。当晶体的类型相同时,共价晶体与原子半径有关;离子晶体与离子的半径和离子所带的电荷数有关;分子晶体当组成和结构相似时,与相对分子质量的大小有关,一般来说,相对分子质量大的,熔点高,即CBr4>CF4。
2.(2020·宜昌高二检测)根据下表中给出的有关数据,判断下列说法中错误的是( )
A.SiCl4是分子晶体B.晶体硼是共价晶体C.AlCl3是分子晶体,加热能升华D.金刚石中的C—C键比晶体硅中的Si—Si键弱【解析】选D。SiCl4、AlCl3的熔、沸点低,都是分子晶体,AlCl3的沸点低于其熔点,故AlCl3加热能升华,A、C项正确;晶体硼的熔、沸点高,所以晶体硼是共价晶体,B项正确;碳原子的半径比硅的原子半径小,金刚石中的C—C键键长比晶体硅中的Si—Si键键长短,金刚石中的C—C键键能比晶体硅中的Si—Si键键能大,金刚石中的C—C键比晶体硅中的Si—Si键强,D项错误。
【素养提升】C60结构,又称为巴基球、足球烯,它是一个由60个碳原子结合形成的稳定分子,英国化学家哈罗德·沃特尔·克罗托勾画出的C60的分子结构,富勒的启示起了关键性作用,因此他们一致建议,将其命名为富勒烯。科研人员应用电子计算机模拟出来类似C60的物质N60,试据此回答下列几个问题:
(1)N60的溶解性是什么?晶体类型是什么?提示:C60是一种单质,属于分子晶体,而N60类似于C60,所以N60也是单质,属于分子晶体,即具有分子晶体的一些性质,如硬度较小,熔、沸点较低。单质一般是非极性分子,难溶于水这种极性溶剂。(2)N60与N2的熔点谁的更高?稳定性呢?提示:由于分子晶体相对分子质量越大,熔、沸点越高,所以N60的熔点高于N2。N2分子以N≡N结合,N60分子中只存在N—N,而N≡N比N—N牢固得多。
1.(2020·惠州高二检测)下列有关共价晶体的叙述错误的是( )A.共价晶体中,原子不遵循紧密堆积原则B.共价晶体具有空间网状结构C.共价晶体中不存在独立的分子D.共价晶体熔化时不破坏共价键
【解析】选D。A项,共价晶体中原子之间通过共价键相连,而共价键具有方向性和饱和性,所以共价晶体中,原子不遵循紧密堆积原则;B项,共价晶体是相邻原子之间通过共价键结合而成的空间网状结构;C项,共价晶体是由原子以共价键相结合形成的,不存在独立的分子;D项,共价晶体是原子通过共价键连接的,熔化时需要破坏共价键。
2.水的沸点是100 ℃,硫化氢的分子结构跟水相似,但它的沸点却很低,是-60.7 ℃,引起这种差异的主要原因是( )A.范德华力 B.共价键C.氢键D.相对分子质量【解析】选C。水分子之间存在氢键,氢键是一种较强的分子间作用力,氢键的存在使水的沸点比硫化氢的高。
3.中国获得2022年冬奥会主办权,这将促进中国冰雪运动。以下关于冰的说法正确的是( )A.冰与水共存物属于混合物B.冰的密度比水大C.冰与二氧化硅的晶体类型相似D.氢键在冰晶体结构中起关键作用
【解析】选D。冰水混合物属于纯净物,故A错误;冰中氢键比水多,又因为氢键具有饱和性和方向性,相同质量,冰的体积比水大,则冰的密度比水小,故B错误;冰属于分子晶体,而二氧化硅属于共价晶体,因此结构不同,故C错误;氢键具有饱和性和方向性,冰中一个水分子有4个氢键,故D正确。
4.(2020·三明高二检测)某化学兴趣小组,在学习分子晶体后,查阅了几种氯化物的熔、沸点,记录如下:
根据这些数据分析,属于分子晶体的是( )A.NaCl、MgCl2、CaCl2B.AlCl3、SiCl4C.NaCl、CaCl2D.全部【解析】选B。由于由分子构成的晶体,分子与分子之间以分子间作用力相互作用,而分子间作用力较小,克服分子间作用力所需能量较低,故分子晶体的熔、沸点较低,表中的MgCl2、NaCl、CaCl2熔、沸点较高,很明显不属于分子晶体,AlCl3、SiCl4熔、沸点较低,应为分子晶体,B项正确,A、C、D三项错误。
5.下列说法正确的是( )A.在含4 ml Si—O键的二氧化硅晶体中,氧原子的数目为4NAB.金刚石晶体中,碳原子数与C—C键数之比为1∶2C.30 g二氧化硅晶体中含有0.5NA个二氧化硅分子D.晶体硅、晶体氖均是由相应原子直接构成的共价晶体
【解析】选B。在二氧化硅晶体中,每个硅原子形成4个Si—O键,故含有4 ml Si—O键的二氧化硅晶体的物质的量为1 ml,即含有2NA个氧原子,A项错误;金刚石中每个碳原子均与另外4个碳原子形成共价键,且每两个碳原子形成一个C—C键,故1 ml碳原子构成的金刚石中共有2 ml C—C键,因此碳原子数与C—C键数之比为1∶2,B项正确;二氧化硅晶体中不存在分子,C项错误;氖晶体是由单原子分子靠分子间作用力结合在一起形成的,属于分子晶体,D项错误。
6.单质硼有无定形和晶体两种,参考下列数据,完成下列问题:
(1)晶体硼的晶体类型属于____________________晶体。 (2)已知晶体硼的基本结构单元是由硼原子构成的正二十面体,如图所示,其中有20个等边三角形的面和一定数目的顶点,每个顶点各有一个硼原子,通过观察图形及推算,可知此结构单元是由________________个硼原子构成,其中B—B键间的键角是__________________(填度数)。
鲁科版 (2019)选择性必修2第2节 几种简单的晶体结构模型教学ppt课件: 这是一份鲁科版 (2019)选择性必修2第2节 几种简单的晶体结构模型教学ppt课件,共60页。PPT课件主要包含了NO1,NO2,NO3,点击右图进入等内容,欢迎下载使用。
高中第3章 不同聚集状态的物质与性质第2节 几种简单的晶体结构模型教学课件ppt: 这是一份高中第3章 不同聚集状态的物质与性质第2节 几种简单的晶体结构模型教学课件ppt,共60页。PPT课件主要包含了课前自主学习,非金属单质,非金属化合物,氧化物,sp3,°28′,正四面体,2堆积方式,较弱的分子间作用力,分子间作用等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修2第2节 几种简单的晶体结构模型多媒体教学课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修2第2节 几种简单的晶体结构模型多媒体教学课件ppt,共60页。PPT课件主要包含了内容索引,知识铺垫,自主梳理,金刚石晶体结构,二氧化硅晶体结构,碘晶体结构,干冰晶体结构,面心立方结构,冰晶体结构,苯甲酸晶体微观结构等内容,欢迎下载使用。













