所属成套资源:鲁科版(2019)化学必修第一册学案全套
- 鲁科版高中化学必修第一册第3章物质的性质与转化第1节基础课时14铁的氧化物和铁的氢氧化物铁及其化合物之间的转化关系学案 学案 0 次下载
- 鲁科版高中化学必修第一册第3章物质的性质与转化第2节基础课时15自然界中的硫二氧化硫的性质学案 学案 0 次下载
- 鲁科版高中化学必修第一册第3章物质的性质与转化第3节基础课时19硝酸人类活动对氮循环和环境的影响学案 学案 0 次下载
- 鲁科版高中化学必修第一册第3章物质的性质与转化第3节能力课时4物质特殊的转化关系与常见气体的制备学案 学案 0 次下载
- 鲁科版高中化学必修第一册第3章物质的性质与转化微项目论证重污染天气“汽车限行”的合理性学案 学案 0 次下载
化学必修 第一册第3章 物质的性质与转化第3节 氮的循环学案
展开
这是一份化学必修 第一册第3章 物质的性质与转化第3节 氮的循环学案,共13页。学案主要包含了自然界中的氮循环,氮的固定,氮氧化物等内容,欢迎下载使用。
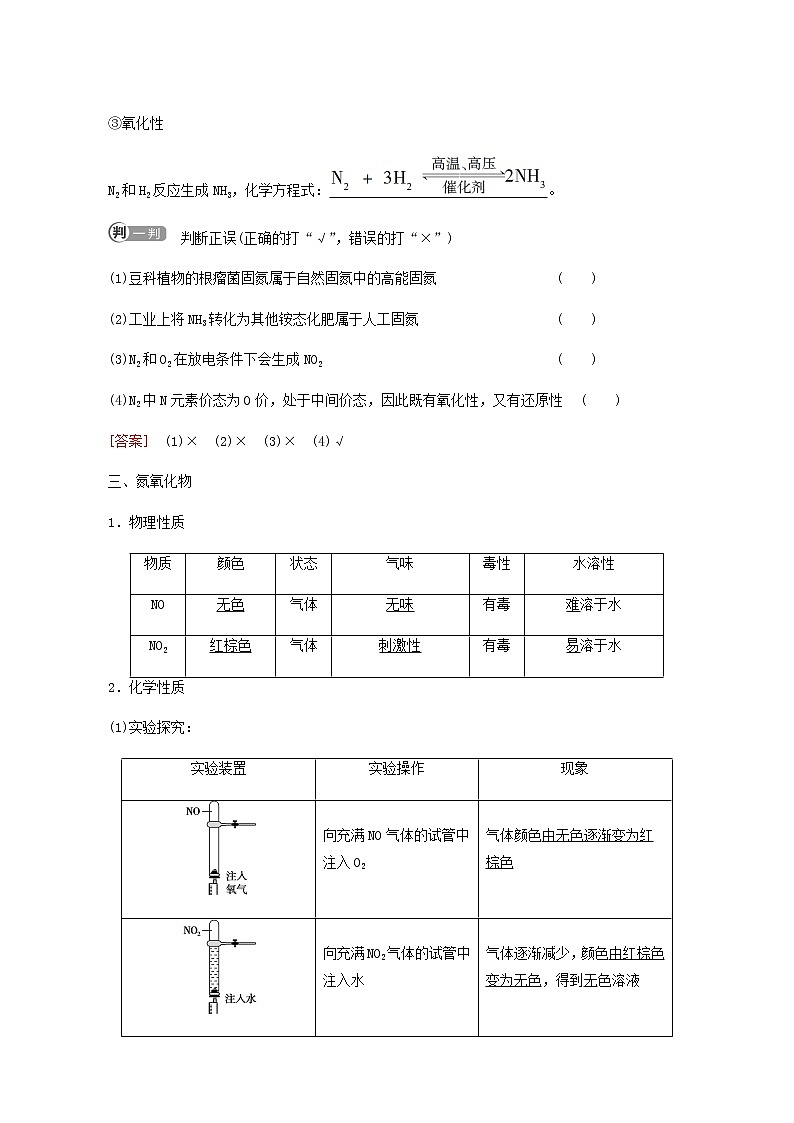
自然界中的氮循环 氮气与氮氧化物学 习 任 务1.通过了解自然界中氮循环的基本过程,认识氮循环过程中的重要物质,并了解含氮物质的相互转化在生产、生活中的应用及对生态环境的影响,增强科学态度与社会责任。2.通过情境素材和合作探究,了解氮气、一氧化氮和二氧化氮的性质,培养科学探究和创新意识。一、自然界中的氮循环1.氮元素在自然界中的存在形式:游离态和化合态。2.自然界中氮的循环3.人类活动的影响(1)氮气氨气→氮肥、硝酸等含氮化合物。(2)燃烧反应产生的氮氧化物参与氮的循环。 判断正误(正确的打“√”,错误的打“×”)(1)自然界中氮的存在形式多种多样,除N2、NH3、NOx、铵盐、硝酸盐等无机物外,还能以蛋白质等有机物的形式存在。 ( )(2)氮的循环中氮元素可被氧化,也可被还原。 ( )(3)氮循环中含氮物质有多种形式的转化,有的对人类生产生活有益,有的则产生了负面作用。 ( )[答案] (1)√ (2)√ (3)√二、氮的固定、氮气1.氮的固定(1)含义:将空气中游离态的氮转化为含氮化合物的过程。(2)分类2.氮气(1)物理性质颜色状态气味密度溶解性无色气体无味比空气稍小难溶于水(2)化学性质①稳定性在通常状况下,氮气的化学性质不活泼,很难与其他物质发生反应。②还原性a.实验探究:实验装置实验操作现象硬质玻璃管内充入N2和O2,然后给硬质玻璃管两端的电极上通电,在硬质玻璃管内能产生火花气体颜色由无色变为红棕色b.结论:在放电条件下,N2与O2反应生成NO,NO立即被氧化为NO2,化学方程式为N2+O22NO、2NO+O2===2NO2。③氧化性N2和H2反应生成NH3,化学方程式:。 判断正误(正确的打“√”,错误的打“×”)(1)豆科植物的根瘤菌固氮属于自然固氮中的高能固氮 ( )(2)工业上将NH3转化为其他铵态化肥属于人工固氮 ( )(3)N2和O2在放电条件下会生成NO2 ( )(4)N2中N元素价态为0价,处于中间价态,因此既有氧化性,又有还原性 ( )[答案] (1)× (2)× (3)× (4)√三、氮氧化物1.物理性质物质颜色状态气味毒性水溶性NO无色气体无味有毒难溶于水NO2红棕色气体刺激性有毒易溶于水2.化学性质(1)实验探究:实验装置实验操作现象向充满NO气体的试管中注入O2气体颜色由无色逐渐变为红棕色向充满NO2气体的试管中注入水气体逐渐减少,颜色由红棕色变为无色,得到无色溶液(2)结论:在一定条件下,NO与NO2可以相互转化,反应的化学方程式为①NO―→NO2:2NO+O2===2NO2;②NO2―→NO:3NO2+H2O===2HNO3+NO。3.其他性质(1)NO①结合血红蛋白的能力比CO还强,更容易造成人体缺氧;②一种传递神经信息的“信使分子”,在扩张血管、提高免疫力、增强记忆力等方面有着重要的作用。(2)NO2①能使多种织物褪色,损坏多种织物和尼龙制品;②对金属和非金属材料也有腐蚀作用。 某山谷经常电闪雷鸣、雷雨交加,但树木、灌木、花草等植被非常茂密,很少有人敢进入这个山谷。你能解释该山谷的植被茂密的原因吗?[提示] 植物生长需要氮肥,N2在雷电的作用下发生一系列变化:N2+O22NO2NO+O2===2NO23NO2+H2O===2HNO3+NOHNO3与土壤成分反应,产生硝酸盐,被植物吸收,所以经常有雷电的地方,植被生长的茂盛。氮气的性质、用途[问题1] 氮气为什么可以用作保护气?[提示] 因为氮气的化学性质稳定,在通常情况下,氮气不容易与其他物质反应,也不会和食物反应而使之变质。氮气本身无毒无害,不会直接对人体产生伤害。[问题2] 实验室可以通过向下排空气法收集氮气吗?[提示] 不能。由于氮气的密度与空气的接近,所以既不能用向上排空气法也不能用向下排空气法收集,应用排水法收集。[问题3] 在化学反应中氮气只作氧化剂吗?[提示] 不是。氮气是非金属单质,在化学反应中既可以作氧化剂也可以作还原剂,如与H2、Mg反应时N2作氧化剂,与O2反应时N2作还原剂。氮气的性质及工业制法1.氮气的密度与空气的接近,只能用排水法收集。2.在高温、高压、放电等条件下,N2能与H2、O2、Mg等发生化学反应。(1)氮气与氢气反应:,该反应是工业合成氨的原理。(2)氮气与氧气反应:N2+O22NO。(3)氮气与镁反应:3Mg+N2Mg3N2。3.工业制法:空气中含有大量的氮气,空气是工业制氮气的主要来源,生产方法主要是分离液态空气,并制得液态氧。氮元素的存在状态与氮的固定1.下列关于氮气性质的说法中,错误的是( )A.通常情况下,氮气性质很不活泼B.可在氧气中燃烧,生成一氧化氮C.通常情况下,氮气在水中的溶解度很小D.跟氢气在一定条件下发生反应时,氮气是氧化剂B [N2不能在O2中燃烧,与O2在放电条件下反应生成NO,B错;氮气与氢气反应时,氮元素的化合价降低,氮气作氧化剂,D对。]2.下列关于N2的说法中错误的是( )A.通常情况下N2的化学性质很稳定,所以N2可在电焊时作保护气B.N2+O22NO,该反应是汽车尾气造成污染的主要原因之一C.N2在空气中约占空气总质量的D.在反应3Mg+N2Mg3N2中,N2作氧化剂C [N2在空气中约占空气总体积的,C项错误。]3.下列叙述与氮的固定无关的是( )A.工业合成氨B.工业上将氨转化为硝酸和其他含氮化合物C.豆科植物的根瘤菌把空气中的氮气转化为含氮化合物D.电闪雷鸣的雨天,空气中的氮气会与氧气发生反应并最终转化为硝酸盐被植物吸收B [氮的固定是指将空气中游离态的氮转化为含氮化合物的过程。]氮的氧化物的性质及有关计算为有效实现NO和NO2的相互转化,设计如下实验:按图组装好实验装置,并检查装置气密性,实验前用排水法收集半瓶NO气体。[问题1] 打开止水夹,推动针筒活塞,使O2进入烧瓶。关上止水夹,观察到什么现象?原因是什么?[提示] 烧瓶中气体由无色变为红棕色,因为发生反应:2NO+O2===2NO2[问题2] 然后轻轻摇动烧瓶,烧瓶中观察到什么现象?产生此现象的原因是什么?[提示] 轻轻摇动烧瓶,使得NO2与水发生反应3NO2+H2O===2HNO3+NO,所以烧瓶中红棕色气体又变为无色,因为烧瓶内气体的量减少,引起烧瓶内气体的压强降低,所以烧杯内的水会倒吸入烧瓶中,使烧瓶中液面上升。[问题3] 若最后烧瓶中充满了水,则原烧瓶中NO与通入氧气的体积之比为多少(同温同压下)?用化学方程式说明。[提示] 发生的反应为①2NO+O2===2NO2,②3NO2+H2O===2HNO3+NO,①×3+②×2可得方程式:4NO+3O2+2H2O===4HNO3,当NO与氧气的体积之比为4∶3时,完全溶于水。氮的氧化物的性质及有关计算1.NO和NO2性质的对比 NONO2色、态、味、毒性无色、无味红棕色、有刺激性气味 有毒气体水溶性难溶易溶且与水反应与氧气反应2NO+O2===2NO2—与水反应—3NO2+H2O===2HNO3+NO与氧气、水同时作用4NO+3O2+2H2O===4HNO34NO2+O2+2H2O===4HNO3氧化性有氧化性,但通常情况下表现出还原性能氧化S2-、I-、Fe2+等离子,NO2能使湿润的淀粉KI试纸变蓝对环境的影响有毒,大气污染物之一2.氮的氧化物溶于水的计算2NO+O2===2NO2 ①3NO2+H2O===2HNO3+NO ②由①+②×2 得4NO2+O2+2H2O===4HNO3,当体积比V(NO2)∶V(O2)由①×3+②×2 得4NO+3O2+2H2O===4HNO3,当体积比V(NO)∶V(O2)NO、NO2均不属于酸性氧化物。酸性氧化物是能够与碱反应生成盐和水的氧化物,而且生成的盐是该氧化物同价态的含氧酸所对应的盐。NO不能与碱反应,NO2与NaOH溶液的反应为2NO2+2NaOH===NaNO2+NaNO3+H2O。但由于生成的不是相应的盐,因此二氧化氮也不是酸性氧化物。【例题】 将10 mL充满NO2和O2的混合气体的试管,倒置于水槽中,反应停止后试管内剩余2 mL的无色气体,求原混合气体中NO2和O2各多少毫升?[解析] 剩余2 mL气体可能是NO或O2,分两种情况讨论:(1)若剩余的是NO,可以看成先发生了反应:4NO2+O2+2H2O===4HNO3。剩余的NO2又与水作用,最终有2 mL NO产生。由反应3NO2+H2O===2HNO3+NO知,剩余的NO2的体积为2 mL×3=6 mL。则原有O2的体积为(10 mL-6 mL)×=0.8 mL,NO2的体积为10 mL-0.8 mL=9.2 mL。(2)若剩余的是O2,则有10 mL-2 mL=8 mL NO2和O2的混合气体按反应4NO2+O2+2H2O===4HNO3进行。所以NO2的体积为8 mL×=6.4 mL,O2的体积为10 mL-6.4 mL=3.6 mL。[答案] 若剩余的气体是NO,则NO2和O2的体积分别为9.2 mL和0.8 mL;若剩余的气体是O2,则NO2和O2的体积分别为6.4 mL和3.6 mL。【变式旁通】 若将例题中“NO2”改为“NO”,则混合气体中NO和O2各多少毫升?写出计算过程。[提示] 设参加反应的NO的体积为x,则4NO+3O2+2H2O===4HNO34 3x xx+x=8 mL⇒x= mL;若NO不足,则V(O2)=10 mL- mL= mL;若O2不足,则V(NO)=10 mL-× mL= mL。故剩余O2时,NO和O2的体积分别为 mL和 mL;剩余NO时,NO和O2的体积分别为 mL和 mL。1.在NO2与水的反应中( )A.氮元素的化合价不发生变化B.NO2只是氧化剂C.NO2只是还原剂D.NO2既是氧化剂又是还原剂D [,故NO2既是氧化剂又是还原剂。]2.把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是( )A.氧气 B.二氧化氮C.二氧化氮和氧气 D.二氧化氮和一氧化氮C [少量NO2气体通入过量小苏打溶液中,逸出的气体为NO、CO2,二者物质的量之比为1∶2,同时还有少量水蒸气逸出,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,CO2与过氧化钠反应生成的O2与NO反应生成NO2,O2有剩余,同时逸出的少量水蒸气与过氧化钠反应生成O2,所以最后收集到的气体是NO2和O2。]1.下列说法不正确的是( )A.豆科植物通过根瘤菌吸收空气中的氮是化学变化B.汽车尾气中的氮氧化物是由游离态氮转化来的C.化石燃料燃烧通常不释放出氮氧化物D.植物秸秆燃烧时产生氮氧化物,参与了氮的循环C [氮的固定是将游离态的氮转变成含氮化合物的过程,是化学变化;汽车尾气中的氮氧化物是由氮气和氧气反应生成的;化石燃料中含有氮元素,燃烧时会释放出氮氧化物;植物秸秆燃烧时产生氮氧化物,参与了氮的循环。]2.下列关于N2的叙述错误的是( )A.N2既可作氧化剂又可作还原剂B.在雷雨天,空气中的N2和O2可反应生成NOC.氮的固定是将N2转化成含氮的化合物D.1 mol N2可与3 mol H2完全反应生成2 mol NH3D [工业合成氨反应为可逆反应。]3.下列对NO、NO2的描述中正确的是( )A.NO是酸性氧化物B.NO2可用排水法收集,且可由N2和O2直接化合而得到C.NO、NO2在一定条件下可相互转化,且二者都是引起光化学烟雾的大气污染物D.一氧化氮在反应中只能作还原剂C [NO不与碱反应,不是酸性氧化物,故A项错误;NO2与水反应:3NO2+H2O===2HNO3+NO,N2与O2在放电的条件下反应生成NO,故B项错误;NO与O2发生反应:2NO+O2===2NO2,NO2与H2O反应生成NO,光化学烟雾主要是由NOx引起的,故C项正确;NO中氮的化合价为+2价,既可升高又可降低,既可作氧化剂又可作还原剂,故D项错误。]4.对3NO2+H2O===2HNO3+NO反应,下列说法正确的是( )A.氧化剂与还原剂的质量比为1∶2B.氧化产物与还原产物的物质的量之比为1∶2C.NO2是氧化剂,H2O是还原剂D.在反应中若有6 mol NO2参与反应时,有3 mol电子发生转移A [氧化剂、还原剂均为NO2,HNO3为氧化产物,来源于还原剂,NO为还原产物,来源于氧化剂,故氧化剂、还原剂的质量比为1∶2。]5.目前,汽车尾气已成为许多大城市空气的主要污染源之一。汽车尾气中含有CO、NO等多种污染物。(1)汽车燃料中一般不含氮,尾气中所含的NO产生的原因是_______________________________________________________________,化学方程式为_________________________________________。(2)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管上装上一个催化转化装置,使NO和CO反应,生成CO2和N2,反应的化学方程式为_______________________________________________________________。(3)下列措施中,能减少或控制汽车尾气污染有效且可行的是________。①制定严格的尾气排放标准,并严格执行。②开发清洁能源,如氢能汽车、太阳能汽车等。③市民出行戴防毒面具。④市民大量移居城市郊区。[解析] (1)空气中的N2和O2在电火花作用下或在内燃机燃烧产生的高温条件下反应产生NO,化学方程式为N2+O22NO。(2)NO和CO反应生成CO2和N2,化学方程式为2NO+2CO2CO2+N2。(3)①有利于减少污染;②有利于减少污染;③不现实,是污染后再防护的做法,不可取;④不现实,大量移居成本较高,不可取。[答案] (1)空气中的N2和O2在电火花作用下或在内燃机燃烧产生的高温条件下反应产生NO N2+O22NO (2)2NO+2CON2+2CO2 (3)①②
相关学案
这是一份高中化学鲁科版 (2019)必修 第一册第3节 氮的循环第1课时导学案,共15页。
这是一份化学必修 第一册第3章 物质的性质与转化第3节 氮的循环导学案,共12页。
这是一份化学必修 第一册第3节 氮的循环学案及答案,共11页。学案主要包含了硝酸的性质,人类活动对氮循环和环境的影响等内容,欢迎下载使用。