





人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解评课ppt课件
展开1.从组成盐的离子成分角度分析盐类水解的本质。2.以动态平衡的观点分析盐类水解对水电离平衡的影响,掌握盐类水解的规律。3.以离子方程式的形式,表达盐类水解。
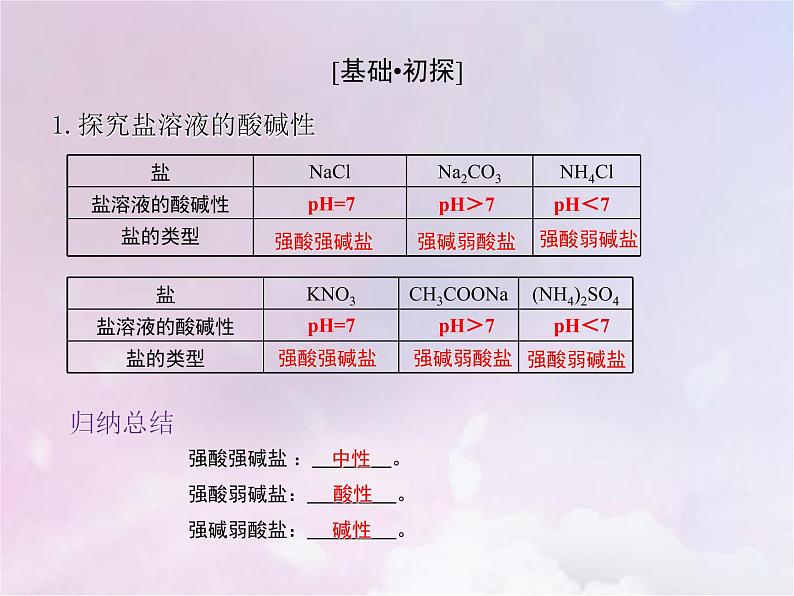
1.探究盐溶液的酸碱性
归纳总结 强酸强碱盐 : 。 强酸弱碱盐: 。 强碱弱酸盐: 。
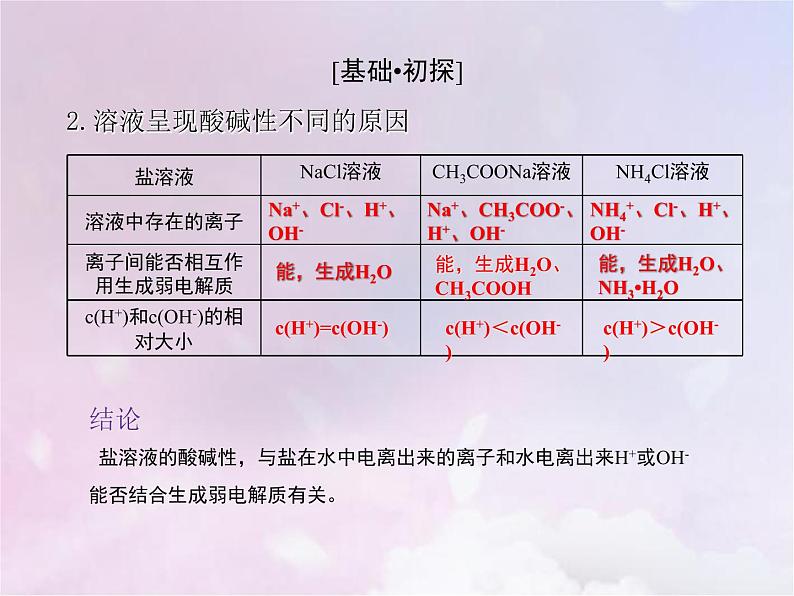
2.溶液呈现酸碱性不同的原因
Na+、Cl-、H+、OH-
c(H+)=c(OH-)
NH4+、Cl-、H+、OH-
能,生成H2O、NH3•H2O
c(H+)>c(OH-)
Na+、CH3COO-、H+、OH-
能,生成H2O、CH3COOH
c(H+)<c(OH-)
结论 盐溶液的酸碱性,与盐在水中电离出来的离子和水电离出来H+或OH-能否结合生成弱电解质有关。
(1)强酸弱碱盐的水解(NH4Cl溶液)
NH4Cl溶于水后电离出来NH4+和Cl-,NH4+与水电离出来的OH-结合生成弱电解质NH3•H2O促进水的电离
溶液中c(H+)>c(OH-),呈酸性
(2)强碱弱酸盐的水解(CH3COONa溶液)
CH3COONa溶于水后完全电离CH3COO-和Na+,CH3COO-与水电离出来的H+结合生成弱电解质CH3COOH促进水的电离
溶液中c(H+)<c(OH-),呈碱性
试分析NaCl溶液呈中性的原因: 。
NaCl 溶于水后电离产生Na+和Cl-,不能与水电离出的OH-、H+结合成难电离的物质,水的电离平衡不发生移动,c(H+)= c(OH-),溶液呈中性。
Na2CO3在水溶液中电离出来的CO32-与水电离出来的H+结合生成HCO3-,HCO3-又与水电离出来的H+结合生成H2CO3,促进水继续电离,溶液中c(H+)
第一步:Na2CO3在水溶液中电离出来的CO32-与水电离出来的H+结合生成HCO3-
第二步:生成HCO3-继续与水电离出来的H+结合成弱电解质H2CO3
3.盐类水解的定义及实质
(1)定义在水溶液中,盐电离出来的 与水电离出来的 结合生成 的反应,叫做盐类的水解。
(1)在可溶性盐溶液中:有弱才水解,无弱不水解,越弱越水解,都弱都水解,谁强显谁性,同强显中性。(2)常见的弱离子弱碱阳离子:NH4+、Al3+、Fe3+、Cu2+等。弱酸根离子:CO32-、HCO3-、AlO2-、SO32-、S2-、HS-、SiO32-、ClO-、CH3COO-、F-等。
(1)盐类的水解 水的电离,使溶液呈酸性、碱性或中性;(2)盐类的水解反应是酸碱 的逆反应:(3)盐类水解一般是 的;(4)盐类水解是 (填“吸热”或“放热”)反应。
5.盐类水解反应的特征
6.盐类水解的离子方程式
(1)一元强碱弱酸盐(如CH3COONa溶液) 。(2)一元弱酸弱碱盐(如NH4Cl溶液) 。(3)多元弱酸强碱盐(正盐:如Na2SO3) 。(4)多元弱酸强碱盐(酸式盐:如Na2HPO4) 。(5)多元弱碱强酸盐(如Al2(SO4)3) 。(6)阴、阳离子相互促进水解:水解程度较大,书写时要用“=”、“↑”、“↓”等。(如NaHCO3与AlCl3混合溶液) 。
能发生相互促进的水解反应而不能大量共存的离子组合:
人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第四节 沉淀溶解平衡备课ppt课件: 这是一份人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第四节 沉淀溶解平衡备课ppt课件,共4页。PPT课件主要包含了第四节沉淀溶解平衡,新课情景呈现,课前素能奠基,溶度积常数,课堂素能探究,7×10-3,2~62,名师博客呈现,课堂达标验收,7×10-7等内容,欢迎下载使用。
化学选择性必修1第三节 盐类的水解课文ppt课件: 这是一份化学选择性必修1第三节 盐类的水解课文ppt课件,共4页。PPT课件主要包含了第三节盐类的水解,第1课时盐类的水解,新课情景呈现,课前素能奠基,玻璃棒,2实验结果,强碱弱酸,强酸弱碱,NH3·H2O,H++OH-等内容,欢迎下载使用。
化学选择性必修1第三节 盐类的水解课堂教学课件ppt: 这是一份化学选择性必修1第三节 盐类的水解课堂教学课件ppt,共56页。PPT课件主要包含了课前·基础认知,课堂·重难突破,素养·目标定位,随堂训练,素养•目标定位,目标素养,知识概览,答案C,答案B等内容,欢迎下载使用。













