






高中化学人教版 (2019)选择性必修1第二节 化学平衡背景图课件ppt
展开1.知道化学平衡常数的含义。2.能书写平衡常数表达式,能进行化学平衡常数、转化率的简单计算。3.通过化学平衡常数对化学平衡进行“定量”计算和判断化学平衡进行的程度及平衡移动方向。
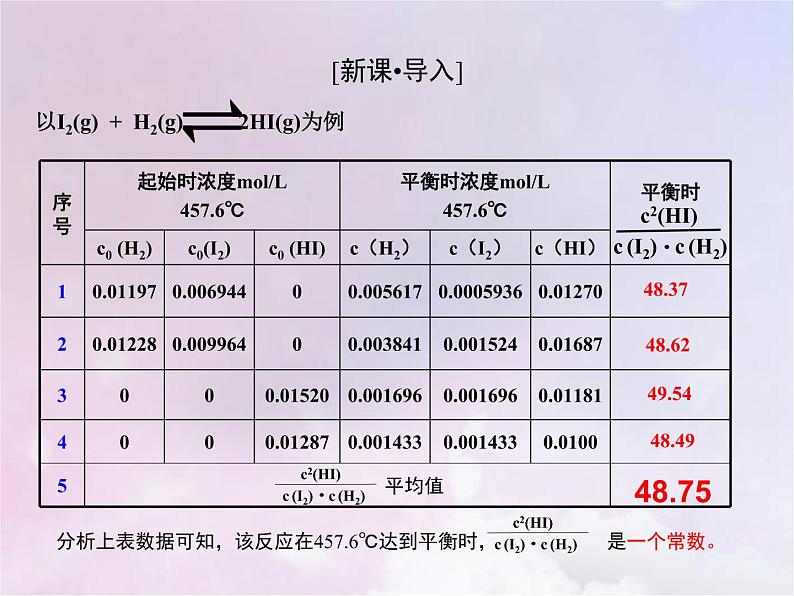
以I2(g) + H2(g) 2HI(g)为例
c (I2)·c (H2)
(1)概念:对于一般的可逆反应,如 ,在任意时刻的 称为浓度商,常用Q表示。(2)使用范围:任意时刻的可逆反应(固体或液体纯物质一般不列入浓度商)(3)表示方法:
(2)使用范围:平衡时的可逆反应(固体或液体纯物质一般不列入平衡常数)(3)表示方法:(4)单位:K的单位为 , ,一般省略不写。
☂名师点拨书写时要注意以下三点:(1)物质的浓度是指平衡时的物质的量浓度。(2)反应物或生成物中有固体或纯液体存在时,由于其浓度可看作“1”而不代入表达式。(3)化学平衡常数是指某一具体反应的平衡常数。若反应方向改变、化学计量数等倍扩大或缩小,化学平衡常数都会相应改变。
(5)影响因素:①平衡常数K只受 影响。随温度的变化而变化,与反应物或生成物的浓度无关,也与反应是从正向开始还是从逆向开始无关。②对于正反应是 的可逆反应, 温度,平衡右移,K值变 ;降低温度,平衡左移,K值变小。 对于正反应是 的可逆反应, 温度,平衡左移,K值变 ;降低温度,平衡右移,K值变大。
(6)意义K值越大→平衡体系中生成物所占的比例 →正向反应进行的程度 →反应进行得越 →反应物的转化率 :反之,就越不完全,转化率就越小。当 时,该反应进行得就基本完全了。当 时,认为该反应很难进行。
(7)应用①判断反应进行的程度K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,即该反应进行得越完全,反应物转化率越大;反之,就越不完全,转化率就越小。②若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。③判断平衡移动方向利用平衡常数可从定量的角度解释恒温下浓度、压强对化学平衡移动的影响。
当Q=K时,反应处于 状态,v正=v逆;当Q
1、概念平衡转化率是指平衡时 了的某反应物的量与 该反应物的量之比,用来表示反应限度。
人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡课文配套ppt课件: 这是一份人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡课文配套ppt课件,共60页。PPT课件主要包含了课前·基础认知,课堂·重难突破,素养·目标定位,随堂训练,素养•目标定位,目标素养,知识概览,五大特征等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二节 化学平衡作业ppt课件: 这是一份人教版 (2019)选择性必修1第二节 化学平衡作业ppt课件,共44页。PPT课件主要包含了答案A,ABCE,ΔH1-ΔH2等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二节 化学平衡图文课件ppt: 这是一份人教版 (2019)选择性必修1第二节 化学平衡图文课件ppt,共32页。PPT课件主要包含了内容索引,自主预习新知导学,合作探究释疑解惑,课堂小结,课标定位素养阐释,问题引领,归纳提升,典型例题等内容,欢迎下载使用。













