








所属成套资源:人教版高中化学选修一同步PPT课件+教案
高中化学第四节 沉淀溶解平衡教学ppt课件
展开
这是一份高中化学第四节 沉淀溶解平衡教学ppt课件,文件包含人教版化学选修一341《沉淀溶解平衡》课件pptx、人教版化学选修一341《沉淀溶解平衡》课件docx等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
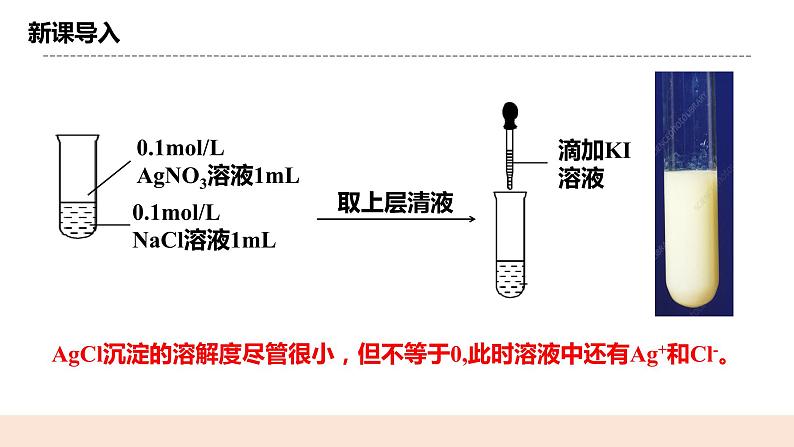
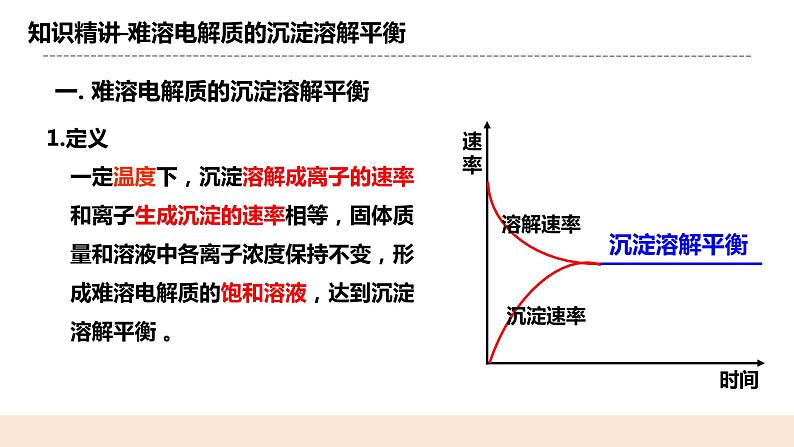
人教版化学选修一《沉淀溶解平衡》教学设计课题名沉淀溶解平衡教学目标1.能描述沉淀溶解平衡,知道溶解平衡的特征。 2.根据化学平衡理论,分析影响沉淀溶解平衡的因素。 3.了解离子积与Ksp的相对大小跟沉淀溶解平衡的关系。 教学重点1.沉淀溶解平衡的特征 2.离子积与Ksp的相对大小跟沉淀溶解平衡的关系教学难点离子积与Ksp的相对大小跟沉淀溶解平衡的关系教学准备教师准备:课件、例题学生准备:复习弱电解质的电离相关知识教学过程一. 新课导入一定温度下,某固体物质在100克溶剂中达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂中的溶解度。 习惯上将溶解度小于0.01g的电解质称为难溶电解质。难溶 ≠绝对不溶 二.知识精讲(一) 难溶电解质的沉淀溶解平衡1.定义 一定温度下,沉淀溶解成离子的速率和离子生成沉淀的速率相等,固体质量和溶液中各离子浓度保持不变,形成难溶电解质的饱和溶液,达到沉淀溶解平衡 。 2.特征逆:研究的对象是可逆反应 等:正反应速率和逆反应速率相等 动:表面静止状态,反应并未停止,是一种动态平衡定:各组分浓度不再改变,不随时间变化而变化变:外界条件改变时,原平衡状态将被打破,再在新条件下建立新的平衡状态3.沉淀溶解平衡的表达式: 标明状态:难溶电解质用“s”,溶液中的离子用“aq”,并用“”连接。4.影响难溶电解质溶解平衡的因素:①内因:电解质本身的性质 ②外因:a.浓度:加水,平衡向溶解方向移动b.温度:升温,多数平衡向溶解方向移动c.同离子效应:在饱和溶液中,加 入含有相同离子的强电解质时, 溶解平衡会被抑制【例1】难溶电解质在水中达到沉淀溶解平衡时,下列说法中错误的是(D) A.沉淀的速率和溶解的速率相等 B.难溶电解质在水中形成饱和溶液 C.再加入该难溶电解质,溶液中各离子的浓度不变 D.难溶电解质溶解形成的阴、阳离子的浓度相等【例2】Mg(OH)2(s)Mg2+(aq)+2OH-(aq) (二)溶度积常数(简称溶度积 Ksp)1.定义: 一定温度下,难溶电解质达到沉淀溶解平衡时,溶液中各离子浓度幂之积为常数,叫做溶度积常数(简称溶度积),用Ksp表示。 2.表达式: Q:写出BaSO4、CaCO3、Ag2S的溶度积表达式 BaSO4(s) Ba2+(aq) + SO42- (aq)CaCO3(s) Ca2+(aq) + CO32- (aq)Ag2S(s) 2Ag+(aq) + S2-(aq)3.影响因素Ksp只与难溶电解质的性质和温度有关.与沉淀的量和离子浓度无关。温度一定, Ksp是常数。4. Ksp的意义Ksp反映了难溶电解质在水中的溶解能力。相同类型(阴、阳离子个数比相同),Ksp越小,溶解度越小。 如:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI) ;S(AgCl) > S(AgBr) > S(AgI)不同类型,不能用Ksp直接比较 【例2】已知硫化亚铁、硫化铜、硫化锌的溶度积分别为: Ksp(FeS)=3.7×10-19 ;Ksp(CuS)=8.5×10-45 ;Ksp(ZnS)=1.2×10-23 向等浓度FeCl2、CuSO4、ZnSO4中滴加0.01mol/LNa2S溶液时 Fe2+、Zn2 + 、Cu2+沉淀的先后顺序是:Cu2+、Zn2+、Fe2+5.溶度积规则表达式:Q<Ksp时,溶液不饱和,无沉淀析出,还可继续溶解直到平衡。Q = Ksp时,溶液饱和,沉淀与溶解处于平衡状态Q>Ksp时,溶液过饱和,有沉淀析出,直到溶液饱和达到平衡。【例3】1 mL 0.012 mol/L NaCl溶液与1 mL 0.010 mol/L AgNO3溶液充分反 应后剩余Ag+的浓度为(忽略溶液体积变化)(Ksp(AgCl)=1.8×10-10) 三.课堂小结一. 难溶电解质的沉淀溶解平衡1.定义 2.特征 3.沉淀溶解平衡的表达式:4.影响难溶电解质溶解平衡的因素:①内因: ②外因:温度、浓度、同离子效应二.溶度积常数(简称溶度积 Ksp)1.定义 2.表达式: 3.影响因素 4. Ksp的意义5.溶度积规则四.随堂练习1.下列有关AgCl沉淀的溶解平衡状态的说法中,正确的是( A )A.AgCl沉淀的生成和溶解不断进行,但速率相等 B.AgCl难溶于水,溶液中没有Ag+和Cl- C.升高温度,AgCl的溶解度不变 D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度不变 2.将一定量的硫酸钡放入水中,对此有关的叙述正确的是( B )A.硫酸钡不溶于水,硫酸钡固体质量不会改变 B.最终会得到BaSO4的极稀的饱和溶液 C.因为Ba2++SO42-===BaSO4↓很容易发生,所以不存在 BaSO4(s)Ba2+(aq)+SO42-(aq)的反应 D.因为BaSO4难溶于水,所以改变外界条件也不会改变BaSO4的溶解性 3.某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是 ( ) A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]B.加适量NH4Cl固体可使溶液由a点变到b点 C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等 D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 布置作业化学课时作业《沉淀溶解平衡》板书设计一. 难溶电解质的沉淀溶解平衡1.定义 2.特征 3.沉淀溶解平衡的表达式:4.影响难溶电解质溶解平衡的因素:①内因: ②外因:温度、浓度、同离子效应二.溶度积常数(简称溶度积 Ksp)1.定义 2.表达式: 3.影响因素 4. Ksp的意义5.溶度积规则教学反思本节课学生对于沉淀溶解认知的拓展,学生能过通过溶解度、化学平衡、电离平衡等知识进行新知识的理解,教师在教学过程中,应帮助学生自主构建学科知识网络。
相关课件
这是一份高中化学第四节 羧酸 羧酸衍生物完美版课件ppt,共27页。PPT课件主要包含了羧酸的结构及分类,根据羧基数目,根据烃基,硬脂酸软脂酸油酸,脂肪酸,芳香酸,一元羧酸,二元羧酸,多元羧酸,低级脂肪酸等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第四节 沉淀溶解平衡授课课件ppt,共27页。PPT课件主要包含了镁与水的反应,探究活动,溶液显碱性,难溶并非不溶,有气泡产生溶液变红,溶解度,nAgCl,V溶液,≈1×10-6mol,100mL等内容,欢迎下载使用。
这是一份苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡试讲课ppt课件,共26页。PPT课件主要包含了课前导入,沉淀溶解平衡,溶度积的应用,溶度积的计算,课堂小结等内容,欢迎下载使用。











