






所属成套资源:人教版高中化学选修一同步PPT课件+教案
化学第二节 水的电离和溶液的pH教学课件ppt
展开
这是一份化学第二节 水的电离和溶液的pH教学课件ppt,文件包含人教版化学选修一323《酸碱中和滴定》课件pptx、人教版化学选修一323《酸碱中和滴定》课件docx等2份课件配套教学资源,其中PPT共21页, 欢迎下载使用。
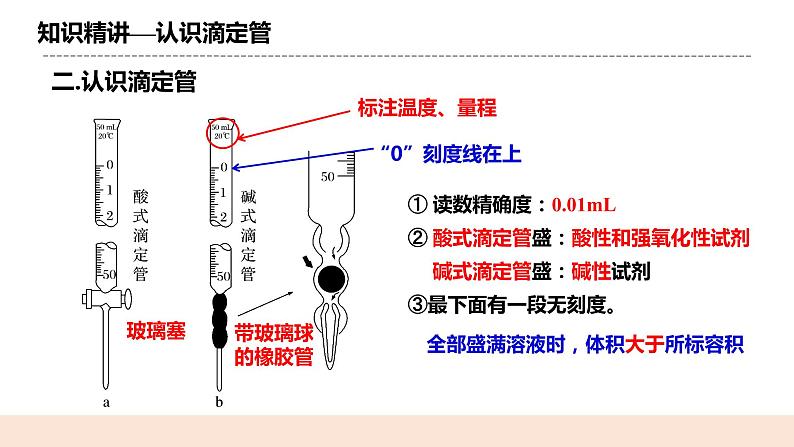
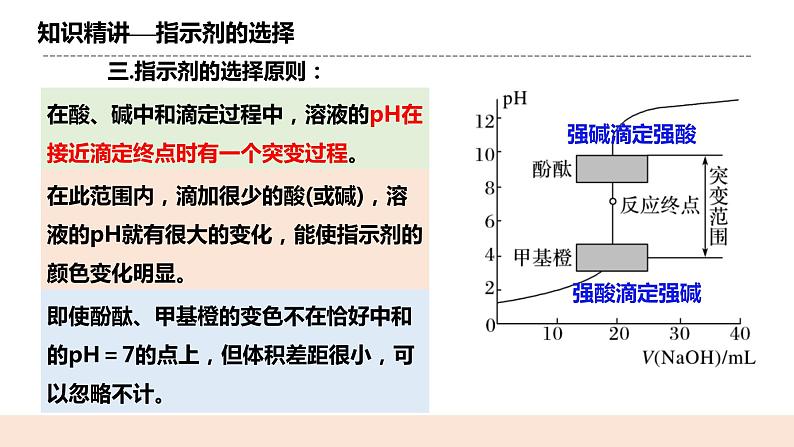
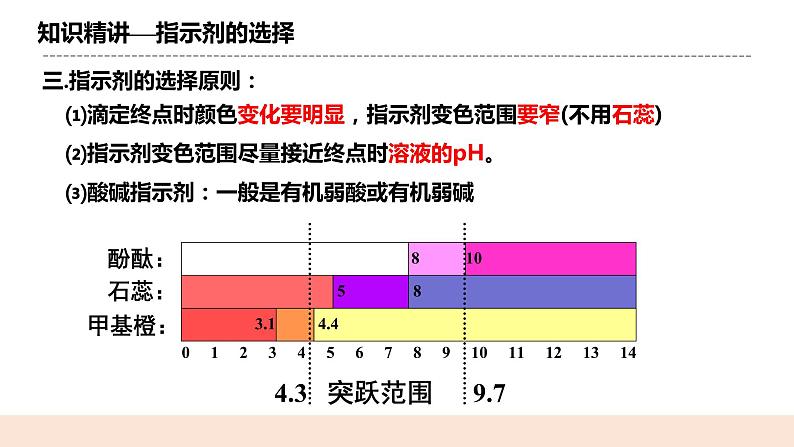
人教版化学选修一《酸碱中和滴定》教学设计课题名酸碱中和滴定教学目标1.掌握酸碱中和滴定及测定酸碱滴定曲线的原理及操作方法。 2.了解指示剂的选择及误差分析 教学重点能正确完成酸碱中和滴定的实验会选择正确的指示剂能对实验结果进行误差分析教学难点会选择正确的指示剂能对实验结果进行误差分析教学准备教师准备:课件、例题学生准备:复习弱电解质的电离相关知识教学过程一. 新课导入如何定性判断一个溶液的酸碱性? 通过酸碱指示剂pH值试纸pH计等如何定量计算一个溶液的浓度? 酸碱中和滴定 二.知识精讲(一)酸碱中和滴定1.概念: 依据中和反应,用已知浓度的碱(或酸)来测定未知浓度的酸(或碱) 的方法,叫做酸碱中和滴定。 2.原理: H++OH-=H2O,恰好反应时: n(H+) = n(OH-) c(H+)·V酸=c(OH-)·V碱c酸V酸=c碱V碱 (一元酸和一元碱)3.实验关键: (1)准确测量参加反应的两种溶液的体积 (2)准确判断中和反应是否恰好完全反应 (二)认识滴定管1. 认识滴定管① 读数精确度:0.01mL ② 酸式滴定管盛:酸性和强氧化性试剂 碱式滴定管盛:碱性试剂③最下面有一段无刻度。全部盛满溶液时,体积大于所标容积2.滴定管的使用方法①检查仪器:使用前先检查滴定管活塞是否漏水。 ②润洗仪器:滴定管在加入反应液之前,先用蒸馏水洗涤干净,再用所要盛装的溶液润洗2~3遍。 ③加入反应液:分别将反应液加入相应滴定管中,使液面位于滴定管“0”刻度线以上2~3mL处。 ④调节起始读数:在滴定管下放一烧杯,调节活塞,使滴定管尖嘴部分充满反应液,并使液面处于“0”刻度或以下某刻度,读数并记录。 (三)指示剂的选择原则在酸、碱中和滴定过程中,溶液的pH在接近滴定终点时有一个突变过程。 在此范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色变化明显。 即使酚酞、甲基橙的变色不在恰好中和的pH=7的点上,但体积差距很小,可以忽略不计。 指示剂的选择原则⑴滴定终点时颜色变化要明显,指示剂变色范围要窄(不用石蕊) ⑵指示剂变色范围尽量接近终点时溶液的pH。⑶酸碱指示剂:一般是有机弱酸或有机弱碱① 强酸——强碱:选酚酞或甲基橙都可以② 强酸滴定弱碱:滴定终点为酸性,选甲基橙③ 强碱滴定弱酸:滴定终点为碱性,选酚酞⑷滴定终点的判断: 当滴入最后一滴××标准溶液后,溶液由××色变成××色,且半分钟内不变色,说明达到滴定终点。 (四)实验:用0.1200mol/L盐酸标准液测定未知浓度NaOH溶液。 1.滴定前准备 ①检查 ②润洗 ③装液 ④调液 ⑤放液:从碱式滴定管中放出20mL的NaOH溶液于锥形瓶中,并滴 2~3滴指示剂(甲基橙或酚酞)。 锥形瓶用水洗干净即可,不能用待测液润洗2.滴定 3.读数重复实验2~3次,取消耗标准液体积的平均值,根据c(NaOH)= ,计算出待测NaOH溶液的浓度 (五)误差分析 三.课堂小结四.随堂练习 1、用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考右图,从表中选出正确选项( ) 2.准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 mol·L-1 NaOH 溶液滴定。下列说法正确的是( ) A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大 C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小布置作业化学课时作业《酸碱中和滴定》板书设计酸碱中和滴定一.原理H++OH-=H2O,恰好反应时: n(H+) = n(OH-) c(H+)·V酸=c(OH-)·V碱c酸V酸=c碱V碱 (一元酸和一元碱)二.指示剂 ① 强酸——强碱:选酚酞或甲基橙都可以② 强酸滴定弱碱:滴定终点为酸性,选甲基橙③ 强碱滴定弱酸:滴定终点为碱性,选酚酞三.误差分析教学反思本节课是实验课,在教学过程中,教师应注重学生操作的规范性,明确实验原理,引导学生自己进行误差分析。
相关课件
这是一份人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH背景图ppt课件,共60页。
这是一份化学选择性必修1第二单元 溶液的酸碱性授课ppt课件,共18页。PPT课件主要包含了学习目标,工业生产,农业生产,环保领域,交流讨论,酸碱中和滴定原理,中和滴定主要仪器,滴定管,酸式滴定管,碱式滴定管等内容,欢迎下载使用。
这是一份高中人教版 (新课标)第三章 水溶液中的离子平衡综合与测试授课ppt课件,共26页。PPT课件主要包含了学习目标,指示剂的选择,酸碱中和滴定,c酸V酸c碱V碱,c待=,c标·V标,仪器及其使用,酸式滴定管,碱式滴定管,2滴定管的构造等内容,欢迎下载使用。











