



2020-2021学年实验活动1 配制一定物质的量浓度的溶液教学ppt课件
展开思考一:纯碱属于盐类,其溶液呈碱性,那是否所有的盐溶液都显碱性呢?
实验一:用pH计测定0.1ml/L以下溶液的pH
原来,不同的盐溶液会呈现不同的酸碱性!
思考二:盐溶液酸碱性不同,是否有什么规律呢?
这似乎与盐类的阴阳离子“组成”有很大的关系
依据形成盐的酸或碱的强弱,我们可以将盐分为哪几类?
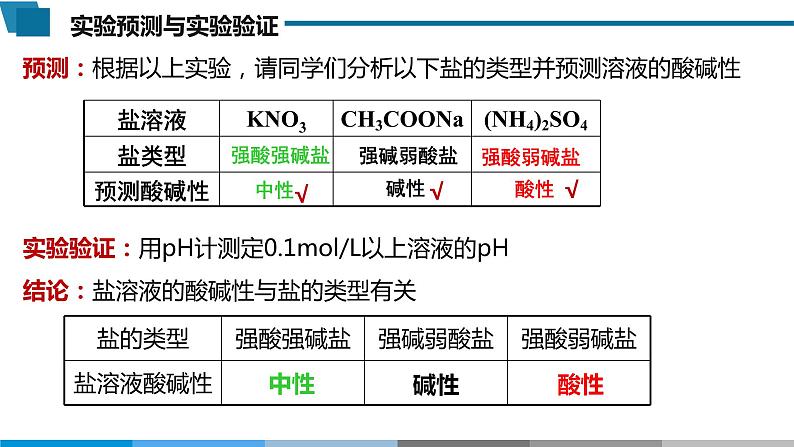
预测:根据以上实验,请同学们分析以下盐的类型并预测溶液的酸碱性
实验验证:用pH计测定0.1ml/L以上溶液的pH
结论:盐溶液的酸碱性与盐的类型有关
原来,Na2CO3是强碱弱酸盐,其溶液呈碱性,这就是它常被当做“碱”使用的原因!
溶液酸碱性的本质:氢离子浓度和氢氧根离子浓度的相对大小中性溶液: c(H+)= c(OH-)酸性溶液: c(H+)> c(OH-)碱性溶液: c(H+)< c(OH-)
思考三:是什么原因造成不同类型的盐溶液中c(H+)和 c(OH-)相对大小的差异呢?
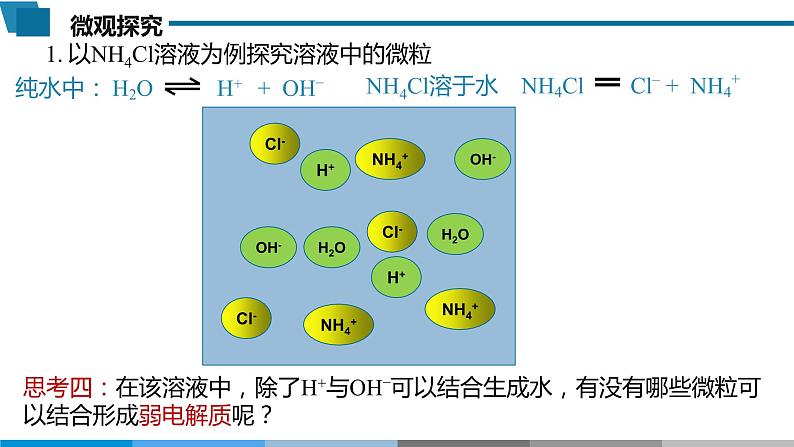
以NH4Cl溶液为例探究溶液中的微粒
思考四:在该溶液中,除了H+与OH–可以结合生成水,有没有哪些微粒可以结合形成弱电解质呢?
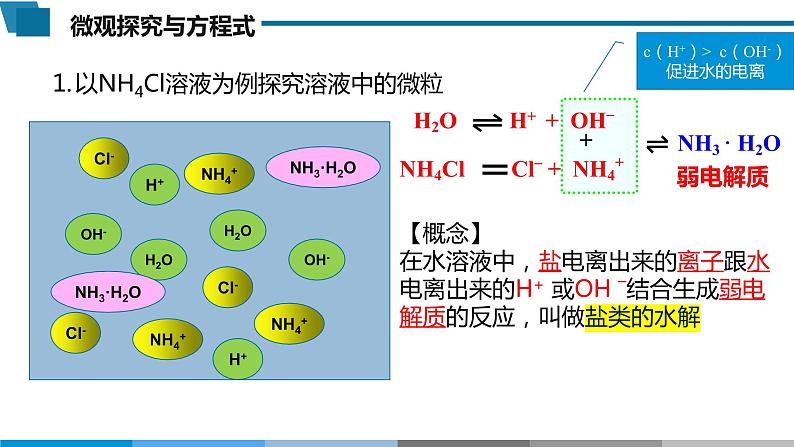
H2O H+ + OH–
NH3 · H2O
c(H+)> c(OH-)促进水的电离
【概念】在水溶液中,盐电离出来的离子跟水电离出来的H+ 或OH –结合生成弱电解质的反应,叫做盐类的水解
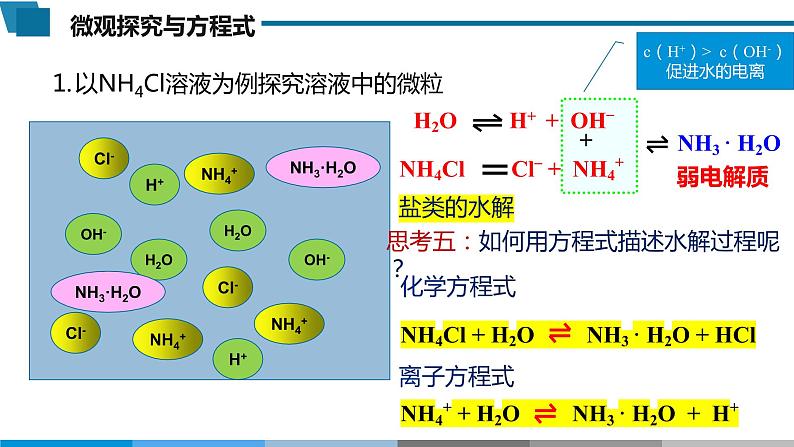
思考五:如何用方程式描述水解过程呢?
Na+、Cl–、H+、OH–
Cl–、NH4+、H+、OH–
Na+、 CH3COO–、 H+、OH–
c(H+) > c(OH–)
c(H+) = c(OH–)
c(H+) < c(OH–)
能(H2O、NH3 · H2O)
能(H2O、CH3COOH)
思考六:什么样的盐溶液可以发生水解反应呢?
概念:在水溶液中,盐电离出来的离子跟水电离出来的H+ 或OH –结合生成弱电解质的反应,叫做盐类的水解。
2.CH3COONa 溶液
思考七:Na2CO3是如何水解的呢?
Na2CO3的水解是分两步进行的
第二步,生成的HCO3- 进一步水解
第一步:CO32- 水解(主要)
1. 盐类水解是可逆反应,要写“ ”,如:
2. 一般盐类水解的程度很小,通常不生成沉淀或气体,在书写时一般不标“↓”或“↑”,也不把生成物写成分解产物的形式,如:
3. 多元弱酸盐的阴离子水解是分步进行的,以第一步为主。如:
4. 多元弱碱的阳离子水解较复杂,一般按一步水解处理。如:
写出以下溶液的水解离子方程式。
①NH4Br②Al2(SO4)3③NaF④FeCl3⑤NaClO⑥NaHCO3⑦NaAlO2⑧Na2S
【练一练】1.下列盐的水溶液中哪些不能水解( )哪些呈酸性( )哪些呈碱性( )① FeCl3 ② NaClO ③ (NH4)2SO4④ AgNO3 ⑤ Na2S ⑥ K2SO4
2.下列物质分别加入到水中,因促进水的电离而使溶液呈酸性的是( )A、硫酸 B、NaOH C、硫酸铝 D. 碳酸钠
在0.1ml/LNa2CO3溶液中,各种微粒之间存在下列关系,其中不正确的是( )A.c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)B.c(CO32-)+c(HCO3-)+c(H2CO3)= 0.1ml/LC.c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]D.c(Na+)>c(HCO3-)>c(OH-)>c(H+)
电荷守恒电解质溶液中阳离子所带的电荷总数与阴离子所带的电荷总数相等
电解质溶液中的电荷守恒与元素质量守恒
元素质量守恒电解质溶液中,由于某些离子发生水解或电离,离子的存在形式发生了变化,就该离子所含的某种元素来说,其质量在变化前后是守恒的
所以c(HCO3-)<c(OH-)
关注:水解的本质和特点、方程式的书写、溶液酸碱性的判断、电荷守恒与元素质量守恒
在水溶液中,盐电离出来的离子跟水电离出来的H+ 或OH –结合生成弱电解质的反应,叫做盐类的水解。
高中化学人教版 (2019)选择性必修1第三节 盐类的水解课前预习ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第三节 盐类的水解课前预习ppt课件,共35页。
化学选择性必修1第三节 盐类的水解精品课件ppt: 这是一份化学选择性必修1第三节 盐类的水解精品课件ppt,共15页。PPT课件主要包含了CH3COOH,溶液显碱性,离子方程式,理论分析,NH3·H2O,溶液显酸性,盐类的水解,促进水的电离,生成弱电解质,NH4Cl等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解教学课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解教学课件ppt,文件包含第2课时影响盐类水解的主要因素盐类水解的应用pptx、第1课时盐类的水解pptx等2份课件配套教学资源,其中PPT共111页, 欢迎下载使用。













