

化学第二节 氯及其化合物巩固练习
展开2.2.2氯气的实验室制法及氯离子的检验
一、基础练习:
1.下列关于Si、Cl、S等非金属元素单质及其化合物的说法中正确的是( )
A.实验室可用浓硫酸干燥硫化氢气体
B.陶瓷、水晶、水泥、玻璃都属于硅酸盐产品
C.漂白粉变质后的残留固体有碳酸钙
D.单质氯气及单质硫与铁反应生成的产物中,铁的化合价相同
2.氯化氢和氯气在生产生活中具有广泛应用。舍勒发现将软锰矿和浓盐酸混合加热可产生氯气,该方法仍是当今实验室制备氯气的主要方法之一。Deacon曾提出在催化剂作用下,通过氧气直接氧化氯化氢制备氯气。该反应为可逆反应,热化学方程式为。实验室制取时,下列装置能达到相应实验目的的是( )
A | B | C | D |
制备 | 净化 | 收集 | 尾气处理 |
A.A
B.B
C.C
D.D
3.实验室制取 时,能用于干燥的试剂是( )
A.碱石灰 B.浓硫酸 C.固体烧碱 D.生石灰
4.一般用于检验Cl-的试剂是( )
A.BaCl2、稀硝酸 B.稀硝酸 、AgNO3 C.稀盐酸、BaCl2 D.AgNO3、稀盐酸
5.下列说法正确的是( )
A.Cl-和Cl2都有毒
B.将AgNO3溶液滴入甲溶液中,若出现白色沉淀,则说明甲溶液中含有Cl-
C.将NaCl溶液滴入AgNO3溶液中或将Cl2通 入AgNO3溶液中均会出现白色沉淀
D.含Cl-的溶液和氯水一样均呈黄绿色
6.实验室制备的反应为。下列说法错误的是( )
A.该反应中HCl作还原剂,作氧化剂
B.每生成,转移2mol电子
C.每消耗,有被氧化
D.利用该反应制备的粗产品中,除含有水蒸气外,还含有HCl气体
7.某同学用下列装置进行有关的实验。下列说法不正确的是( )
A.I图中:实验现象证明氯气无漂白作用,氯水有漂白作用
B.II图中:闻的气味
C.III图中:生成棕黄色的烟
D.IV图中:若气球干瘪,证明可与NaOH反应
8.下列有关实验室制取氯气的说法不正确的是( )
A.可用二氧化锰和稀盐酸加热反应生成氯气
B.干燥氯气时常用浓硫酸作干燥剂
C.多余的氯气用氢氧化钠溶液吸收
D.收集氯气用向上排空气法
9.离子检验的常用方法有三种:
检验方法 | 沉淀法 | 显色法 | 气体法 |
含义 | 反应中有沉淀产生或溶解 | 反应中有颜色变化 | 反应中有气体产生 |
下列离子检验的方法不合理的是( )
A. :气体法 B.:气体法 C.:显色法 D.:沉淀法
10.检验氯离子的试剂是稀硝酸和硝酸银溶液,加入过量稀硝酸的目的是( )
A.排除碳酸根离子的干扰
B.排除硫酸根离子的干扰
C.生成白色沉淀
D.排除硝酸根离子的干扰
二、能力提升:
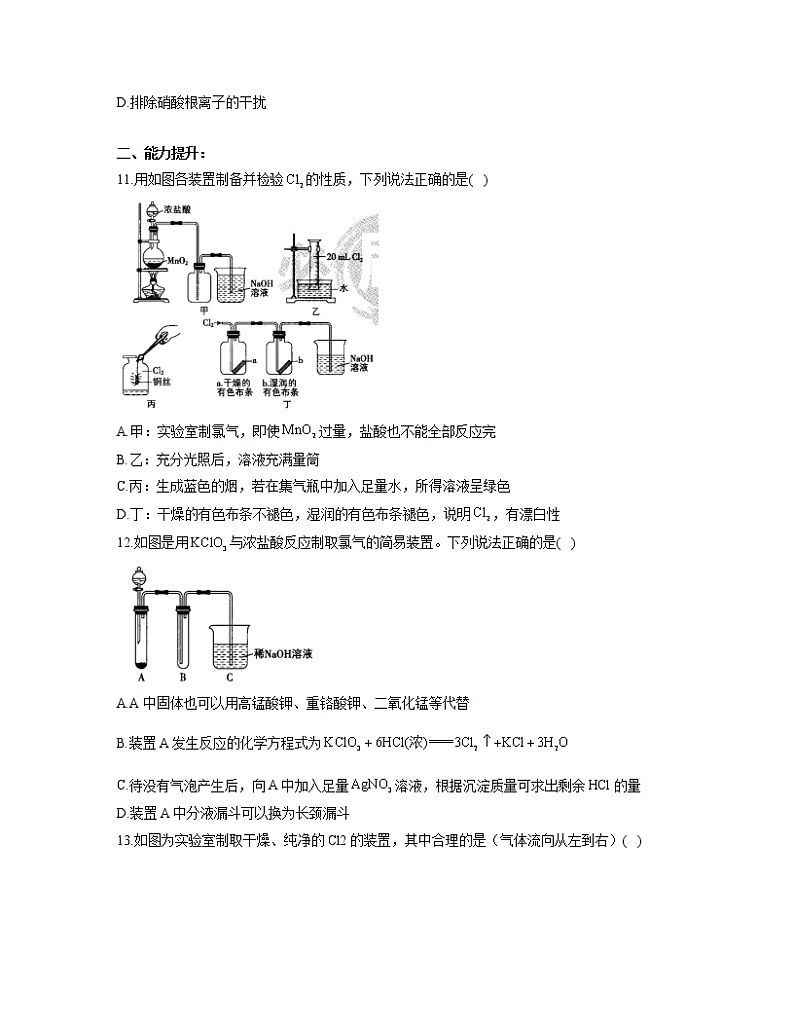
11.用如图各装置制备并检验的性质,下列说法正确的是( )
A.甲:实验室制氯气,即使过量,盐酸也不能全部反应完
B.乙:充分光照后,溶液充满量筒
C.丙:生成蓝色的烟,若在集气瓶中加入足量水,所得溶液呈绿色
D.丁:干燥的有色布条不褪色,湿润的有色布条褪色,说明,有漂白性
12.如图是用与浓盐酸反应制取氯气的简易装置。下列说法正确的是( )
A.A中固体也可以用高锰酸钾、重铬酸钾、二氧化锰等代替
B.装置A发生反应的化学方程式为
C.待没有气泡产生后,向A中加入足量溶液,根据沉淀质量可求出剩余HCl的量
D.装置A中分液漏斗可以换为长颈漏斗
13.如图为实验室制取干燥、纯净的Cl2的装置,其中合理的是(气体流向从左到右)( )
A.制
B.净化
C.收集
D.尾气处理
14.已知两瓶气体分别是HCl和。可以区别它们的方法或试剂是( )
①观察颜色
②打开瓶盖看有无白雾
③硝酸银溶液
④湿润的红色石蕊试纸
⑤湿润的蓝色石蕊试纸
A.①②③④
B.①②⑤
C.①②④⑤
D.①②④
15.实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
(1)A中盛有浓盐酸,B中盛有,写出反应的离子方程式:_____。
(2)E中为红色干布条,F中为红色湿布条,可观察到的现象是__________,对比E和F中现象的差异可得出的结论及解释是_______。
(3)试管C和D中试剂各为_______________。
(4)装置G处发生反应的离子方程式为_______________。
(5)用离子方程式表示试剂X的作用:________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。
“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式:___________________。
答案以及解析
1.答案:C
解析:硫化氢具有还原性,能与浓硫酸反应,不能用浓硫酸干燥硫化氢气体,故A错误;陶瓷、水泥、玻璃都属于硅酸盐产品,而水晶的主要成分为二氧化硅,不属于硅酸盐产品,故B错误;漂白粉变质是因为次氯酸钙与空气中的二氧化碳和水蒸气反应生成碳酸钙,所以漂白粉变质后的残留固体有碳酸钙,故C正确;氯气具有强氧化性,与铁反应生成三氯化铁,硫为弱氧化剂,与铁反应生成硫化亚铁,所以单质氯气及单质硫与铁反应生成的产物中,铁的化合价不同,故D错误。
2.答案:D
解析:
3.答案:B
解析:
4.答案:B
解析:
5.答案:C
解析:Cl-无毒,而Cl2有毒,A错误;苦甲溶液中含有 、,加入AgNO3溶液也会生成白色沉淀,B错误; NaCl溶液或氯水中均有Cl-,都可与AgNO3溶液反应生成 AgCl白色沉淀,C正确;Cl-在溶液中无色,D错误。
6.答案:C
解析:实验室制备的反应为,作氧化剂,HCl作还原剂,每生成,转移2mol电子,浓盐酸具有挥发性,因此得到的气体中还有挥发出来的HCl气体,A、B、D正确;该反应每消耗,同时消耗,其中有被氧化,另外表现酸性,C错误。
7.答案:D
解析:若能与NaOH溶液反应,则烧瓶内压强减小,气球就会鼓起来。
8.答案:A
解析:A.二氧化锰与稀盐酸不反应,应选浓盐酸与二氧化锰加热制备氯气,故A错误; B浓硫酸具有吸水性,且与氯气不反应,则干燥氯气时常用浓硫酸作干燥剂,故B正确; C.氯气有毒,与NaOH溶液反应,则多余的氯气用氢氧化钠溶液吸收,故C正确; D氯气的密度比空气密度大,可用向上排空气法收集,故D正确;故选:A。
9.答案:B
解析:A.的检验方法:取少量的样品与试管中,向试管中加入氢氧化钠溶液,加热,观察是否产生能使湿润的红色石蕊试纸变蓝的气体,属于气体法,故A正确; B.的检验方法是利用生成淡黄色的溴化银沉淀,故该方法属于沉淀法,故B正确; C.的检验方法是利用生成硫酸钡沉淀,故方法属于沉淀法,故C错误; D.的检验方法是滴加硫氰化钾溶液,看是否显血红色,属于显色法,故D正确;故选:C。
10.答案:A
解析:常见和AgNO3溶液反应生成白色沉淀的反应有: Ag++Cl-=AgCl,+2Ag+=Ag2CO3。所以加入稀硝酸主要是为了防止碳酸根的干扰。因为碳酸银溶于稀硝酸,而AgCl不溶于稀硝酸。
11.答案:A
解析:二氧化锰和浓盐酸在加热条件下发生氧化还原反应生成氯气,但稀盐酸与二氧化锰不反应,当盐酸浓度降低至一定程度时,反应停止,则盐酸不能完全消耗,故A正确;乙中涉及反应有,反应过程中有生成,所以溶液不能充满量筒,故B错误;氯气与铜反应生成棕黄色的烟,加足量水后溶液呈蓝色,故C错误;湿润的有色布条能褪色,是由于发生反应:,生成的HClO具有漂白性,而氯气没有漂白性,故D错误。
12.答案:B
解析:浓盐酸与二氧化锰在常温下不反应,A项错误;用与浓盐酸反应,生成氯化钾、氯气和水,化学方程式为,B项正确;反应产物中的KCl也会和溶液反应生成AgCl,因此不能利用沉淀质量求出剩余HCl的量,C项错误;装置A为生成气体的装置,若将分液漏斗换为长颈漏斗,则反应速率不易控制,容易造成压强过大,液体无法滴落,甚至会造成危险,D项错误。
13.答案:C
解析:实验室利用浓盐酸与二氧化锰在加热条件下制取氯气,选项中缺少加热装置,故A错误;浓盐酸易挥发,制得的氯气中含有氯化氢及水蒸气,必须先通过饱和食盐水除去氯化氢,再通过浓硫酸干燥得到干燥纯净的氯气,故B错误;氯气的密度大于空气,可用向上排空气法收集,故C正确;氯气应用氢氧化钠溶液进行尾气处理,故D错误。
14.答案:C
解析:HCl是无色气体,是黄绿色气体,因此可以通过观察气体的颜色区分HCl和,故①正确;HCl遇空气中水蒸气产生白雾,则不会,可以区分HCl和,故②正确;HCl和都可以与硝酸银溶液反应生成白色沉淀,不能用硝酸银溶液区分HCl和,故③错误;湿润的红色石蕊试纸遇HCl仍为红色,湿润的红色石蕊试纸遇后褪色(与反应生成的HClO有漂白性),可以区分HCl和,故④正确;湿润的蓝色石蕊试纸遇HCl变红,湿润的蓝色石蕊试纸遇先变红后褪色,能够区分HCl和,故⑤正确。故选C。
15.答案:(1)
(2)E中不褪色,F中褪色;干燥的氯气没有漂白性,氯气和水反应生成的次氯酸有漂白性
(3)饱和食盐水和浓硫酸
(4)
(5)
(6)
解析:(1)与浓盐酸在加热条件下发生氧化还原反应生成氯气、氯化锰和水,方程式,故离子方程式为,故答案为:;
(2)干燥的氯气依次通过E中红色干布条,F中红色湿布条,看到现象为E中布条不褪色, F中布条褪色,说明氯气不具有漂白性,具有漂白性的为次氯酸;故答案为:E中不褪色,F中褪色;干燥的氯气没有漂白性,氯气和水反应生成的次氯酸有漂白性;
(3)制得的氯气混有HCl气体和水蒸气,由C中饱和食盐水除去HCl,D中浓硫酸吸收水蒸气;故答案为:饱和食盐水、浓硫酸;
(4)G是浸有淀粉KI溶液的棉花球,氯气将KI氧化生成碘单质,故离子方程式为,故答案为:;
(5)氯气有毒不能直接排放到空气中,由于氯气能够与碱反应,产生容易溶于水的物质,所以可以用氢氧化钠溶液作吸收试剂,吸收过量的氯气,反应的离子方程式是,故答案为:;
(6)次氯酸根离子与氯离子发生氧化还原反应生成氯气和水,离子方程式;故答案为:。
人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第二节 氯及其化合物课后复习题: 这是一份人教版 (2019)必修 第一册<a href="/hx/tb_c161981_t7/?tag_id=28" target="_blank">第二章 海水中的重要元素——钠和氯第二节 氯及其化合物课后复习题</a>,共15页。试卷主要包含了掌握氯气的实验室制法;,了解氯离子的检验方法;,初步了解卤族元素,仪器和装置 ,除杂,收集方法,尾气处理,注意事项等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二节 氯及其化合物精练: 这是一份人教版 (2019)必修 第一册<a href="/hx/tb_c161981_t7/?tag_id=28" target="_blank">第二节 氯及其化合物精练</a>,文件包含222氯气的实验室制法氯离子的检验精准练习-高一化学同步学习高效学讲练人教版必修第一册原卷版docx、222氯气的实验室制法氯离子的检验精准练习-高一化学同步学习高效学讲练人教版必修第一册解析版docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
化学人教版 (2019)第二节 氯及其化合物课后复习题: 这是一份化学人教版 (2019)第二节 氯及其化合物课后复习题,文件包含222氯气的实验室制法与氯离子的检验分层作业解析版-2022-2023学年高一化学同步备课系列人教版2019必修第一册docx、222氯气的实验室制法与氯离子的检验分层作业原卷版-2022-2023学年高一化学同步备课系列人教版2019必修第一册docx等2份试卷配套教学资源,其中试卷共15页, 欢迎下载使用。













