





高中化学人教版 (2019)必修 第二册第六章 化学反应与能量第一节 化学反应与能量变化评课课件ppt
展开
这是一份高中化学人教版 (2019)必修 第二册第六章 化学反应与能量第一节 化学反应与能量变化评课课件ppt,共27页。PPT课件主要包含了镁条表面产生大量气泡,盐酸与镁反应放热,这是一个吸热反应,放热反应,1定义,吸热反应,C+H2Og,CO+H2,课堂测评,我们下次见等内容,欢迎下载使用。
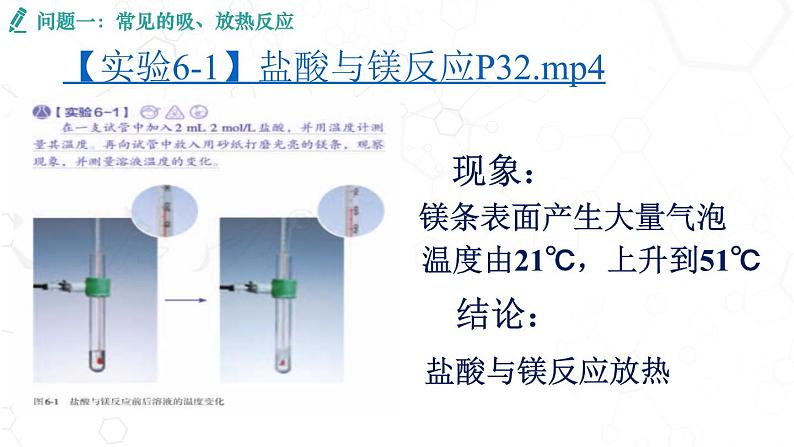
问题一:常见的吸、放热反应
温度由21℃,上升到51℃
【实验6-1】盐酸与镁反应P32.mp4
3.产生有刺激性气味的气体
2.烧杯变凉,小木片粘到了烧杯底部
【实验6-2】 氢氧化钡晶体与氯化铵晶体的反应P33.mp4
释放热量的化学反应称为放热反应
(2)常见的放热反应:
所有的燃烧反应和缓慢氧化反应、 所有的酸碱中和反应、大多数化合反应、铝热反应、活泼金属与水或酸的反应
吸收热量的化学反应称为吸热反应
(2)常见的吸热反应:
大多数的分解反应、C+CO2
Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3·H2O+8H2O
NaHCO3+HCl=H2O+CO2↑+NaCl
NaOH固体溶于水、浓硫酸的稀释,属于放热过程;NH4NO3固体溶于水,升华、蒸发等属于吸热过程。
①吸热反应和放热反应均是化学反应
②需要加热的反应不一定是吸热反应
③在可逆反应中,如果正反应为吸热, 则逆反应为放热
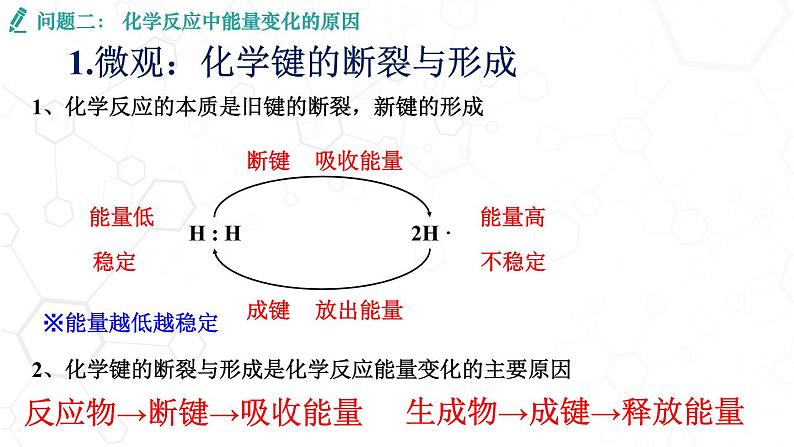
1.微观:化学键的断裂与形成
问题二: 化学反应中能量变化的原因
生成物→成键→释放能量
反应物→断键→吸收能量
2、化学键的断裂与形成是化学反应能量变化的主要原因
1、化学反应的本质是旧键的断裂,新键的形成
举例:H2(g)+Cl2(g)=2HCl(g)
2.宏观:反应物与生成物的总能量高低
放热反应
:反应物的总能量>生成物的总能量
吸热反应
:反应物的总能量Q3 D.若该反应吸收能量,则Q1+Q2
相关课件
这是一份高中化学人教版 (2019)必修 第二册第一节 化学反应与能量变化教学ppt课件,共52页。PPT课件主要包含了课前·新知导学,刺激性,黏结在一起,断裂和形成,答案吸热放热,总能量,天然气,课堂·重难探究,典例精练,课堂小结等内容,欢迎下载使用。
这是一份高中化学必修2 第1课时 化学反应与热能,共43页。
这是一份人教版 (2019)第一节 化学反应与能量变化课前预习课件ppt,共60页。PPT课件主要包含了必备知识·自主学习,逐渐溶解,刺激性,化学键的断裂和形成,不可再生,SO2,NOx,燃烧效率,能源利用,新能源等内容,欢迎下载使用。










