

鲁科版 (2019)必修 第一册第3节 氧化还原反应学案
展开
这是一份鲁科版 (2019)必修 第一册第3节 氧化还原反应学案,文件包含231认识氧化还原反应-2021-2022学年高一化学精讲精练新鲁科版必修第一册解析版docx、231认识氧化还原反应-2021-2022学年高一化学精讲精练新鲁科版必修第一册原卷版docx等2份学案配套教学资源,其中学案共16页, 欢迎下载使用。
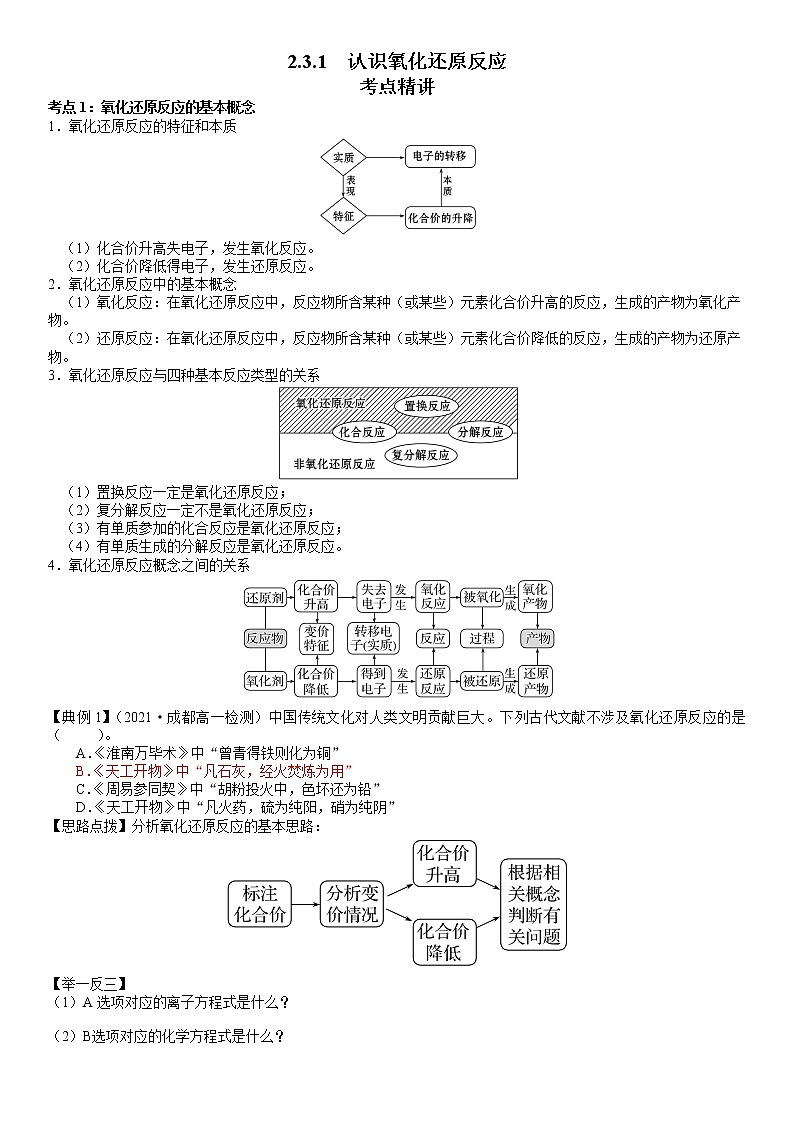
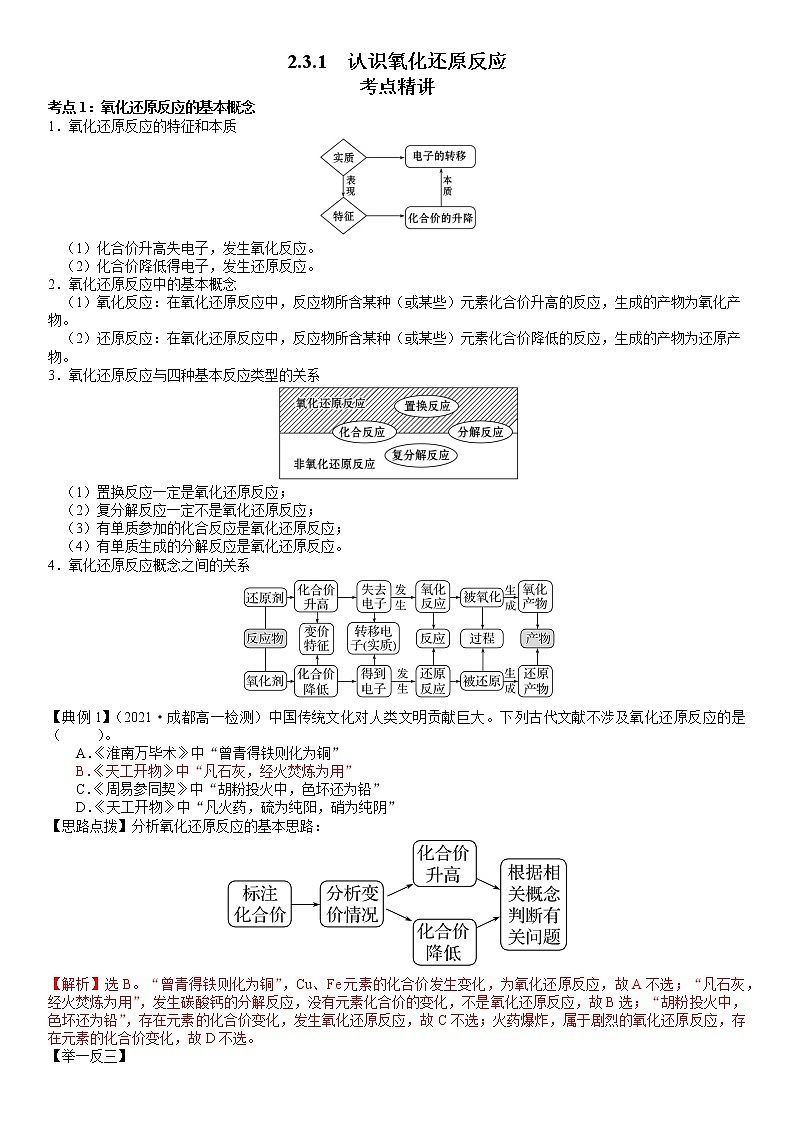
2.3.1 认识氧化还原反应
考点精讲
考点1:氧化还原反应的基本概念
1.氧化还原反应的特征和本质
(1)化合价升高失电子,发生氧化反应。
(2)化合价降低得电子,发生还原反应。
2.氧化还原反应中的基本概念
(1)氧化反应:在氧化还原反应中,反应物所含某种(或某些)元素化合价升高的反应,生成的产物为氧化产物。
(2)还原反应:在氧化还原反应中,反应物所含某种(或某些)元素化合价降低的反应,生成的产物为还原产物。
3.氧化还原反应与四种基本反应类型的关系
(1)置换反应一定是氧化还原反应;
(2)复分解反应一定不是氧化还原反应;
(3)有单质参加的化合反应是氧化还原反应;
(4)有单质生成的分解反应是氧化还原反应。
4.氧化还原反应概念之间的关系
【典例1】(2021·成都高一检测)中国传统文化对人类文明贡献巨大。下列古代文献不涉及氧化还原反应的是( )。
A.《淮南万毕术》中“曾青得铁则化为铜”
B.《天工开物》中“凡石灰,经火焚炼为用”
C.《周易参同契》中“胡粉投火中,色坏还为铅”
D.《天工开物》中“凡火药,硫为纯阳,硝为纯阴”
【思路点拨】分析氧化还原反应的基本思路:
【解析】选B。“曾青得铁则化为铜”,Cu、Fe元素的化合价发生变化,为氧化还原反应,故A不选;“凡石灰,经火焚炼为用”,发生碳酸钙的分解反应,没有元素化合价的变化,不是氧化还原反应,故B选;“胡粉投火中,色坏还为铅”,存在元素的化合价变化,发生氧化还原反应,故C不选;火药爆炸,属于剧烈的氧化还原反应,存在元素的化合价变化,故D不选。
【举一反三】
(1)A选项对应的离子方程式是什么?
提示:Cu2++FeFe2++Cu。
(2)B选项对应的化学方程式是什么?
提示:CaCO3CaO+CO2↑。
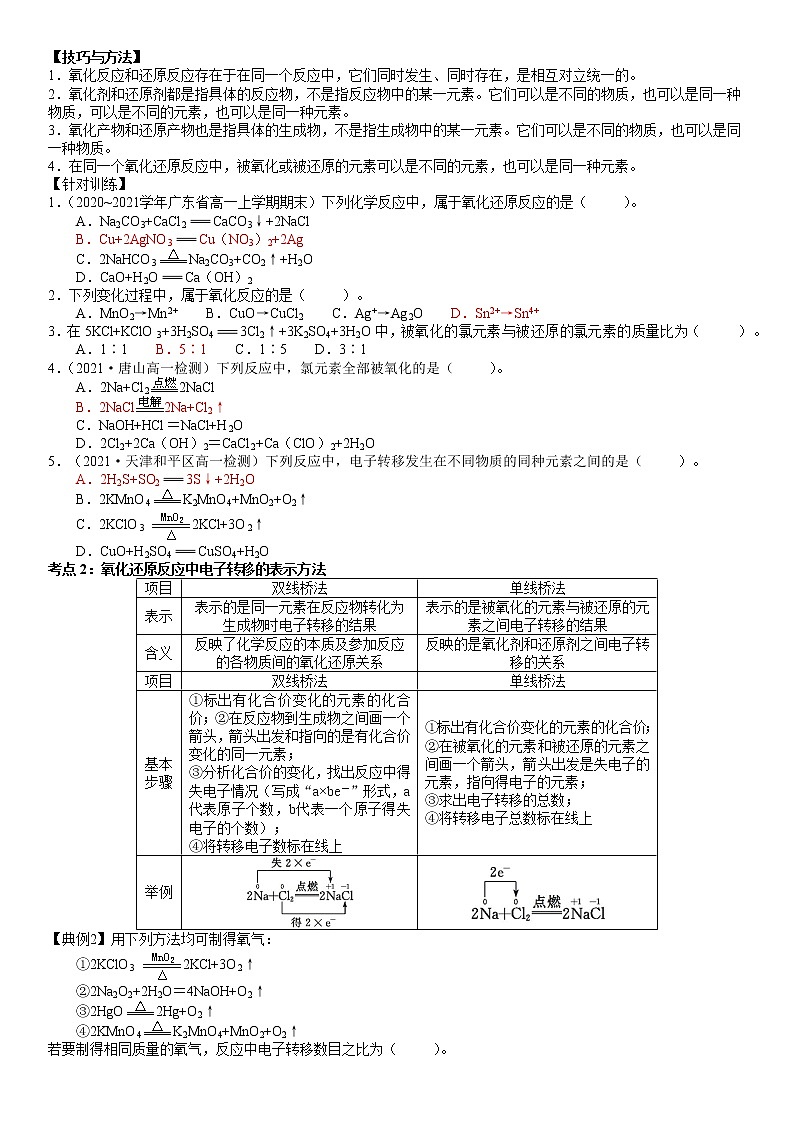
【技巧与方法】
1.氧化反应和还原反应存在于在同一个反应中,它们同时发生、同时存在,是相互对立统一的。
2.氧化剂和还原剂都是指具体的反应物,不是指反应物中的某一元素。它们可以是不同的物质,也可以是同一种物质,可以是不同的元素,也可以是同一种元素。
3.氧化产物和还原产物也是指具体的生成物,不是指生成物中的某一元素。它们可以是不同的物质,也可以是同一种物质。
4.在同一个氧化还原反应中,被氧化或被还原的元素可以是不同的元素,也可以是同一种元素。
【针对训练】
1.(2020~2021学年广东省高一上学期期末)下列化学反应中,属于氧化还原反应的是( )。
A.Na2CO3+CaCl2CaCO3↓+2NaCl
B.Cu+2AgNO3Cu(NO3)2+2Ag
C.2NaHCO3Na2CO3+CO2↑+H2O
D.CaO+H2OCa(OH)2
【解析】选B。Na2CO3+CaCl2CaCO3↓+2NaCl为复分解反应,不存在元素化合价变化,不属于氧化还原反应,故A不选;反应Cu+2AgNO3Cu(NO3)2+2Ag为置换反应,Cu、Ag元素的化合价发生变化,属于氧化还原反应,故B选;反应2NaHCO3Na2CO3+CO2↑+H2O中,各元素的化合价都没有发生变化,不是氧化还原反应,故C不选;反应CaO+H2OCa(OH)2中不存在元素化合价变化,不属于氧化还原反应,故D不选。
2.下列变化过程中,属于氧化反应的是( )。
A.MnO2→Mn2+ B.CuO→CuCl2 C.Ag+→Ag2O D.Sn2+→Sn4+
【解析】选D。A中化合价降低发生还原反应,B中铜元素的化合价没改变,C中银元素的化合价没改变,D中锡元素的化合价升高被氧化。
3.在5KCl+KClO3+3H2SO43Cl2↑+3K2SO4+3H2O中,被氧化的氯元素与被还原的氯元素的质量比为( )。
A.1∶1 B.5∶1 C.1∶5 D.3∶1
【解析】选B。由可知,被氧化的氯元素与被还原的氯元素的质量比为5∶1。
4.(2021·唐山高一检测)下列反应中,氯元素全部被氧化的是( )。
A.2Na+Cl22NaCl
B.2NaCl2Na+Cl2↑
C.NaOH+HCl=NaCl+H2O
D.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】选B。该反应中Cl元素化合价由0价变为-1价,所以氯元素得电子化合价降低,全部被还原,故A错误;该反应中Cl元素化合价由-1价变为0价,所以Cl元素失电子化合价升高,全部被氧化,故B正确;该反应中没有电子转移,所以不是氧化还原反应,属于复分解反应,故C错误;该反应中Cl元素化合价由0价变为-1价、+1价,所以Cl元素被氧化、被还原,故D错误。
5.(2021·天津和平区高一检测)下列反应中,电子转移发生在不同物质的同种元素之间的是( )。
A.2H2S+SO23S↓+2H2O
B.2KMnO4K2MnO4+MnO2+O2↑
C.2KClO32KCl+3O2↑
D.CuO+H2SO4CuSO4+H2O
【解析】选A。2H2S+SO23S↓+2H2O反应是在-2价硫和+4价硫之间发生电子转移的氧化还原反应,故A正确;该反应中Mn元素化合价由+7价变为+6价、+4价,氧元素化合价由-2价变为0价,是在锰元素和氧元素之间发生电子转移的氧化还原反应,故B错误;该反应中Cl元素化合价由+5价变为-1价,反应是在氯元素和氧元素之间发生电子转移的氧化还原反应,故C错误;CuO+H2SO4CuSO4+H2O该反应中各元素化合价不变,故D错误。
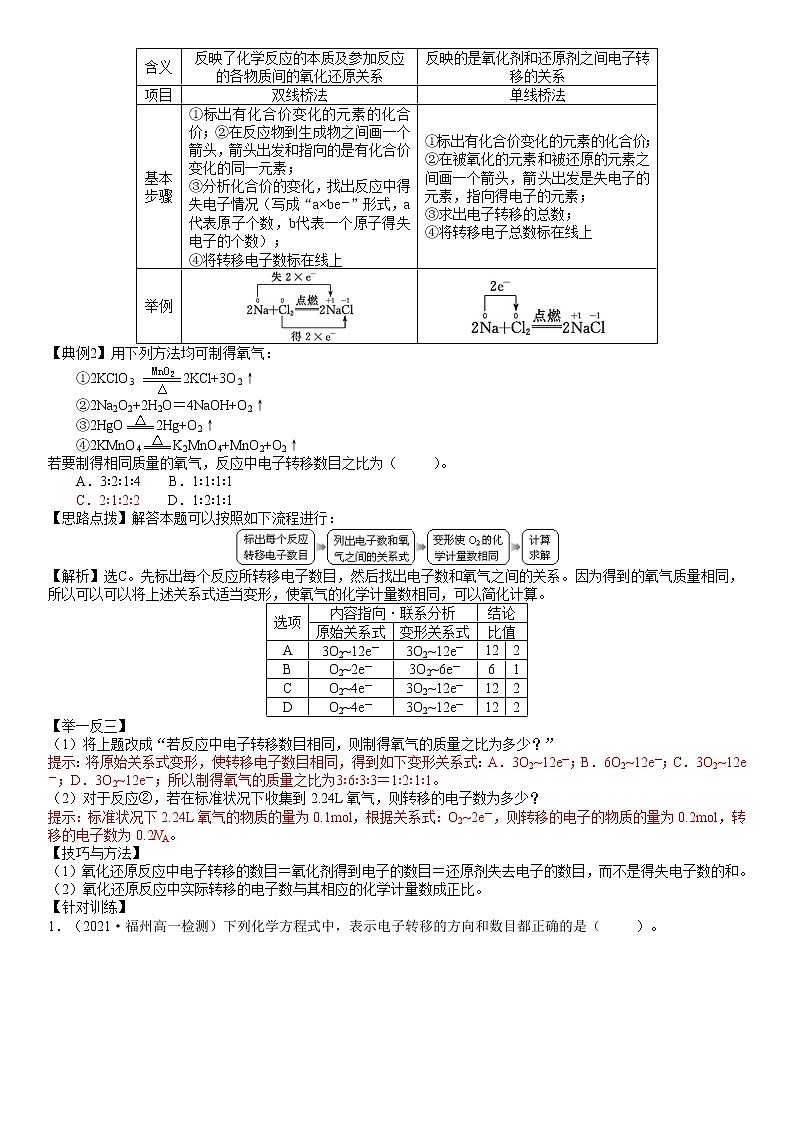
考点2:氧化还原反应中电子转移的表示方法
项目
双线桥法
单线桥法
表示
表示的是同一元素在反应物转化为生成物时电子转移的结果
表示的是被氧化的元素与被还原的元素之间电子转移的结果
含义
反映了化学反应的本质及参加反应的各物质间的氧化还原关系
反映的是氧化剂和还原剂之间电子转移的关系
项目
双线桥法
单线桥法
基本步骤
①标出有化合价变化的元素的化合价;②在反应物到生成物之间画一个箭头,箭头出发和指向的是有化合价变化的同一元素;
③分析化合价的变化,找出反应中得失电子情况(写成“a×be-”形式,a代表原子个数,b代表一个原子得失电子的个数);
④将转移电子数标在线上
①标出有化合价变化的元素的化合价;
②在被氧化的元素和被还原的元素之间画一个箭头,箭头出发是失电子的元素,指向得电子的元素;
③求出电子转移的总数;
④将转移电子总数标在线上
举例
【典例2】用下列方法均可制得氧气:
①2KClO32KCl+3O2↑
②2Na2O2+2H2O=4NaOH+O2↑
③2HgO2Hg+O2↑
④2KMnO4K2MnO4+MnO2+O2↑
若要制得相同质量的氧气,反应中电子转移数目之比为( )。
A.3∶2∶1∶4 B.1∶1∶1∶1
C.2∶1∶2∶2 D.1∶2∶1∶1
【思路点拨】解答本题可以按照如下流程进行:
【解析】选C。先标出每个反应所转移电子数目,然后找出电子数和氧气之间的关系。因为得到的氧气质量相同,所以可以可以将上述关系式适当变形,使氧气的化学计量数相同,可以简化计算。
选项
内容指向·联系分析
结论
原始关系式
变形关系式
比值
A
3O2~12e-
3O2~12e-
12
2
B
O2~2e-
3O2~6e-
6
1
C
O2~4e-
3O2~12e-
12
2
D
O2~4e-
3O2~12e-
12
2
【举一反三】
(1)将上题改成“若反应中电子转移数目相同,则制得氧气的质量之比为多少?”
提示:将原始关系式变形,使转移电子数目相同,得到如下变形关系式:A.3O2~12e-;B.6O2~12e-;C.3O2~12e-;D.3O2~12e-;所以制得氧气的质量之比为3∶6∶3∶3=1∶2∶1∶1。
(2)对于反应②,若在标准状况下收集到2.24L氧气,则转移的电子数为多少?
提示:标准状况下2.24L氧气的物质的量为0.1mol,根据关系式:O2~2e-,则转移的电子的物质的量为0.2mol,转移的电子数为0.2NA。
【技巧与方法】
(1)氧化还原反应中电子转移的数目=氧化剂得到电子的数目=还原剂失去电子的数目,而不是得失电子数的和。
(2)氧化还原反应中实际转移的电子数与其相应的化学计量数成正比。
【针对训练】
1.(2021·福州高一检测)下列化学方程式中,表示电子转移的方向和数目都正确的是( )。
【解析】选B。A项中箭头方向标反,应为。C项中Cu由0价升高到+2价,转移2e-,HNO3中部分N由+5价降低到+4价,转移2×e-,正确的表示方法为+2H2O。D项中HgS中汞元素由+2价降低到0价,得到2e-,O2中氧元素由0价降低到-2价,得到2×2e-,故反应中共得到6e-,HgS中硫元素由-2价升高到+4价,失去6e-,正确的表示方法为。
2.将0.1mol Na投入足量水中,水共获得的电子个数为( )。
A.NA/2 B.2.3NA C.0.1NA D.NA
【解析】选C。Na和水反应的化学方程式方程式为:2Na+2H2O2NaOH+H2↑,每消耗1mol Na,转移1mol电子,则0.1molNa完全反应转移电子的物质的量为0.1mol,其个数为0.1NA。
3.(2021·大庆高一检测)在反应3Cu2S+22HNO3=6Cu(NO3)2+3H2SO4+10NO↑+8H2O中,1mol还原剂失去电子的物质的量为(Cu2S中Cu为+1价)( )。
A.6mol B.8mol C.10mol D.12mol
【解析】选C。在该反应中铜元素的化合价由+1价变成+2价,升高了6×1=6,硫元素的化合价由-2价变成+6价,升高了3×8=24,化合价一共升高了6+24=30;氮元素的化合价由+5价变成+2价,一共降低了10×3=30,所以该反应转移的电子总数为30,还原剂Cu2S和转移的电子总数之间的关系为3Cu2S~30e-,所以1molCu2S失去电子的物质的量为10mol。
4.被誉为“太空金属”的钛(Ti),在自然界中主要以金红石(TiO2)的形式存在。由于金红石熔点高,为金属Ti的直接制备带来了困难。在工业上常常采用将其先转化成熔沸点较低的TiCl4后再进行还原的方法。金红石转化成TiCl4的反应方程式如下:TiO2+2C+2Cl2TiCl4+2CO。
(1)指出发生还原反应的是_______,氧化产物是_______。
(2)用双线桥法标出电子转移。
(3)当有6mol电子转移,则有_______molC被氧化。
【解析】(1)氯元素的化合价降低,碳元素的化合价升高,则Cl2发生还原反应,CO是氧化产物。(2)在反应中,碳元素的化合价由0价升高到+2价,氯元素的化合价由0价降低为-1价,电子转移情况如下:。(3)根据化学方程式,当消耗2mol碳单质时,转移的电子为4mol,当有6mol电子转移,则有3molC被氧化。
【答案】(1)Cl2;CO(2)(3)3
合格考达标练
1.中华民族有着光辉灿烂的发明史,下列发明创造不涉及氧化还原反应的是( )。
A.用胆矾炼铜 B.用铁矿石炼铁
C.黑火药的使用 D.打磨磁石制指南针
【解析】选D。用胆矾炼铜,Cu的化合价从+2价降低到0价,所以涉及氧化还原反应,故A不选;用铁矿石炼铁,Fe元素的化合价降低,铁矿石被还原,属于氧化还原反应,故B不选;黑火药的使用时,发生了剧烈的爆炸,C、S、N等元素的化合价发生变化,涉及氧化还原反应,故故C不选;打磨磁石制指南针,属于物理变化,不是化学变化,不涉及氧化还原反应,故D选。
2.下列反应不属于氧化还原反应的是( )。
A.3Fe+4H2O(g)Fe3O4+4H2
B.NaOH+HClNaCl+H2O
C.3NO2+H2O2HNO3+NO
D.Cl2+H2OHCl+HClO
【解析】选B。氧化还原反应的特征是元素化合价的升降,如发生氧化还原反应,则肯定存在元素化合价的变化,结合物质的性质和元素的化合价的变化判断。Fe和H元素化合价发生变化,属于氧化还原反应,故A不符合题意;复分解反应一定不是氧化还原反应,故B符合题意;N元素化合价发生变化,属于氧化还原反应,故C不符合题意;Cl元素化合价发生变化,属于氧化还原反应,故D不符合题意。
3.下列四种基本类型的反应中,一定有电子转移的反应是( )。
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
【解析】选C。有电子转移的反应属于氧化还原反应,四种基本类型的反应中,置换反应一定是氧化还原反应。
4.(2021年1月·浙江学考真题)反应8NH3+6NO2=7N2+12H2O中,还原剂是( )。
A.NH3 B.NO2 C.N2 D.H2O
【解析】选C。在反应中失电子化合价升高的反应物是还原剂,在该反应中NH3中N元素的化合价由-3价变为N2中的0价,被氧化,则N2是还原剂。
5.(2021·连云港高一检测)下列对氧化还原反应分析正确的是( )。
【解析】选C。A中,4molHCl参加反应,只有2mol被氧化成Cl2,失去2mol电子;B中,Fe失去电子,发生氧化反应,HCl得到电子,发生还原反应;D中,钨元素的化合价由WO3中的+6价变成单质钨中的0价,化合价降低,发生还原反应,氢元素的化合价由H2中的0价变成H2O中的+1价,化合价升高,发生氧化反应。
6.(2021·南京师大附中高一检测)对于反应:4Na+3CO22Na2CO3+C,下列说法正确的是( )。
A.Na是氧化剂
B.Na在反应中被氧化
C.CO2全部被还原
D.CO2既是氧化剂又是还原剂
【解析】选B。Na元素化合价升高,失去电子,是还原剂,A错误;Na在反应中被氧化,B正确;3mol二氧化碳参加反应,只有1molCO2被还原,C错误;碳元素化合价降低,CO2是氧化剂,D错误。
7.下列反应中,划线的物质发生氧化反应的是( )。
A.Cu+2FeCl32FeCl2+CuCl2
B.CO2+C2CO
C.Fe2O3+2AlAl2O3+2Fe
D.CO2+NaOHNaHCO3
【解析】选C。A项中FeCl3中的Fe,B项中CO2中的C化合价都是降低的,所以FeCl3和CO2都发生还原反应;C项Al价态升高,发生氧化反应,D项不是氧化还原反应。
8.(2020~2021学年深圳高一上期中)实现下列变化,需要加入氧化剂的是( )。
A.HCl→Cl2 B.HCl→H2 C.I2→KI D.NaCl→AgCl
【解析】选A。HCl→Cl2,Cl元素由-1价升高到0价,表现出还原性,需要加入氧化剂才能实现此转化,故A选;HCl→H2,H元素由+1价降低到0价,表现出氧化性,需要加入还原剂,故B不选;I2→KI,虽然I元素的价态降低,表现出氧化性,但由于I2与KOH反应,自身可实现化合价的升与降,所以不需另加还原剂,故C不选;NaCl→AgCl,Cl元素的价态没有发生改变,不需另加氧化剂或还原剂,故D不选。
9.(2021·福建福州高一检测)一定条件下氨气和氧化铜可以发生如下反应:2NH3+3CuO3Cu+N2+3H2O,对此反应的分析合理的是( )。
A.该反应属于置换反应
B.CuO是氧化剂
C.反应体现了金属铜的还原性
D.每生成1molH2O就伴随着1mol电子转移
【解析】选B。该反应的反应物中无单质,不是置换反应,A项错误;反应中NH3→N2,氮元素化合价升高,被氧化,作还原剂,每生成3molH2O,同时生成lmolN2,转移电子6mol,D项错误;CuO→Cu,铜元素化合价降低,CuO作氧化剂,Cu为还原产物,B对、C错。
10.(2020年7月·浙江学考真题)反应MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O中,氧化产物与还原产物的物质的量之比是( )。
A.1∶2 B.1∶1 C.2∶1 D.4∶1
【解析】选B。由反应方程式可知,反应物MnO2中的Mn元素的化合价为+4价,生成物MnCl2中Mn元素的化合价为+2价,反应物HCl中Cl元素的化合价为-1价,生成物Cl2中Cl元素的化合价为0价,故MnCl2是还原产物,Cl2是氧化产物,由氧化还原反应中得失电子守恒可知,n(Cl2)∶n(MnCl2)=1∶1,B符合题意。
11.在2Mg+O22MgO的化学反应中,氧元素的化合价由0价降低为_______价;氧原子得到电子的总数为_______,则镁原子失去电子的总数为_______,1molMg反应时转移电子的物质的量为_______。
【解析】在该反应中氧元素化合价由0价降低为-2价;氧原子得电子数是2,得电子总数是2×2=4;镁元素化合价升高2价,化合价升高总数是2×2=4;镁原子失电子数是2,失电子总数是2×2=4。
【答案】-2,4,4,2mol
12.(2021·泉州高一期中检测)氧化亚铜(Cu2O)是一种鲜红色粉末状固体,几乎不溶于水,可在酸性溶液中发生反应,与硫酸、盐酸、硝酸反应如下:
①Cu2O+H2SO4=CuSO4+Cu+H2O
②Cu2O+4HCl=2HCuCl2+H2O
③3Cu2O+14HNO3(稀)=6Cu(NO3)2+2NO↑+7H2O
(1)Cu2O中Cu的化合价为________。
(2)反应①中氧化剂为________,还原剂为________。
(3)反应②______(填“是”或“不是”)氧化还原反应,若是请说明转移电子情况,若不是请说明判断依据________________________________。
(4)请写出反应③的离子方程式________________________________;生成标准状况下22.4LNO,转移电子数为________,做氧化剂的硝酸的物质的量为______。
【解析】(1)Cu2O中O元素的化合价为-2价,则Cu为+1价;(2)反应①中只有Cu元素的化合价发生变化,Cu2O中Cu元素的化合价降低作氧化剂,同时Cu2O中Cu元素的化合价升高作还原剂;(3)反应②Cu2O+4HCl=2HCuCl2+H2O中没有元素化合价的变化,不是氧化还原反应;(4)3Cu2O+14HNO3(稀)=6Cu(NO3)2+2NO↑+7H2O的离子方程式为3Cu2O+14H++2NO3-=6Cu2++2NO↑+7H2O;反应中N元素从+5价降低到+2价,当生成标准状况下22.4LNO,则转移的电子为1mol×(5-2)=3mol,即转移电子数为3NA;发生化合价的变化的硝酸作氧化剂,其物质的量为1mol。
【答案】(1)+1(2)Cu2O;Cu2O
(3)不是;反应前后没有元素化合价的改变
(4)3Cu2O+14H++2NO3-=6Cu2++2NO↑+7H2O;3NA;1mol
等级考提升练
1.(2021·肇庆高一检测)下列古代技术的应用中,不涉及氧化还原反应的是( )。
【解析】选C。古法炼铁中金属元素的化合价降低,为氧化还原反应,故A不选;化丹(Pb3O4)为铅,Pb元素化合价变化,为氧化还原反应,故B不选;煅烧贝壳,是碳酸钙发生分解反应,没有发生氧化还原反应,故C选;火药爆炸,属于剧烈的氧化还原反应,存在元素的化合价变化,故D不选。
2.(2021·东营高一检测)如图为反应Fe+CuSO4Cu+FeSO4中电子转移的关系图,则图中的元素甲、乙分别表示( )。
A.Fe,S B.Cu,S C.Fe,O D.Fe,Cu
【解析】选D。Fe与CuSO4反应,Fe失电子被氧化,Cu2+得电子被还原。
3.(2021·渭南高一检测)氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是( )。
A.2H2+O22H2O
B.2NaHCO3Na2CO3+H2O+CO2↑
C.CuO+COCu+CO2
D.C+FeOFe+CO↑
【解析】选C。从图中的关系可以看出区域3表示的化学反应属于氧化还原反应,但又不属于四种基本反应类型。A项中的反应既属于氧化还原反应,又属于化合反应,B项中的反应为非氧化还原反应,C项中的反应属于氧化还原反应,但又不属于四种基本反应类型,D项中的反应为氧化还原反应,又属于置换反应。
4.(2021·南京高一检测)下列反应中,SO2被还原的是( )。
A.SO2+2NaOH=Na2SO3
B.SO2+Cl2+2H2O=H2SO4+2HCl
C.SO2+2H2S=3S↓+2H2O
D.SO2+NO2=SO3+NO
【解析】选C。S元素化合价没有发生变化,不是氧化还原反应,故A错误;S元素化合价升高,被氧化,故B错误;SO2中S元素化合价降低,被还原,故C正确;S元素化合价升高,被氧化,故D错误。
5.某金属元素由氧化物转变为单质,则该金属元素( )。
A.一定被氧化
B.一定被还原
C.可能被氧化,也可能被还原
D.既不被氧化,也不被还原
【解析】选B。金属元素在氧化物中显正化合价,转变成单质变为0价,得电子被还原。
6.下列标明电子转移的方向和数目的化学方程式中正确的是( )。
A.
B.
C.
D.
【解析】选B。A项中锌失电子,氢得电子,而不是锌得电子,氢失电子;B项中应注意KCl是KClO3的还原产物,O2是KClO3的氧化产物,B项正确;C项,得失电子总数为6;D项,HNO3中的+5价氮原子得电子生成NO2中的+4价的氮原子,箭头应指向氮原子而不是氧原子,且得失电子总数为2而不是4。
7.下列对X+2YX2++2Y-的叙述中正确的是( )。
A.Y被还原,X2+是还原产物 B.Y被还原,X发生氧化反应
C.X是还原剂,Y被氧化 D.X被氧化,X显氧化性
【解析】选B。在反应X+2YX2++2Y-中Y的化合价降低,Y作氧化剂,发生还原反应、被还原,Y-是还原产物;X的化合价升高、作还原剂,发生氧化反应、被氧化,X2+是氧化产物,据此可知选项A、C、D均错误,B正确。
8.下列几种反应类型之间的关系正确的是( )。
【解析】选B。置换反应有单质参与,肯定有元素化合价的变化,置换反应都是氧化还原反应,有些离子反应不是氧化还原反应,如H++OH-H2O,因此选项A、C、D均是错误的,B正确。
9.(双选)(2021·太原高一检测)N2O既是医学上的一种麻醉剂,又是一种常见的温室气体。制取N2O的方法有很多,例如:
①NH4NO3=N2O↑+2H2O
②K2SO3+2NO=K2SO4+N2O↑
③2NH3+2O2=N2O↑+3H2O
④2NaNO3+(NH4)2SO4=2N2O↑+Na2SO4+4H2O
下列说法正确的是( )。
A.反应①中硝酸铵既是氧化剂又是还原剂,H2O是氧化产物
B.反应②中K2SO3是还原剂,N2O是氧化产物
C.反应③中每生成1molN2O,转移8mol电子
D.反应④中NaNO3是氧化剂,N2O既是氧化产物又是还原产物
【解析】选CD。反应①中硝酸铵中-3价的氮元素和+5价的氮元素反应归中反应生成N2O中+1价的氮元素,所以NH4NO3既是氧化剂又是还原剂,N2O既是氧化产物又是还原产物,A选项错误;反应②中硫元素的化合价升高,氮元素的化合价降低,所以K2SO3是还原剂,K2SO4是氧化产物,NO是氧化剂,N2O是还原产物,B选项错误;反应③中,氮元素的化合价由-3价升高到+1价,共升高8价,氧元素的化合价由0价降低到-2价,共降低8价,所以该反应转移8个电子,即每生成1molN2O,转移8mol电子,C选项正确;反应④中(NH4)2SO4中-3价的氮元素和NaNO3中+5价的氮元素反应归中反应生成N2O中+1价的氮元素,所以(NH4)2SO4是还原剂,NaNO3是氧化剂,N2O既是氧化产物又是还原产物,D选项正确。
10.(2021·辽源高一检测)重铬酸钾(K2Cr2O7)是重要的化合物,常用于制铬矾、火柴、铬颜料等。一些含铬化合物的转化关系如下图所示:
下列有关说法不正确的是( )。
A.K2Cr2O7中Cr的化合价为+6
B.②③⑤均属于非氧化还原反应
C.完成①④⑥的转化均需加入氧化剂
D.①中生成1molCrCl3,转移3mol电子
【解析】选C。K2Cr2O7中钾元素为+1价,氧元素为-2价,化合物中各元素的化合价代数和为0,因此可得Cr元素的化合价为+6价。选项正确,A不符合题意;反应②③⑤中各元素的化合价都没有发生变化,都属于非氧化还原反应。选项正确,B不符合题意;反应①中铬元素的化合价降低,发生还原反应,需加入还原剂;反应④⑥中铬元素的化合价均升高,发生氧化反应,需加入氧化剂。选项错误,C符合题意;反应①中铬由+6价变为+3价,得到3个电子,因此生成1molCrCl3时,转移电子数为3mol。选项正确,D不符合题意。
11.(2020~2021学年广东云浮市高一下期末)铜广泛应用于电气、轻工、机械制造、国防工业等。回答下列问题:
(1)用黄铜矿冶铜原理如图所示。
①CuFeS2中Fe的化合价为________。
②反应Ⅲ的化学方程式为___________________________________。
(2)铜锈中有无害的Cu2(OH)2CO3和有害的“粉状锈”[Cu2(OH)3Cl]。
①Cu2(OH)2CO3和Cu2(OH)3Cl均属于_______(填“正”、“酸式”或“碱式”)盐;CuCl在湿的空气中生成Cu2(OH)3Cl的反应中,CuCl作_______。(填“氧化剂”或“还原剂”)
②上述流程图中涉及的物质中属于酸性氧化物的是_______,属于碱性氧化物的是_______。
【解析】(1)①CuFeS2中Cu为+2价,S为-2价,Fe为+2价,②反应Ⅲ中反应为Cu2O和Cu2S,二者在高温条件下反应生成铜单质,根据元素价态变化规律和元素守恒可知应还有SO2生成,所以化学方程式为2Cu2O+Cu2S6Cu+SO2↑,(2)Cu2(OH)2CO3和Cu2(OH)3Cl都可以电离出氢氧根,所以为碱式盐;CuCl转化为Cu(OH)Cl铜元素的化合价升高,所以作还原剂;SO2属于酸性氧化物,FeO属于碱性氧化物。【答案】(1)+2价;2Cu2O+Cu2S6Cu+SO2↑;(2)碱式;还原剂;SO2;FeO。
12.已知实验室制取氯气的反应原理为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。
(1)该反应中氧化剂是______(填化学式),被氧化的元素是____(填元素符号)。
(2)用单线桥法表示电子转移的方向和数目:_______________________。
(3)有一种“地康法”制取氯气的反应原理如图所示:
①反应Ⅰ的离子方程式为____________________________。
②反应Ⅱ属于__________反应(填四种基本反应类型之一)。
(4)在一定条件下,Fe2O3+3CO2Fe+3CO2反应中,__________(填名称)是还原剂,_______(填化学式)发生还原反应。生成112gFe时,消耗CO质量是____。
(5)维生素C又称“抗坏血酸”,能帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有__________(填“氧化性”或“还原性”)。
(6)火药是中国的“四大发明”之一。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+SK2S+N2↑+3CO2↑,其中氧化产物是__________(填化学式)。
【解析】所含元素化合价升高的反应物是还原剂,还原剂发生氧化反应得到氧化产物,还原剂失去电子具有还原性;所含元素化合价降低的反应物是氧化剂,氧化剂发生还原反应得到还原产物,氧化剂得到电子具有氧化性。一个氧化还原反应中,还原剂的还原性大于还原产物;氧化剂的氧化性大于氧化产物;(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O中,MnO2中锰元素化合价从+4价降低到+2价,故MnO2是氧化剂;HCl中氯元素化合价升高,故被氧化的元素是Cl;(2)结合(1)的分析,用单线桥法表示MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O电子转移的方向和数目为;(3)①反应Ⅰ为氧化铜和盐酸反应生成氯化铜和水,则离子方程式为CuO+2H+Cu2++H2O;②反应Ⅱ为氧气和氯化铜反应生成氧化铜和氯气,故反应Ⅱ属于四种基本反应类型之一的置换反应;(4)在一定条件下,Fe2O3+3CO2Fe+3CO2反应中,一氧化碳是还原剂,Fe2O3发生还原反应,生成112gFe即铁的物质的量为2mol时,由化学方程式知,消耗3molCO,其质量是84g;(5)Fe3+转变为Fe2+是还原反应,维生素C将Fe3+转变为Fe2+,这说明维生素C具有还原性;(6)反应2KNO3+3C+SK2S+N2↑+3CO2↑中,C化合价从0升高到+4价,故氧化产物是CO2。
【答案】(1)MnO2;Cl(2)
(3)①CuO+2H+Cu2++H2O②置换
(4)一氧化碳;Fe2O3;84g(5)还原性(6)CO2
相关学案
这是一份化学必修 第一册第3节 化学中常用的物理量——物质的量学案及答案,文件包含132气体摩尔体积-2021-2022学年高一化学精讲精练新鲁科版必修第一册解析版docx、132气体摩尔体积-2021-2022学年高一化学精讲精练新鲁科版必修第一册原卷版docx等2份学案配套教学资源,其中学案共119页, 欢迎下载使用。
这是一份高中第3章 物质的性质与转化第1节 铁的多样性导学案,文件包含311铁与铁盐-2021-2022学年高一化学精讲精练新鲁科版必修第一册解析版docx、311铁与铁盐-2021-2022学年高一化学精讲精练新鲁科版必修第一册原卷版docx等2份学案配套教学资源,其中学案共19页, 欢迎下载使用。
这是一份2020-2021学年第2节 硫的转化学案设计,文件包含322硫酸及其酸雨-2021-2022学年高一化学精讲精练新鲁科版必修第一册解析版docx、322硫酸及其酸雨-2021-2022学年高一化学精讲精练新鲁科版必修第一册原卷版docx等2份学案配套教学资源,其中学案共23页, 欢迎下载使用。










