安徽省合肥市中市区2023届高三(上)摸底检测化学试题(word版,含答案)
展开安徽省合肥市中市区2023届高三(上)摸底检测
理科综合(化学试题)
注意事项:
1.答题前,考生务必将自己的学校、姓名、班级、准考证号填写在答题卡上相应的位置。
2.全部答案在答题卡上完成,答在本试卷上无效。
3.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案用0.5毫米及以上黑色笔迹签字笔写在答题卡上。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Al-27 S-32 Cl-35.5 Ti-48 Zn-65
第Ⅰ卷(选择题 共42分)
一、选择题(本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项符合题目要求.)
1. 长征五号系列运载火箭是我国首型大推力无毒、无污染液体燃料火箭,运载能力位居世界前列,是中国由航天大国迈向航天强国的显著标志和重要支撑。下列叙述错误的是
A. 火箭芯一级尾段使用的碳纤维材料属于新型无机非金属材料
B. 火箭的整流罩前锥段材料-聚甲基丙烯酰亚胺属于有机高分子材料
C. 火箭采用2219-铝合金做箭体的蒙皮材料,有利于减轻火箭的质量
D. 火箭的推进剂是四氧化二氮和偏二甲肼
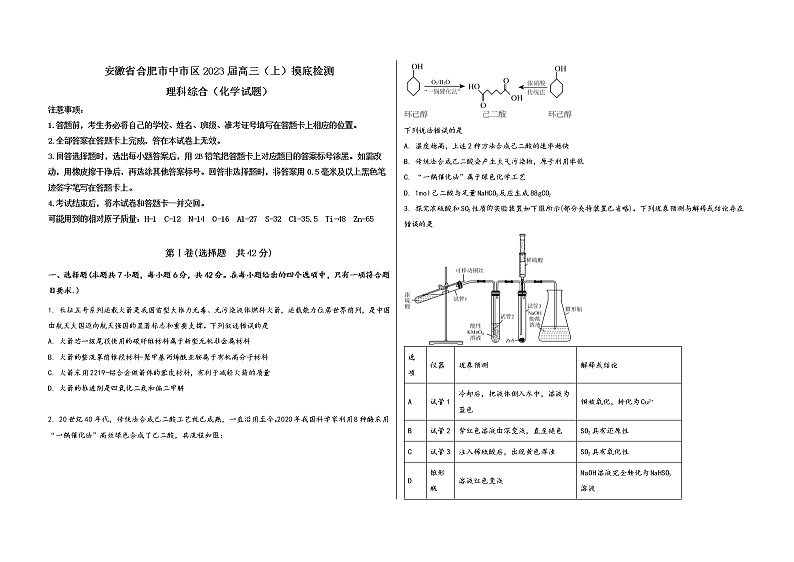
2. 20世纪40年代,传统法合成己二酸工艺就已成熟,一直沿用至今。2020年我国科学家利用8种酶采用“一锅催化法”高效绿色合成了己二酸,其流程如图:
下列说法错误的是
A. 温度越高,上述2种方法合成己二酸的速率越快
B. 传统法合成己二酸会产生大气污染物,原子利用率低
C. “一锅催化法”属于绿色化学工艺
D. 1mol己二酸与足量NaHCO3反应生成88gCO2
3. 探究浓硫酸和SO2性质实验装置如下图所示(部分夹持装置已省略)。下列现象预测与解释或结论存在错误的是
选项 | 仪器 | 现象预测 | 解释或结论 |
A | 试管1 | 冷却后,把液体倒入水中,溶液为蓝色 | 铜被氧化,转化为Cu2+ |
B | 试管2 | 紫红色溶液由深变浅,直至褪色 | SO2具有还原性 |
C | 试管3 | 注入稀硫酸后,出现黄色浑浊 | SO2具有氧化性 |
D | 锥形瓶 | 溶液红色变浅 | NaOH溶液完全转化为NaHSO3溶液 |
A. A B. B
C. C D. D
4. 氨氮废水是造成河流湖泊富营养化的主要原因,处理氨氮废水(主要以和NH3·H2O的形式存在)的主要流程如图所示:
下列说法不正确的是
A. 过程I降低氮元素浓度的方法:加入NaOH溶液,调节pH为碱性,升高温度,再通入空气,赶出氨气
B. 过程II是在碱性条件下通入氧气实现:→→转化,被氧气氧微生物化为 ,总反应的离子方程式: +2O2 +H2O+2H+
C. 过程III中甲醇的作用是作还原剂,将还原为N2
D. 过程III的转化过程为→→N2,每生成1molN2转移10mol电子
5. 短周期主族元素X、Y、Z、W原子序数依次增大,X与Z同主族,W与X原子的最外层电子数之和等于Y原子的最外层电子数,四种元素组成的一种食品添加剂的结构如图所示,下列叙述正确的是
A. Y、Z形成的简单离子半径:Y <Z
B. Z分别与X、Y形成的化合物中均含离子键
C. W的最高化合价氧化物的水化物为强酸
D. W、Y对应的简单氢化物沸点:Y<W
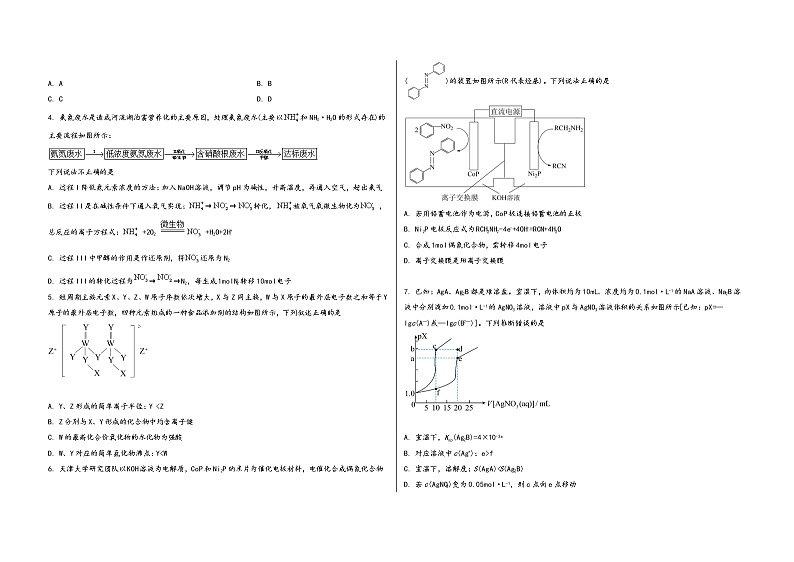
6. 天津大学研究团队以KOH溶液为电解质,CoP和Ni2P纳米片为催化电极材料,电催化合成偶氮化合物()的装置如图所示(R代表烃基)。下列说法正确的是
A. 若用铅蓄电池作为电源,CoP极连接铅蓄电池的正极
B. Ni2P电极反应式为RCH2NH2-4e-+4OH-=RCN+4H2O
C. 合成1mol偶氮化合物,需转移4mol电子
D. 离子交换膜是阳离子交换膜
7. 已知:AgA、Ag2B都是难溶盐。室温下,向体积均为10mL、浓度均为0.1mol·L-1的NaA溶液、Na2B溶液中分别滴加0.1mol·L-1的AgNO3溶液,溶液中pX与AgNO3溶液体积的关系如图所示[已知:pX=—lgc(A—)或—lgc(B2—)]。下列推断错误的是
A. 室温下,Ksp(Ag2B)=4×10-3a
B. 对应溶液中c(Ag+):e>f
C. 室温下,溶解度:S(AgA)<S(Ag2B)
D. 若c(AgNO3)变为0.05mol·L-1,则c点向e点移动
第Ⅱ卷(非选择题)
二、非选择题(本题包括必考题和选考题两部分,共58分。第8题~第10题为必考题,每个试题考生都必须作答,第11题~第12题为选考题,考生根据要求作答)
(一)必考题
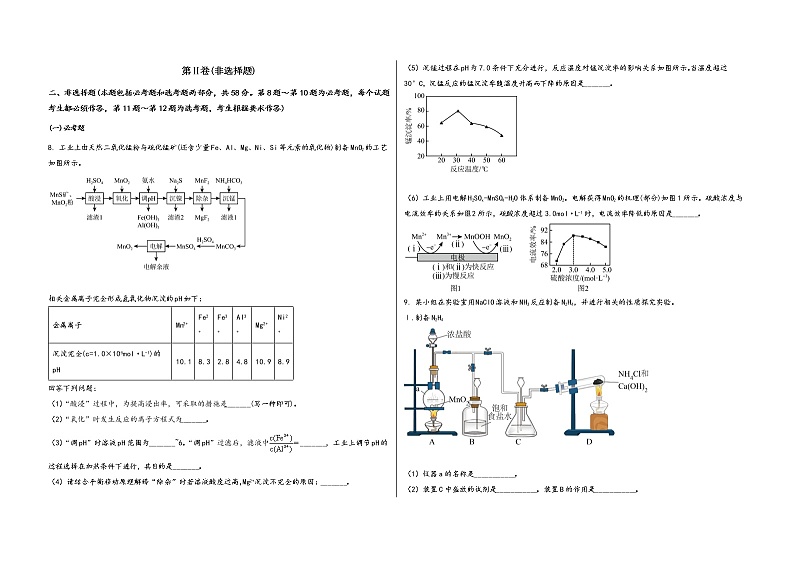
8. 工业上由天然二氧化锰粉与硫化锰矿(还含少量Fe、Al、Mg、Ni、Si等元素的氧化物)制备MnO2的工艺如图所示。
相关金属离子完全形成氢氧化物沉淀的pH如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Ni2+ |
沉淀完全(c=1.0×10-5mol·L-1)的pH | 10.1 | 8.3 | 2.8 | 4.8 | 10.9 | 8.9 |
回答下列问题:
(1)“酸浸”过程中,为提高浸出率,可采取的措施是_______(写一种即可)。
(2)“氧化”时发生反应的离子方程式为_______。
(3)“调pH”时溶液pH范围为_______~6。“调pH”过滤后,滤液中_______,工业上调节pH的过程选择在加热条件下进行,其目的是_______。
(4)请结合平衡移动原理解释“除杂”时若溶液酸度过高,Mg2+沉淀不完全的原因:_______。
(5)沉锰过程在pH为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。当温度超过30°C,沉锰反应的锰沉淀率随温度升高而下降的原因是_______。
(6)工业上用电解H2SOx-MnSO4-H2O体系制备MnO2。电解获得MnO2的机理(部分)如图1所示。硫酸浓度与电流效率的关系如图2所示,硫酸浓度超过3.0mol·L-1时,电流效率降低的原因是_______。
9. 某小组在实验室用NaClO溶液和NH3反应制备N2H4,并进行相关的性质探究实验。
Ⅰ.制备N2H4
(1)仪器a的名称是___________。
(2)装置C中盛放的试剂是___________。装置B的作用是___________。
(3)制备N2H4的离子方程式为___________。
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
(4)称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
①滴定到达终点的现象是___________。
②实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合腓的质量分数为___________。
Ⅲ.探究的还原性与碱性。将制得的耕分离提纯后,进行如图实验。
【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
操作 | 现象 | 实验结论 |
i.取少量黑色固体于试管中,加入适量①_________ | 黑色固体部分溶解 | 黑色固体有Ag2O |
ii.取少量黑色固体于试管中加入足量稀硝酸,振荡 | ②_________ | 黑色固体是Ag和Ag2O |
(5)请完成表中的空白部分:①___________;②___________。
(6)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:___________。
10. 工业上常用合成气(主要成分为CO、H2及少量CO2、H2O)制备甲醇,然后再利用甲醇合成其它化工产品,部分合成原理如下图所示:
回答下列问题:
(1)反应2为副反应,为了减少该副反应的发生,提高反应1的选择性,要优先考虑_______,已知298K时,由稳定态单质生成1mol化合物的焓变叫该物质在此温度下的标准生成焓()。下表为几种物质的标准生成焓,反应2的ΔH=_______kJ·mol-1
物质 | CO2(g) | CO(g) | H2O(g) |
(kJ·mol-1) | -394 | -111 | -242 |
(2)500K温度下,在2L的刚性容器中充入4molCO和8molH2制备二甲醚(忽略反应2的发生),4min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3)。
①从开始到平衡,反应1的v(H2)=_______mol·L-1·min-1。
②反应4中甲醇的转化率为_______,反应1的平衡常数Kc=_______。
(3)在T2K、1.0×104kPa下,等物质的量的CO与CH3OH混合气体只发生反应3。反应速率v正-v逆=k正·p(CO)·p(CH3OH)-k逆·p(CH3COOH),k正、k逆分别为正、逆反应的速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5,当CO的转化率为20%时,=________。
(4)对于反应2(不考虑其他反应),若CO和CO2的浓度随时间发生变化的曲线如图所示。则t2时刻改变的条件可能是_______(任写一种),若t4时刻通过改变容积的方法将压强增大为原来的2倍,在图中t4~t5区间内画出CO、CO2浓度变化曲线,并标明物质_________(假设各物质状态均保持不变)。
(二)选考题(.请考生从给出的2道题任选一题作答,并用2B铅笔在答题卡上把所选题目题号后的方框涂黑。注意所做题目的题号必修与所涂题目的题号一致,并且在解答过程中写清每问的小题号,在答题卡指定位置答题。如果多做,则每学科按所做的第一题计分。
【化学--选修3:物质结构与性质】
11. 磷酸亚铁锂(LiFePO4)电池是新能源汽车动力电池之一。
(1)写出基态Fe2+的核外电子排布式_______,请从原子结构角度解释Fe为何能呈+2价_______,与Fe同周期元素中,与Fe最外层电子数相等的副族元素有_______种。
(2)PO的立体构型_______,由两种短周期同主族元素构成且与磷酸根互为等电子体的粒子为_______,P的杂化轨道与O的2p轨道形成_______。
(3)Li2O具有反萤石结构,为立方晶系晶体,其晶胞参数为apm。该晶胞中离子的分数坐标为:
氧离子:(0,0,0);(,,0);(,0,);(0,,);……
锂离子:(,,);(,,);(,,);(,,);……
①在图上画出氧化锂晶胞沿x轴投影的俯视图_______。
②锂离子的配位数为_______。
③设NA为阿伏加德罗常数的值,氧化锂的晶体密度为_______g·cm-3(列出计算表达式)。
【化学--选修5:有机化学基础】
12. 有机合成中成环及环的元素增减是合成路线设计的关键问题之一,由 合成 路线如下:
已知:①
②
回答下列问题:
(1)A的分子式为_______;B中所含官能团名称为_______。
(2)C的结构简式为_______;E→F反应类型是_______。
(3)写出D→E的化学方程式_______。
(4)E的芳香族化合物的同分异构体中,核磁共振氢谱有四组峰且峰面积之比为9∶6∶2∶1的所有同分异构体的结构简式为_______。
(5)以 为原料合成 ,其合成路线为_______。
参考答案
一.选择题
1. D 2. A 3. D 4. B 5. B 6. B 7. D
二. 非选择题
8. (1)将矿物粉碎以增大接触面积、适当升高温度或适当增大硫酸浓度等
(2)2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
(3) ①. 4.8 ②. 106:1 ③. 提高反应速率
(4)酸度过高,氟离子与氢离子结合生成弱电解质HF,氟离子浓度减小,导致镁离子沉淀不完全
(5)温度升高,NH4HCO3受热分解
(6)前两步快反应:Mn2+-e-+2H2O=MnOOH+3H+,慢反应:MnOOH-e-=MnO2+H+,从电极反应来看,H+浓度太大,不利于电极反应正向进行,MnOOH直接与H+反应,故当硫酸浓度大于3mol/L时,电流效率降低
9. (1)圆底烧瓶
(2)①. NaOH溶液 ②. 平衡气压,收集多余氯气
(3)2NH3+ClO-=N2H4+Cl-+H2O
(4)①. 当加入最后一滴(或半滴)碘标准溶液时,溶液恰好变为蓝色,且半分钟内不褪色 ②. 25%
(5)①. 加入足量氨水 ②. 黑色固体溶解,并有气体产生
(6)肼具有还原性将Ag+还原为Ag,肼具有碱性,与Ag+反应生成AgOH,AgOH分解生成黑色的Ag2O
10. (1)①. 使用合适催化剂 ②. -41
(2)①. 0.8 ②. 80% ③. 1.25
(3)0.8
(4)①. 降低温度或增大水蒸气的量或减少氢气的量
②.
11. (1)①. [Ar]3d6或1s22s22p63s23p63d6 ②. Fe的价电子排布为3d64s2,其4s上的2个电子易失去显+2价 ③. 5
(2)①. 正四面体 ②. SO ③. σ
(3)①. ②. 4 ③.
12. (1) ①. C12H20O3 ②. 羰基、酯基
(2)①. ②. 加聚反应
(3)+H2O
(4)、
(5)
安徽省颍上县2023届高三(上)摸底检测化学试题(word版,含答案): 这是一份安徽省颍上县2023届高三(上)摸底检测化学试题(word版,含答案),共6页。试卷主要包含了5 Ti-48 Zn-65等内容,欢迎下载使用。
安徽省合肥市东市区2023届高三(上)摸底检测化学试题(word版,含答案): 这是一份安徽省合肥市东市区2023届高三(上)摸底检测化学试题(word版,含答案),共6页。试卷主要包含了5 Ti-48 Zn-65,5%左右,其成分中含有蛋白质,5NA等内容,欢迎下载使用。
安徽省合肥市西市区2023届高三(上)摸底检测化学试题(word版,含答案): 这是一份安徽省合肥市西市区2023届高三(上)摸底检测化学试题(word版,含答案),共6页。试卷主要包含了5 Ti-48 Zn-65, 2+O22+2H2O等内容,欢迎下载使用。












