
安徽省桐城市2023届高三(上)摸底检测化学试题(word版,含答案)
展开安徽省桐城市2023届高三(上)摸底检测
理科综合(化学试题)
注意事项:
1.答题前,考生务必将自己的学校、姓名、班级、准考证号填写在答题卡上相应的位置。
2.全部答案在答题卡上完成,答在本试卷上无效。
3.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案用0.5毫米及以上黑色笔迹签字笔写在答题卡上。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Al-27 S-32 Cl-35.5 Ti-48 Zn-65
第Ⅰ卷(选择题 共42分)
一、选择题(本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项符合题目要求.)
1. 化学与人类生产、生活、社会可持续发展密切相关,下列叙述错误的是
A. 复合膨松剂中添加柠檬酸,是利用其还原性
B. 铝制餐具不宜用来蒸煮酸性、碱性或咸的食物
C. 用Na2S除去工业废水中的Cu2+和Hg2+
D. 二氧化硫作为细菌抑制剂,可作为保护剂添加到葡萄酒中
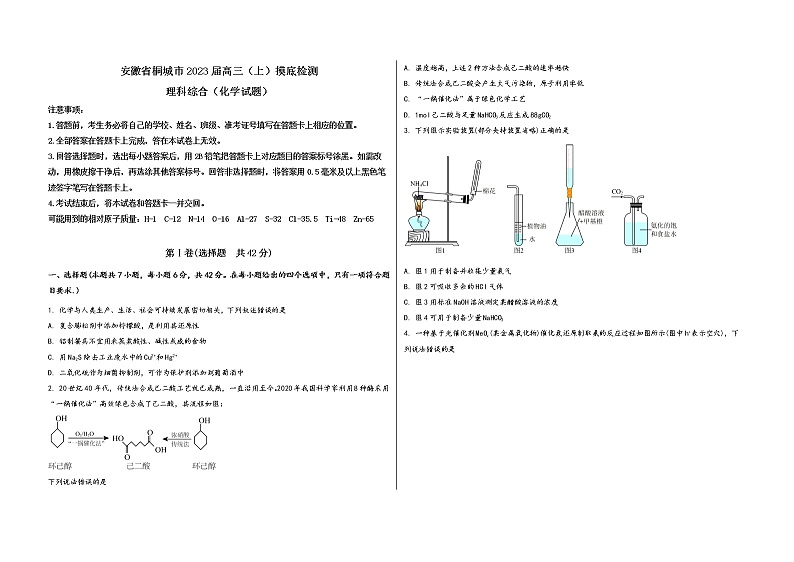
2. 20世纪40年代,传统法合成己二酸工艺就已成熟,一直沿用至今。2020年我国科学家利用8种酶采用“一锅催化法”高效绿色合成了己二酸,其流程如图:
下列说法错误的是
A. 温度越高,上述2种方法合成己二酸的速率越快
B. 传统法合成己二酸会产生大气污染物,原子利用率低
C. “一锅催化法”属于绿色化学工艺
D. 1mol己二酸与足量NaHCO3反应生成88gCO2
3. 下列图示实验装置(部分夹持装置省略)正确的是
A. 图1用于制备并收集少量氨气
B. 图2可吸收多余的HCl气体
C. 图3用标准NaOH溶液测定某醋酸溶液的浓度
D. 图4可用于制备少量NaHCO3
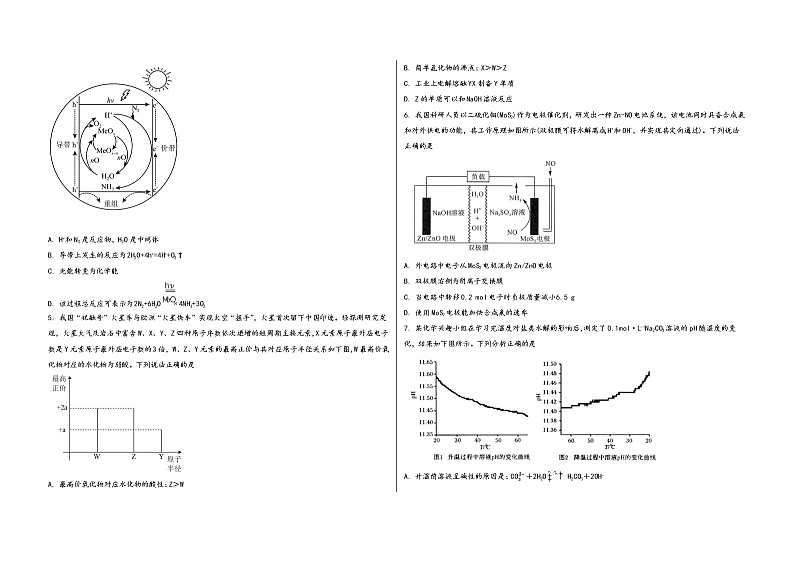
4. 一种基于光催化剂MeOx(某金属氧化物)催化氮还原制取氨的反应过程如图所示(图中h+表示空穴),下列说法错误的是
A. H+和N2是反应物,H2O是中间体
B. 导带上发生的反应为2H2O+4h+=4H++O2↑
C. 光能转变为化学能
D. 该过程总反应可表示为2N2+6H2O4NH3+3O2
5. 我国“祝融号”火星车与欧洲“火星快车”实现太空“握手”,火星首次留下中国印迹。经探测研究发现,火星大气及岩石中富含W、X、Y、Z四种原子序数依次递增的短周期主族元素,X元素原子最外层电子数是Y元素原子最外层电子数的3倍,W、Z、Y元素的最高正价与其对应原子半径关系如下图,W最高价氧化物对应的水化物为弱酸。下列说法正确的是
A. 最高价氧化物对应水化物的酸性:Z>W
B. 简单氢化物的沸点:X>W>Z
C. 工业上电解熔融YX制备Y单质
D. Z的单质可以和NaOH溶液反应
6. 我国科研人员以二硫化钼(MoS2)作为电极催化剂,研发出一种Zn-NO电池系统,该电池同时具备合成氨和对外供电的功能,其工作原理如图所示(双极膜可将水解离成H+和OH-,并实现其定向通过)。下列说法正确的是
A. 外电路中电子从MoS2电极流向Zn/ZnO电极
B. 双极膜右侧为阴离子交换膜
C. 当电路中转移0.2 mol电子时负极质量减小6.5 g
D. 使用MoS2电极能加快合成氨的速率
7. 某化学兴趣小组在学习完温度对盐类水解的影响后,测定了0.1mol·L-1Na2CO3溶液的pH随温度的变化,结果如下图所示。下列分析正确的是
A. 升温前溶液呈碱性的原因是:CO+2H2OH2CO3+2OH-
B. 常温下,0.1 mol·L-1Na2CO3溶液中:c(Na+)>2c(CO)+c(HCO)
C. 温度升高,Na2CO3水解程度增大,溶液pH增大,故图1实验数据一定错误
D. 降低温度,Na2CO3水解平衡移动和水的电离平衡移动对溶液pH的影响一致
第Ⅱ卷(非选择题)
二、非选择题(本题包括必考题和选考题两部分,共58分。第8题~第10题为必考题,每个试题考生都必须作答,第11题~第12题为选考题,考生根据要求作答)
(一)必考题
8. 无水氯化镨(PrCl3)是制取稀土金属镨及镨合金的主要原料,采用以下工艺流程可由孪生矿(主要含ZnS、FeS、Pr2S3、SiO2等)制备氯化镨晶体(PrCl3·6H2O)。
已知:①2FeCl3+ZnS=ZnCl2+2FeCl2+S;2FeCl3+FeS=3FeCl2+S
②该条件下,溶液中部分金属离子生成氢氧化物开始沉淀和完全沉淀时的pH如下表所示:
金属离子 | Zn2+ | Fe3+ | Fe2+ |
开始沉淀时的pH | 5.4 | 2.2 | 7.5 |
沉淀完全时的pH | 6.4 | 3.2 | 9.0 |
回答下列问题:
(1)①若其他条件不变,采取下列措施能提高镨元素浸出率的有_________(填字母)。
A.适当升高溶浸温度B.适当加快搅拌速率C.适当缩短溶浸时间
②写出“溶浸”时Pr2S3发生反应的离子方程式:_________。
(2)“滤渣1”主要成分是_________。
(3)在“沉淀”时加入氨水逐步调节溶液的pH至6.5,依次析出的金属离子是_________;已知Fe(OH)3在隔绝空气的条件下与FeS2混合焙烧时生成Fe3O4和S,写出该反应的化学方程式:_________。
(4)①利用电解法可以生产金属镨。先将氯化镨与工业纯KCl配成二元电解质体系(PrCl3-KCl);然后置于石墨电解槽内熔化,通入直流电进行电解。电解过程中得到金属镨的电极反应式为_________。
②科学家以氯化镨气溶胶为前驱体,研究了PrCl3·6H2O的高温热解机制。利用X射线衍射技术分析,其结果如下表所示:
热解温度/℃ | 氯化镨气溶胶的热解产物 |
600 | Pr(OH)2Cl和PrOCl |
700~1000 | Pr(OH)2Cl、PrOCl和PrO2 |
1100 | PrO2和Pr(OH)2Cl |
以上热解产物中,热稳定性最差的是_________(填化学式)。氯化镨的高温热解过程主要是发生PrCl3的水解反应、Pr(OH)2Cl的脱水反应和PrOCl的氧化反应,从表中数据分析1100℃时热解产物主要为PrO2而无PrOCl的原因是_________。
9. 硫氰化钾(KSCN)是一种用途广泛化学药品,常用于合成树脂、杀虫杀菌剂等。某实验小组用下图所示的装置制备硫化钾。
已知是一种难溶于水的无色液体,密度为1.26难溶于,回答下列问题:
(1)制备溶液:三颈烧瓶内盛放有、水和催化剂,实验开始时,打开,(处于关闭状态)加热装置A、D,使A中产生的氨气缓缓通入到三颈烧瓶中,反应至消失,反应的方程式为:。
①装置A中______(填“能”或者“不能”)直接加热固体制取氨气
②仪器B的名称是:______。
③装置C的作用是:_____。
④三颈烧瓶左侧导管口必须插入到下层的液体中,主要原因是_____(写出一条原因即可)。
(2)制备KSCN溶液:
①熄灭A处的酒精灯,关闭,移开水浴,将装置D继续加热至105℃,完全分解后(反应方程式为),打开,继续保持溶液温度为105℃,缓缓滴入适量的KOH溶液,制得KSCN溶液。反应的化学方程式为____。
②装置E可用于处理尾气,已知酸性重铬酸钾溶液能将氧化生成浅黄色沉淀。铬元素被还原为,写出其氧化的离子方程式_____。
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、______、过滤、洗涤、干燥,得到硫氰化钾晶体。
10. 二氧化碳资源化利用有助于实现“双碳目标”。在二氧化碳加氢制甲烷的反应体系中,主要反应的热化学方程式有
反应Ⅰ:CO2(g)+4H2(g)CH4(g)+2H2O(g) kJ·mol-1
反应 Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g) =+41.2 kJ·mol-1
反应Ⅲ :2CO(g)+2H2(g)CO2(g)+CH4(g) =-247.1 kJ·mol-1
起始时向恒压、密闭容器中通入1 mol CO2和4 mol H2,平衡时CH4、CO、CO2的物质的量随温度的变化如图1所示。回答下列问题:
(1)计算 CH4(g)+H2O(g) CO(g)+3H2(g)的 =___________。
(2)图1中表示n(CH4)随温度变化的曲线是___________(填图中字母),判断依据是___________。
(3)①在600℃时,已知平衡体系中n(H2)=a mol,则n(H2O)= ___________mol(用含a的代数式表示,需化简)。
②若平衡时体系的压强为p,则反应Ⅲ的平衡常数Kp=___________。(用含a、p的代数式表示,列出计算式即可,平衡分压代替平衡浓度表示,分压=总压×物质的量分数)
(4)科研人员提出CeO2催化CO2合成碳酸二甲酯(DMC)的反应过程如图2所示,由图可知 其中没有O-H键断裂的步骤是___________ (填“①”、“②'或“③”),合成DMC的总反应方程式为___________。(CH3OH不需标注同位素原子)。
(二)选考题(.请考生从给出的2道题任选一题作答,并用2B铅笔在答题卡上把所选题目题号后的方框涂黑。注意所做题目的题号必修与所涂题目的题号一致,并且在解答过程中写清每问的小题号,在答题卡指定位置答题。如果多做,则每学科按所做的第一题计分。
【化学--选修3:物质结构与性质】
11. 近年以来,全球化石能源价格一路飙升,对全球经济复苏产生巨大影响。氢能源是一种不依赖化石燃料的储量丰富的清洁能源。
(1)电解水产氢是目前较为理想的制氢技术,这项技术的广泛应用一直被高价的贵金属催化剂所制约。我国科学家开发了一种负载氧化镍纳米晶粒的聚合物氮化碳二维纳米材料,大幅提高了催化效率。
①基态 Ni原子的价电子排布式为_______,该元素在元素周期表中的位置是_______。
②C、N、O的电负性的由大到小的顺序是_______。
③为寻找更多的金属催化剂,科学家从众多金属元素中选取Co、Fe、Cu进行了相关研究,并取得了成功。选取这三种金属进行相关研究的原因可能是_______。
(2)开发新型储氢材料是氢能利用的重要研究方向。氨硼烷(NH3BH3)是一种潜在的储氢材料,可由(HB=NH)3(结构为平面六元环状)通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6NH3BH3。
①请解释CH4、H2O、CO2的键角大小顺序_______。
②(HB=NH)3中B、N原子杂化轨道类型分别为_______。
③氨硼烷(NH3BH3)中N、B都达到稳定结构,用化学键表示出(NH3BH3)分子的结构式_______。
(3)有储氢功能的铜银合金晶体具有立方堆积结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子可进到由Cu原子与Ag原子构成的全部四面体空隙中。
①该晶体储氢后的化学式为_______。
②储氢材料的储氢能力=,若晶胞参数为apm,忽略吸氢前后晶胞的体积变化,标准状况下氢气的密度为bg·cm-3,则该储氢材料的储氢能力为_______。(NA表示阿伏加德罗常数,写出表达式即可)
【化学--选修5:有机化学基础】
12. 有机合成中成环及环的元素增减是合成路线设计的关键问题之一,由 合成 路线如下:
已知:①
②
回答下列问题:
(1)A的分子式为_______;B中所含官能团名称为_______。
(2)C的结构简式为_______;E→F反应类型是_______。
(3)写出D→E的化学方程式_______。
(4)E的芳香族化合物的同分异构体中,核磁共振氢谱有四组峰且峰面积之比为9∶6∶2∶1的所有同分异构体的结构简式为_______。
(5)以 为原料合成 ,其合成路线为_______。
参考答案
一.选择题
1. A 2. A 3. D 4. D 5. D 6. D 7. B
二. 非选择题
8. (1)①. AB ②. Pr2S3+6Fe3+=6Fe2++2Pr3++3S
(2)SiO2、S
(3) ①. Fe3+、Zn2+ ②. 8Fe(OH)3+FeS23Fe3O4+2S+12H2O
(4)①. Pr3++3e-=Pr ②. PrOCl ③. 1100℃时主要发生PrOCl的氧化反应,生成PrO2
9. (1)①. 不能 ②. 球形干燥管 ③. 通过观察C中的气泡流速,控制A中产生氨气的速度 ④. 防倒吸
(2)①. NH4SCN+KOH KSCN+NH3↑+H2O ②. 3+Cr2O+8H+=3S↓+2Cr3++7H2O
(3)冷却结晶
10. (1)+205.9KJ∙mol-1
(2) ①. A ②. 反应Ⅰ和Ⅲ均为放热反应,当温度升高时,平衡均逆向移动,n(CH4)均减小
(3 ①. 3.26-a ②.
(4)①. ② ②. 2CH3OH+CO2 CH3OCOOCH3+H2O
11. (1)①. 3d84s2 ②. 第四周期第Ⅷ族 ③. O>N>C ④. 这三种元素都是过渡元素,在元素周期表中位置和Ni相近,可能具有相似的性质
(2) ①. CO2中心原子为sp杂化,键角为180度;CH4和H2O中心原子均为sp3杂化。H2O中孤对电子与成键电子对之间的斥力大于CH4中成键电子对之间的斥力,故键角:CO2>CH4>H2O ②. sp2、sp2 ③.
(3) ①. Cu3AgH8 ②.
12. (1) ①. C12H20O3 ②. 羰基、酯基
(2)①. ②. 加聚反应
(3)+H2O
(4)、
(5)
安徽省颍上县2023届高三(上)摸底检测化学试题(word版,含答案): 这是一份安徽省颍上县2023届高三(上)摸底检测化学试题(word版,含答案),共6页。试卷主要包含了5 Ti-48 Zn-65等内容,欢迎下载使用。
安徽省和县2023届高三(上)摸底检测化学试题(word版,含答案): 这是一份安徽省和县2023届高三(上)摸底检测化学试题(word版,含答案),共7页。试卷主要包含了5 Ti-48 Zn-65等内容,欢迎下载使用。
安徽省歙县2023届高三(上)摸底检测化学试题(word版,含答案): 这是一份安徽省歙县2023届高三(上)摸底检测化学试题(word版,含答案),共6页。试卷主要包含了5 Ti-48 Zn-65等内容,欢迎下载使用。












