
安徽省蚌埠市西市区2023届高三(上)摸底检测化学试题(word版,含答案)
展开安徽省蚌埠市西市区2023届高三(上)摸底检测
理科综合(化学试题)
注意事项:
1.答题前,考生务必将自己的学校、姓名、班级、准考证号填写在答题卡上相应的位置。
2.全部答案在答题卡上完成,答在本试卷上无效。
3.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案用0.5毫米及以上黑色笔迹签字笔写在答题卡上。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Al-27 S-32 Cl-35.5 Ti-48 Zn-65
第Ⅰ卷(选择题 共42分)
一、选择题(本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项符合题目要求.)
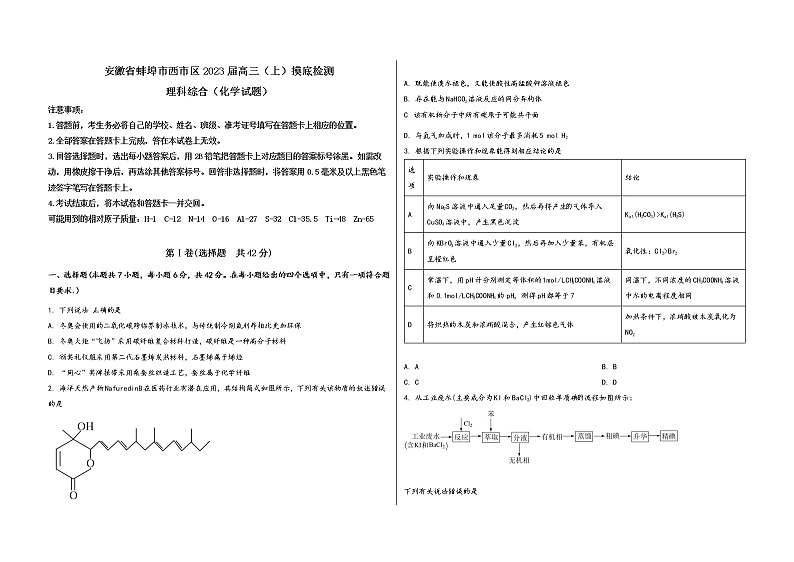
1. 下列说法 正确的是
A. 冬奥会使用的二氧化碳跨临界制冰技术,与传统制冷剂氟利昂相比更加环保
B. 冬奥火炬“飞扬”采用碳纤维复合材料打造,碳纤维是一种高分子材料
C. 颁奖礼仪服采用第二代石墨烯发热材料,石墨烯属于烯烃
D. “同心”奖牌挂带采用桑蚕丝织造工艺,蚕丝属于化学纤维
2. 海洋天然产物NafuredinB在医药行业有潜在应用,其结构简式如图所示,下列有关该物质的叙述错误的是
A. 既能使溴水褪色,又能使酸性高锰酸钾溶液褪色
B. 存在能与NaHCO3溶液反应的同分异构体
C 该有机物分子中所有碳原子可能共平面
D. 与氢气加成时,1 mol该分子最多消耗5 mol H2
3. 根据下列实验操作和现象能得到相应结论的是
选项 | 实验操作和现象 | 结论 |
A | 向Na2S溶液中通入足量CO2,然后再将产生气体导入CuSO4溶液中,产生黑色沉淀 | Ka1(H2CO3)>Ka1(H2S) |
B | 向KBrO3溶液中通入少量Cl2,然后再加入少量苯,有机层呈橙红色 | 氧化性:Cl2>Br2 |
C | 常温下,用pH计分别测定等体积的1mol/LCH3COONH4溶液和0.1mol/LCH3COONH4的pH,测得pH都等于7 | 同温下,不同浓度的CH3COONH4溶液中水的电离程度相同 |
D | 将炽热的木炭和浓硝酸混合,产生红棕色气体 | 加热条件下,浓硝酸被木炭氧化为NO2 |
A. A B. B
C. C D. D
4. 从工业废水(主要成分为KI和BaCl2)中回收单质碘流程如图所示:
下列有关说法错误的是
A. 萃取的过程中,加入苯充分振荡后,要及时打开分液漏斗的活塞放气
B. 碘的升华与加热分离NaCl和NH4Cl固体混合物的原理相同
C. 蒸馏时,温度计水银球应在蒸馏烧瓶支管口处
D. 整个过程应注意防止环境的污染
5. 研究绿色环保阻燃效率高的阻燃剂一直备受科学家的青睐,如图所示的两种化合物可应用于阻燃材料和生物材料的合成。其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,Y原子序数为W原子价电子数的3倍。下列说法正确的是
A. 原子半径:r(W)<r(Y)<r(Z)<r(X)
B. 简单气态氢化物的热稳定性:W<Y
C. 最高价氧化物对应水化物的酸性:X>Z
D. Z、W和氢三种元素可形成同时含有离子键和共价键的化合物
6. 工业上制取KIO3可采用如下两种方法:
方法1:直接歧化法:将精制I2溶于过量KOH溶液,发生的反应为3I2+6KOH=KIO3+5KI+3H2O。
方法2:电解法:将直接歧化法反应后的溶液,加入阳极区,使KI转化为KIO3(I-+6OH--6e-=+3H2O),在阴极区加入KOH溶液,电解槽用水冷却。
下列说法正确的是
A. 方法1中,氧化剂与还原剂物质的量之比为1:2
B. 当外电路转移1mole-,阴极区溶液质量减少18g
C. 电解过程中处于阴极区电极1上会有氧气生成
D. 若电流利用率为100%,理论上电解法制KIO3碘原子的利用率是直接歧化法的3倍
7. 室温下,向20.00mL0.1000mol·L-1的某一元碱MOH溶液中滴加未知浓度的稀硫酸,混合溶液的温度、酸度AG[AG=lg]随加入稀硫酸体积的变化如图所示。下列叙述正确的是
A. 室温下MOH的电离常数Kb=1.0 ×10-4
B. 当AG=0时,溶液中存在c( )>c(M+ )>c(H+ )=c(OH- )
C. b、c、d三点对应的溶液中,水的电离程度的大小关系是b=d>c
D. a点对应的溶液中c(M+ )+c(MOH)=8c( )
第Ⅱ卷(非选择题)
二、非选择题(本题包括必考题和选考题两部分,共58分。第8题~第10题为必考题,每个试题考生都必须作答,第11题~第12题为选考题,考生根据要求作答)
(一)必考题
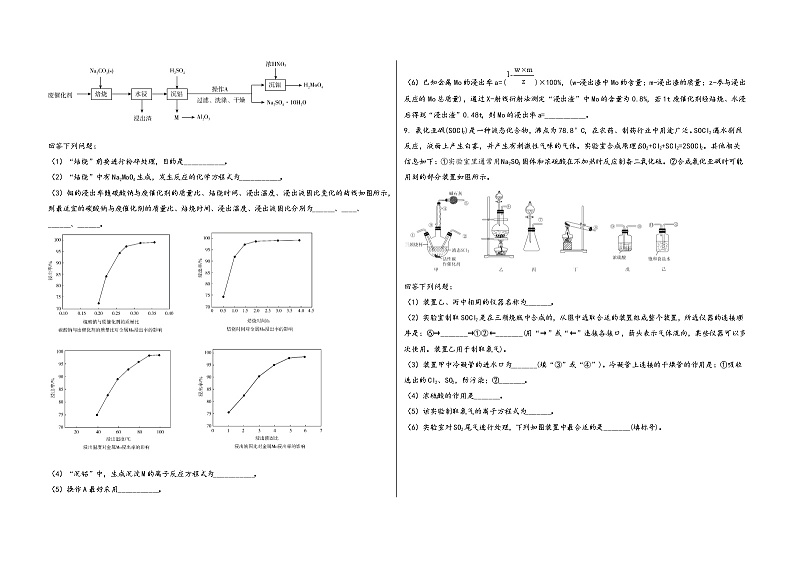
8. 某废催化剂主要含有Al2O3(45.4%)、MoO3 (28.8%)、Fe2O3(0.7%)以及其他杂质。为节约和充分利用资源,通过如下工艺流程回收钼和铝等。
回答下列问题:
(1)“焙烧”前要进行粉碎处理,目的是___________。
(2)“焙烧”中有Na2MoO4生成,发生反应的化学方程式为___________。
(3)钼的浸出率随碳酸钠与废催化剂的质量比、焙烧时间、浸出温度、浸出液固比变化的曲线如图所示,则最适宜的碳酸钠与废催化剂的质量比、焙烧时间、浸出温度、浸出液固比分别为______、____、______、______。
(4)“沉铝”中,生成沉淀M的离子反应方程式为___________。
(5)操作A最好采用___________。
(6)已知金属Mo的浸出率a=()×100%,(w-浸出渣中Mo的含量;m-浸出渣的质量;z-参与浸出反应的Mo总质量),通过X-射线衍射法测定“浸出渣”中Mo的含量为0.8%,若1t废催化剂经焙烧、水浸后得到“浸出渣”0.48t,则Mo的浸出率a=___________。
9. 氯化亚砜(SOCl2)是一种液态化合物,沸点为78.8°C,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并产生有刺激性气味的气体。实验室合成原理:SO2+Cl2+SCl2=2SOCl2。其他相关信息如下:①实验室里通常用Na2SO3固体和浓硫酸在不加热时反应制备二氧化硫。②合成氯化亚砜时可能用到的部分装置如图所示。
回答下列问题:
(1)装置乙、丙中相同的仪器名称为_______。
(2)实验室制取SOCl2是在三颈烧瓶中合成的,从图中选取合适的装置组成整个装置,所选仪器的连接顺序是:⑥→_______→①②←_______(用“→”或“←”连接各接口,箭头表示气体流向,某些仪器可以多次使用。装置乙用于制取氯气)。
(3)装置甲中冷凝管的进水口为_______(填“③”或“④”)。冷凝管上连接的干燥管的作用是:①吸收逸出的Cl2、SO2,防污染;②_______。
(4)浓硫酸的作用是_______。
(5)该实验制取氯气的离子方程式为_______。
(6)实验室对SO2尾气进行处理,下列如图装置中最合适的是_______(填标号)。
(7)已知SCl2的沸点为60°C。实验结束后,将三颈烧瓶中液体混合物分离开的实验操作名称是_______。若反应中消耗的Cl2的体积为896mL(已转化为标准状况,SO2足量),最后得到纯净的SOCl27.12g,则SOCl2的产率为_______(保留两位有效数字)。
10. 碳中和目标背景下,我国加快低碳技术的发展和应用推广,其中二氧化碳碳捕集、利用与封存技术已经成为近期化学研究的热点,回答下列问题:
(1)已知常温常压下下列反应的能量变化如图所示:
写出由二氧化碳和氢气制备甲醇的热化学方程式:_______。
(2)CO2催化加氢制取甲醇,反应如下:
主反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ∆H1=-49.5kJ·mol-1
副反应:CO2(g)+H2(g)CO(g)+H2O(g) △H2=+41.2kJ·mol-1
①在一定条件下,向某1L恒容密闭容器中充入1molCO2和amolH2发生主反应。图中能表示该反应的平衡常数K与温度T之间的变化关系的是曲线_______(填“m”或“n”),判断依据是_______。
②副反应的反应速率v=v正-v逆=k正c(CO2)·c(H2)k逆cm(CO)·cn(H2O),其中k正、k逆分别为正、逆反应速率常数。该反应的平衡常数K=,则m=_______,升高温度时k正-k逆_______(填“增大”减小”或“不变”)。
③在一定温度下,①中的起始总压强为21.2MPa。实验测得CO2的平衡转化率和平衡时CH3OH的选择性随温度变化如图所示:
已知:CH3OH的选择性=×100%。图中表示平衡时CH3OH的选择性的曲线为_______(填“X”或“Y”),温度高于280°C时,曲线Y随温度升高而升高的原因是_______。240°C时,反应20min容器内达平衡状态,副反应的K,初始充入H2的物质的量a=_______mol,主反应的平衡常数Kp=_______(MPa)-2(①用平衡分压代替平衡浓度,分压=总压×物质的量分数;②计算结果保留1位小数)。
(二)选考题(.请考生从给出的2道题任选一题作答,并用2B铅笔在答题卡上把所选题目题号后的方框涂黑。注意所做题目的题号必修与所涂题目的题号一致,并且在解答过程中写清每问的小题号,在答题卡指定位置答题。如果多做,则每学科按所做的第一题计分。
【化学--选修3:物质结构与性质】
11. 我国科学家构建了新型催化剂“纳米片”(Co—N—C),该“纳米片“可用于氧化SO和吸附Hg2+。回答下列问题:
(1)基态Co原子的价层电子排布式为____,N、C、Co中第一电离能最大的是____(填元素符号)。
(2)在空气中SO会被氧化成SO。SO的空间构型是____,SO中S原子采用_____杂化。
(3)[Co(NH3)4(H2O)Cl]Cl2是钴的一种配合物,含1mol[Co(NH3)4(H2O)Cl]Cl2的溶液与足量AgNO3溶液能生成____molAgCl,[Co(NH3)4(H2O)Cl]Cl2中Co2+的配位数为____。
(4)氰气[(CN)2]称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则(CN)2分子中σ键、π键个数之比为____。
(5)氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如图1所示。它的化学式为____,它的硬度超过金刚石的主要原因是____。
(6)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(,,),则原子3的原子分数坐标为____。若氮化馆的晶体密度为ρg·cm-3,则晶胞中Ga-N键的键长为____(用含ρ、NA的代数式表示)pm。已知NA为阿伏加德罗常数的值。
图2
【化学--选修5:有机化学基础】
12. M是合成某药物的中间体,以A为原料合成M的路线如下(部分条件和产物省略):
已知:RCHO
请回答下列问题:
(1)芳香化合物A的化学名称为___________,M中所含的含氧官能团除羟基外,还有___________。
(2)B有多种同分异构体,其中能同时满足下列条件的芳香族化合物的结构简式为___________。
①能发生水解反应,但不能发生银镜反应
②核磁共振氢谱有4组峰,且峰面积比为1:2:2:3
(3)试剂R的结构简式为___________,由D生成E的化学方程式为___________。
(4)由A生成B的多步反应中,存在反应,结合合成路线中的相关反应,说明设计该反应的目的为___________。
(5)参照上述流程,写出以乙醇为原料合成2-丁醇的路线:(其他试剂自选) ___________。
参考答案
一.选择题
1. A 2. C 3. A 4. B 5. D 6. B 7. D
二. 非选择题
8. (1)增大接触面积,提高浸取率
(2)Na2CO3 + MoO3=Na2MoO4+ CO2↑
(3) ①. 0.28(0.25~0.3均正确) ②. 1.5h ③. 90°C (85~90°C均正确) ④. 5:1
(4)+H++H2O=Al(OH)3↓
(5)蒸发浓缩,冷却结晶
(6)98%
9. (1)分液漏斗
(2)① ⑫→⑪→⑨→⑩ ②. ⑩←⑨←⑦
(3)①. ③ ②. 防止水蒸气进入装置与SOCl2反应
(4)干燥产生的氯气和二氧化硫
(5)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
(6)③
(7)①. 蒸馏 ②. 75%
10. (1)CO2(g)+3H2(g)CH3OH(g)+H2O(l) ∆H=-50kJ·mol-1
(2)①. m ②. 主反应焓变小于零,为放热反应,温度升高平衡逆向移动,平衡常数减小 ③. 1 ④. 增大 ⑤. X ⑥. 温度高于280°C时,以副反应为主,副反应为吸热反应,平衡正向移动,二氧化碳转化率升高 ⑦. 1.12 ⑧. 4.2
11. (1)①. 3d74s2 ②. N
(2)①. 三角锥形 ②. sp3
(3)①. 2 ②. 6
(4)3:4
(5) ①. C3N4 ②. 氮化碳和金刚石都是原子(共价)晶体,N的原子半径小于C,氮碳键的键能大于碳碳键
(6) ①. (,,) ②. ××1010
12. (1)①. 甲苯 ②. 羰基、醚键
(2)、
(3) ①. ②. 2+O22+2H2O
(4)保护酚羟基,防止在酚羟基反应过程中被氧化
(5)
安徽省合肥市西市区2023届高三(上)摸底检测化学试题(word版,含答案): 这是一份安徽省合肥市西市区2023届高三(上)摸底检测化学试题(word版,含答案),共6页。试卷主要包含了5 Ti-48 Zn-65, 2+O22+2H2O等内容,欢迎下载使用。
安徽省黟县2023届高三(上)摸底检测化学试题(word版,含答案): 这是一份安徽省黟县2023届高三(上)摸底检测化学试题(word版,含答案),共6页。试卷主要包含了5 Ti-48 Zn-65等内容,欢迎下载使用。
安徽省歙县2023届高三(上)摸底检测化学试题(word版,含答案): 这是一份安徽省歙县2023届高三(上)摸底检测化学试题(word版,含答案),共6页。试卷主要包含了5 Ti-48 Zn-65等内容,欢迎下载使用。












