

安徽省合肥市西市区2023届高三(上)摸底检测化学试题(word版,含答案)
展开安徽省合肥市西市区2023届高三(上)摸底检测
理科综合(化学试题)
注意事项:
1.答题前,考生务必将自己的学校、姓名、班级、准考证号填写在答题卡上相应的位置。
2.全部答案在答题卡上完成,答在本试卷上无效。
3.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案用0.5毫米及以上黑色笔迹签字笔写在答题卡上。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Al-27 S-32 Cl-35.5 Ti-48 Zn-65
第Ⅰ卷(选择题 共42分)
一、选择题(本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项符合题目要求.)
1. 下列说法 正确的是
A. 冬奥会使用的二氧化碳跨临界制冰技术,与传统制冷剂氟利昂相比更加环保
B. 冬奥火炬“飞扬”采用碳纤维复合材料打造,碳纤维是一种高分子材料
C. 颁奖礼仪服采用第二代石墨烯发热材料,石墨烯属于烯烃
D. “同心”奖牌挂带采用桑蚕丝织造工艺,蚕丝属于化学纤维
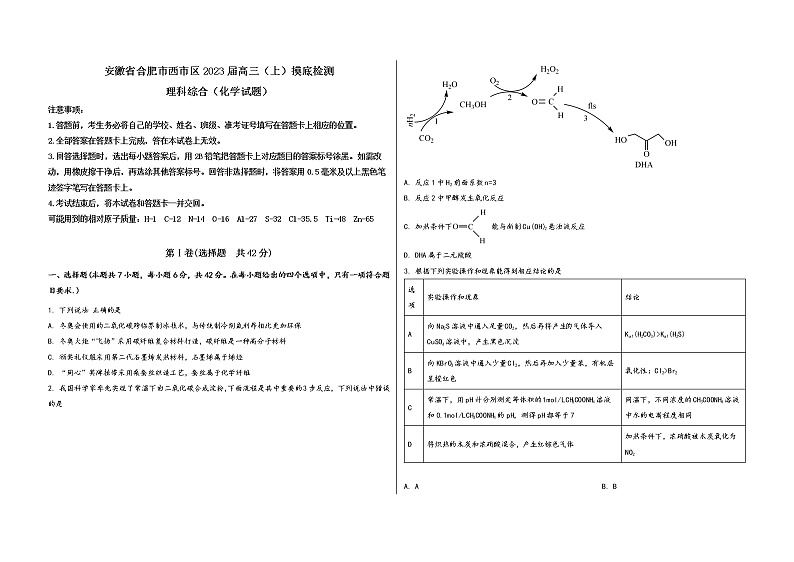
2. 我国科学家率先实现了常温下由二氧化碳合成淀粉,下面流程是其中重要的3步反应,下列说法中错误的是
A. 反应1中H2前面系数n=3
B. 反应2中甲醇发生氧化反应
C. 加热条件下 能与新制Cu(OH)2悬浊液反应
D. DHA属于二元羧酸
3. 根据下列实验操作和现象能得到相应结论的是
选项 | 实验操作和现象 | 结论 |
A | 向Na2S溶液中通入足量CO2,然后再将产生气体导入CuSO4溶液中,产生黑色沉淀 | Ka1(H2CO3)>Ka1(H2S) |
B | 向KBrO3溶液中通入少量Cl2,然后再加入少量苯,有机层呈橙红色 | 氧化性:Cl2>Br2 |
C | 常温下,用pH计分别测定等体积的1mol/LCH3COONH4溶液和0.1mol/LCH3COONH4的pH,测得pH都等于7 | 同温下,不同浓度的CH3COONH4溶液中水的电离程度相同 |
D | 将炽热的木炭和浓硝酸混合,产生红棕色气体 | 加热条件下,浓硝酸被木炭氧化为NO2 |
A. A B. B
C. C D. D
4. 设为阿伏加德罗常数的值。下列说法正确的是
A. 工业上电解制备时,产生气体的分子数为3
B. 三硫化四磷(,如图所示)中含有的极性键的数目为6
C. 标准状况下,22.4L氯气与足量烧碱溶液反应,转移的电子数为2
D. 与足量乙醇在一定条件下反应,生成的酯基的数目为2
5. 下图为某物质的结构。已知:W、Y、Z属于不同周期、不同主族的短周期元素,W、Y、Z原子最外层电子数之和等于X原子最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述错误的是
A. Y元素在周期表中的位置为第二周期IVA族
B. W、X对应的简单离子半径:X>W
C. 该物质具有强氧化性,可以用作漂白剂
D. 该物质中,Y、X原子的最外层均满足8电子结构
6. 工业上制取KIO3可采用如下两种方法:
方法1:直接歧化法:将精制I2溶于过量KOH溶液,发生的反应为3I2+6KOH=KIO3+5KI+3H2O。
方法2:电解法:将直接歧化法反应后的溶液,加入阳极区,使KI转化为KIO3(I-+6OH--6e-=+3H2O),在阴极区加入KOH溶液,电解槽用水冷却。
下列说法正确的是
A. 方法1中,氧化剂与还原剂物质的量之比为1:2
B. 当外电路转移1mole-,阴极区溶液质量减少18g
C. 电解过程中处于阴极区电极1上会有氧气生成
D. 若电流利用率为100%,理论上电解法制KIO3碘原子的利用率是直接歧化法的3倍
7. 室温下,用mmol/L的二甲胺[(CH3)2NH]溶液(二甲胺在水中的电离与一水合氨相似)滴定10.00mL0.1mol/L的盐酸溶液。溶液pH随加入二甲胺溶液体积变化曲线如图所示(忽略溶液混合时的体积变化)。下列说法正确的是
A. 本实验应该选择酚酞作指示剂
B. 室温下,
C. a点溶液中水的电离程度最大
D. b点溶液中存在:c[(CH3)2NH]>c(OH-)>c(Cl-)>c(H+)
第Ⅱ卷(非选择题)
二、非选择题(本题包括必考题和选考题两部分,共58分。第8题~第10题为必考题,每个试题考生都必须作答,第11题~第12题为选考题,考生根据要求作答)
(一)必考题
8. 无水氯化镨(PrCl3)是制取稀土金属镨及镨合金的主要原料,采用以下工艺流程可由孪生矿(主要含ZnS、FeS、Pr2S3、SiO2等)制备氯化镨晶体(PrCl3·6H2O)。
已知:①2FeCl3+ZnS=ZnCl2+2FeCl2+S;2FeCl3+FeS=3FeCl2+S
②该条件下,溶液中部分金属离子生成氢氧化物开始沉淀和完全沉淀时的pH如下表所示:
金属离子 | Zn2+ | Fe3+ | Fe2+ |
开始沉淀时的pH | 5.4 | 2.2 | 7.5 |
沉淀完全时的pH | 6.4 | 3.2 | 9.0 |
回答下列问题:
(1)①若其他条件不变,采取下列措施能提高镨元素浸出率的有_________(填字母)。
A.适当升高溶浸温度B.适当加快搅拌速率C.适当缩短溶浸时间
②写出“溶浸”时Pr2S3发生反应的离子方程式:_________。
(2)“滤渣1”主要成分是_________。
(3)在“沉淀”时加入氨水逐步调节溶液的pH至6.5,依次析出的金属离子是_________;已知Fe(OH)3在隔绝空气的条件下与FeS2混合焙烧时生成Fe3O4和S,写出该反应的化学方程式:_________。
(4)①利用电解法可以生产金属镨。先将氯化镨与工业纯KCl配成二元电解质体系(PrCl3-KCl);然后置于石墨电解槽内熔化,通入直流电进行电解。电解过程中得到金属镨的电极反应式为_________。
②科学家以氯化镨气溶胶为前驱体,研究了PrCl3·6H2O的高温热解机制。利用X射线衍射技术分析,其结果如下表所示:
热解温度/℃ | 氯化镨气溶胶的热解产物 |
600 | Pr(OH)2Cl和PrOCl |
700~1000 | Pr(OH)2Cl、PrOCl和PrO2 |
1100 | PrO2和Pr(OH)2Cl |
以上热解产物中,热稳定性最差的是_________(填化学式)。氯化镨的高温热解过程主要是发生PrCl3的水解反应、Pr(OH)2Cl的脱水反应和PrOCl的氧化反应,从表中数据分析1100℃时热解产物主要为PrO2而无PrOCl的原因是_________。
9. 碱式氯化铜[Cux(OH)yClz]是重要的无机杀菌剂,是一种墨绿色结晶性粉末,难溶于水,溶于稀盐酸和氨水,在空气中十分稳定。
Ⅰ.模拟制备碱式氯化铜。
向CuCl2溶液中通入NH3和稀盐酸调节pH至5.0~5.5,控制反应温度为70~80℃,实验装置如图所示(部分夹持装置已省略)。
(1)盛装稀盐酸的仪器名称是_______,仪器 X的主要作用有导气、_______。
(2)利用装置A制NH3 ,发生反应的化学方程式为_______。
(3)若滴入稀盐酸过量会导致碱式氯化铜的产量_______(填“偏高”“偏低”或“无影响”)。
(4)反应结束后,将三颈烧瓶中的混合物过滤,滤渣经提纯得产品无水碱式氯化铜;从滤液中还可以获得的一种副产品,该副产品的用途是_______ (写 出一种即可)。
Ⅱ.无水碱式氯化铜组成的测定。称取产品4.290 g,加硝酸溶解,并加水定容至200. 00 mL,得到待测液。
(5)铜的测定:取20. 00 mL待测液,经测定Cu2+浓度为0. 2000 mol·L-1.则称取的样品中n(Cu2+ )=_______mol。
(6)采用沉淀滴定法测定氯:取20. 00 mL待测液于锥形瓶中,加入30. 00 mL 0.1000 mol·L-1AgNO3溶液(过量) ,使Cl-完全转化为AgCl沉淀。用0.1000 mol· L-1 NH4SCN标准溶液滴定过量的AgNO3(已知:AgSCN是种难溶于水的白色固体)。
①滴定时,下列物质中可选作指示剂的是_______(填标号)。
a. FeSO4 b. Fe(NO3)3 c. FeCl3 d. KI
②重复实验操作三次,消耗NH4SCN溶液的体积平均为10. 00 mL。则称取的样品中n(Cl- )=_______mol。
(7)根据上述实验结果可推知无水碱式氯化铜的化学式为_______。
10. 当今世界多国相继规划了碳达峰、碳中和的时间节点,中国承诺2030年前,二氧化碳的排放不再增长,达到峰值之后逐步降低。2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。因此,降低空气中二氧化碳含量成为研究热点,其中研发二氧化碳的利用技术,将二氧化碳转化为能源是缓解环境和解决能源问题的方案之一。
I.二氧化碳在一定条件下转化为甲烷,其反应过程如下图所示。
已知:CO2(g)+4H2(g)CH4(g)+2H2O(g)△H1=-205kJ·mol-1
反应II:CO(g)+3H2(g)CH4(g)+H2O(g)△H2=-246kJ·mol-1
(1)则反应I的热化学方程式为_______。
(2)一定条件下,向2L恒容密闭容器中加入1mo1CO2和5molH2,只发生上述反应I和反应II;10min后容器内总压强(P)不再变化,容器中CH4为0.6mol,CO2为0.2mol,H2O为1.4mol,10min内H2的平均反应速率v(H2)=_______反应II的平衡常数Kp=_______(用含字母P的代数式表示,已知Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替,某气体分压=气体总压强×该气体的物质的量分数)
II.在催化剂作用下CO2加氢还可制得甲醇CO2(g)+3H2(g)CH3OH(g)+H2O(g)∆H=50kJ/mol。
(3)能说明反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=50kJ/mol已达平衡状态的是_______(填字母)。
A. 单位时间内生成1molCH3OH(g)的同时消耗了3molH2(g)
B. 在恒温恒容的容器中,混合气体的密度保持不变
C. 在绝热恒容的容器中,反应的平衡常数不再变化
D. 在恒温恒压的容器中,气体的平均摩尔质量不再变化
III.CO2与H2催化重整制备CH3OCH3的过程中存在反应:
①2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)△H<0;
②CO2(g)+H2(g)CO(g)+H2O(g)△H>0。
(4)向密闭容器中以物质的量之比为1:3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图所示。P1、P2、P3由大到小的顺序为_______;T2°C时主要发生反应_______。(填“①”或“②”),CO2平衡转化率随温度变化先降后升的原因为_______。
(二)选考题(.请考生从给出的2道题任选一题作答,并用2B铅笔在答题卡上把所选题目题号后的方框涂黑。注意所做题目的题号必修与所涂题目的题号一致,并且在解答过程中写清每问的小题号,在答题卡指定位置答题。如果多做,则每学科按所做的第一题计分。
【化学--选修3:物质结构与性质】
11. 中国传统绘画颜料迄今已有七千多年的历史。古代艺术作品色彩艳丽,璀璨夺目,与所使用矿物颜料有很大关系。回答下列问题:
(1)石青,又名蓝矿石,化学式为Cu3(CO3)2(OH)2,基态Cu2+核外电子的空间运动状态有_______种。原子轨道中电子有两种相反的自旋状态,分别用+ 和-表示,称为电子的自旋磁量子数,则Cu2+中电子自旋磁量子数的代数和为_______。中C原子的杂化方式为_______。
(2)亚铁氰化钾,化学式为K4[Fe(CN)6],呈黄色结晶性粉末。[Fe(CN)6]4-中配体CN-的配位原子是_______(填元素符号),[Fe(CN)6]4-中。σ键和π键的数目之比为_______。
(3)宜德时期青花瓷使用的颜料“苏勃泥青”是从一种钴矿[主要成分为(FeCo)x AsS]中提取出来的。无水CoCl2的熔点是735℃ ,沸点1049℃ ,CoCl2属于_______晶体;砷酸根离子( )的空间构型为_______。
(4)ZnS可用于制白色颜料等。ZnS的晶胞如图所示。
①图中S2-的坐标有(0,0,0)、(0,,),与(0,0,0)距离最近的S2-还有_______(填坐标)。
②Zn2+占据_______ (填“八面体”或“四面体”)空隙,空隙利用率为_______%。
③ZnS的密度为_______g·cm-3(设NA为阿伏加德罗常数的值)。
【化学--选修5:有机化学基础】
12. 某芳香烃A是有机合成中重要的原料,由A制取高聚物M的流程如下:
回答下列问题:
(1)A的结构简式为___________。
(2)反应②的条件为___________。
(3)D中含有的官能团的名称为___________。
(4)反应⑤的反应类型为___________。
(5)写出反应③的化学方程式___________。
(6)K与C互为同分异构体,满足下列两个条件的K有___________种(不考虑立体异构)。
①苯环上连有三个取代基
②1molK最多可消耗2 molNaOH
其中核磁共振氢谱显示为6组峰,且峰面积比为1:2:2:2:2:3同分异构体的结构简式为___________(写一种)。
参考答案
一.选择题
1. A 2. D 3. A 4. B 5. A 6. B 7. B
二. 非选择题
8. (1)①. AB ②. Pr2S3+6Fe3+=6Fe2++2Pr3++3S
(2)SiO2、S
(3) ①. Fe3+、Zn2+ ②. 8Fe(OH)3+FeS23Fe3O4+2S+12H2O
(4)①. Pr3++3e-=Pr ②. PrOCl ③. 1100℃时主要发生PrOCl的氧化反应,生成PrO2
9. (1)①. 分液漏斗 ②. 防止倒吸
(2)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(3)偏低
(4)作肥料
(5)0.04 (6) ①. b ②. 0.02
(7)Cu2(OH)3Cl
10. (1)CO2(g)+H2(g)CO(g)+H2O(g)△H1=+41kJ·mol-1
(2)①. 0.13mol·L-1·min-1 ②. 7/p2
(3)CD
(4)①. P1>P2>P3 ②. ② ③. 开始升温以反应①为主,反应放热,平衡逆向移动,CO2平衡转化率下降,升高一定温度后,以反应②为主,反应吸热平衡正向移动,CO2平衡转化率上升
11. (1) ①. 14 ②. +或- ③. sp2
(2)①. C ②. 1:1
(3)①. 离子 ②. 正四面体形
(4)①. (,0,)和(,,0) ②. 四面体 ③. 50 ④.
12. (1). (2). 氢氧化钠溶液、加热 (3). 醛基、羟基 (4). 消去反应
(5). 2+O22+2H2O
(6). 12 或
安徽省合肥市东市区2023届高三(上)摸底检测化学试题(word版,含答案): 这是一份安徽省合肥市东市区2023届高三(上)摸底检测化学试题(word版,含答案),共6页。试卷主要包含了5 Ti-48 Zn-65,5%左右,其成分中含有蛋白质,5NA等内容,欢迎下载使用。
安徽省和县2023届高三(上)摸底检测化学试题(word版,含答案): 这是一份安徽省和县2023届高三(上)摸底检测化学试题(word版,含答案),共7页。试卷主要包含了5 Ti-48 Zn-65等内容,欢迎下载使用。
安徽省合肥市郊区2023届高三(上)摸底检测化学试题(word版,含答案): 这是一份安徽省合肥市郊区2023届高三(上)摸底检测化学试题(word版,含答案),共7页。试卷主要包含了5 Ti-48 Zn-65, 实验测得0,62,10ml/L, 苯硫酚是一种局部麻醉剂等内容,欢迎下载使用。












