
















































2023版 创新设计 高考总复习 化学 鲁科版第1章 认识化学科学
展开1.基本概念及相互关系
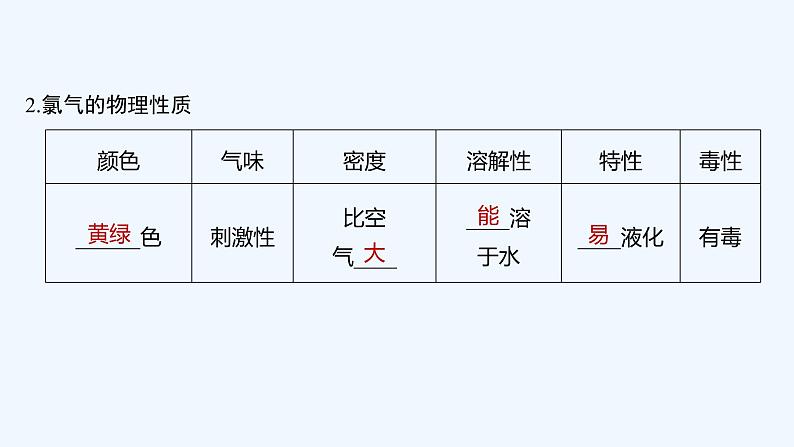
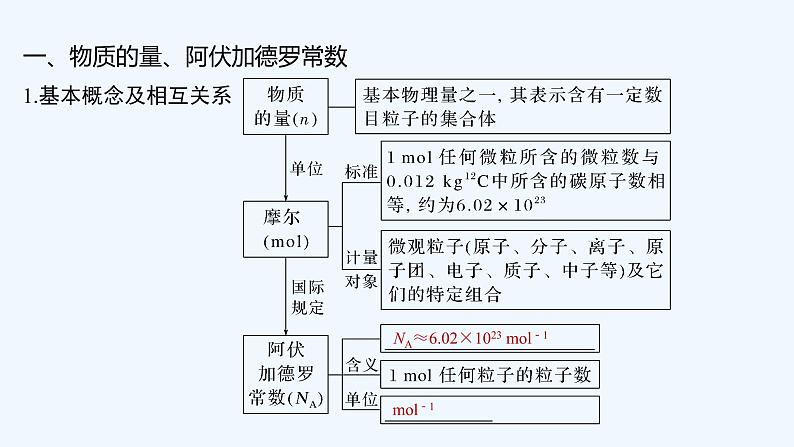
一、物质的量、阿伏加德罗常数
NA≈6.02×1023 ml-1
2.物质的量的规范表示方法
如:1 ml H、0.5 ml O2、0.01 ml Na+。
3.物质的量与微粒数、阿伏加德罗常数之间的关系
n=______或N=________或NA= ______ 。
【判一判】 判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)摩尔是描述微观粒子多少的物理量( )(2)阿伏加德罗常数就是6.02×1023( )(3)1 ml 水中含有2 ml 氢和1 ml 氧( )(4)1 ml 任何物质都含有约6.02×1023个原子( )(5)等物质的量的O2与O3,所含氧原子数相同( )答案 (1)× (2)× (3)× (4)× (5)×
2.物质的量(n)、质量(m)、摩尔质量(M)之间的关系
n=______或m=_______或M= ______ 。
(1)硫酸的摩尔质量为98 g ( )(2)1 ml OH-的质量是17 g·ml-1( )(3)2 ml H2O的摩尔质量是1 ml H2O摩尔质量的2倍( )(4)1 ml O2的质量与它的相对分子质量相同( )(5)22 g CO2中含有的氧原子为1 ml( )答案 (1)× (2)× (3)× (4)× (5)√
三、气体摩尔体积1.影响物质体积的因素
L/ml(或L·ml-1)
22.4 L·ml-1
3.物质的量(n)与气体体积(V)、气体摩尔体积(Vm)之间的关系
n=______或V=________或Vm= ______ 。
(1)在标准状况下,1 ml O2与1 ml SO3的体积相同( )(2)在标准状况下,1 ml 气体的体积约是22.4 L,在非标准状况下,1 ml气体的体积则一定不是22.4 L( )(3)22.4 L气体在标准状况下是1 ml,在非标准状况下一定不是1 ml( )(4)在相同条件下,相同物质的量的CO、N2的混合气体与O2的分子个数相同,所包含的原子个数也相同( )答案 (1)× (2)× (3)× (4) √
四、阿伏加德罗定律及其推论1.阿伏加德罗定律
在相同的温度和压强下,相同______的任何______都含有相同数目的______。
2.阿伏加德罗定律的推论
(1)阿伏加德罗定律不仅适用于单一气体,也适用于不反应的混合气体,但不适用于非气体。(2)阿伏加德罗定律及其推论可由理想气体状态方程pV=nRT进行推导。
(1)在标准状况下,相同体积的H2O和O2具有相同数目的分子 ( )(2)同温同压下,等质量的CO和N2体积相同( )(3)同温、同压、同体积的CO2和H2S含有的原子数相等( )(4)同温同体积的条件下,等质量的SO2和O2的压强比为2∶1( )(5)不同温度下,相同体积、相同密度的CO和N2的分子数目不同( )答案 (1)× (2)√ (3)√ (4)× (5)×
考点二 气体摩尔体积和阿伏加德罗定律的应用
考点一 物质的量、摩尔质量的有关计算
【典例1】 根据相关量的关系,完成下列填空:
(1)有以下三种物质:①0.5 ml 二氧化碳 ②8 g 氢气 ③1.204×1024个氮气分子,它们所含分子数最多的是____________,所含原子数最多的是____________,质量最大的是____________(填序号)。(2)12.4 g Na2R含Na+ 0.4 ml,则Na2R的摩尔质量为____________,R的相对原子质量为____________,含R的质量为1.6 g 的Na2R,其物质的量为____________。答案 (1)② ② ③ (2)62 g·ml-1 16 0.1 ml
与物质的量有关计算的注意点❶以物质的量为中心,应用公式将其他量转化为物质的量进行计算;❷题目中要求“什么量”,就找“什么公式”,如题目要求质量就找m=n·M。
题组一 物质的量、摩尔质量的判断与计算1.屠呦呦因发现治疗疟疾的青蒿素和双氢青蒿素(结构如图)获得诺贝尔生理学或医学奖。
双氢青蒿素的分子式为C15H24O5,相对分子质量为284。下列关于青蒿素和双氢青蒿素的说法正确的是( )A.1 ml 青蒿素的质量为282 g·ml-1B.双氢青蒿素的摩尔质量等于284C.14.1 g 青蒿素中含有的原子总数为2.2NAD.含有6.02×1023个双氢青蒿素分子的集合体称为1 ml
2.0.5 ml Na2SO4中含有的离子的个数和氧原子的质量分别是( )
2 ml 32 g ×1023 4 ml D.NA 64 g
题组二 物质的量与指定粒子数目的关系3.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.2.3 g 钠由原子变成离子时,失去的电子数为个硫酸分子与19.6 g 磷酸含有相同的氧原子数C.28 g 氮气所含的原子数为NAD.NA个氧分子与NA个氢分子的质量比为8∶1
❶以物质的量为中心计算的思维流程❷计算物质中所含指定微粒数目的方法弄清楚微粒与所给物质的关系:原子(电子)的物质的量=分子(或特定组合)物质的量×1个分子(或特定组合)中所含这种原子(电子)个数。
【典例2】 (2021·衡水模拟)下列说法不正确的是( )
A.温度相同、体积相同的O2(g)和N2(g)分子数相同B.等温等压下,SO2气体与CO2气体的密度之比等于16∶11C.温度和容积相同的两气罐中分别盛有5 ml O2(g)和2 ml N2(g),两容器中的压强之比等于5∶2D.等温等压条件下, 5 ml O2(g)和2 ml H2(g)的体积之比等于5∶2
解析 A项压强没有确定,错误;B项等温等压下,SO2气体与CO2气体的密度之比等于其相对分子质量之比为64∶44=16∶11,正确;C项温度和容积相同的两气罐中的压强之比等于其物质的量之比,即5∶2,正确;D项等温等压条件下,两气体的体积之比等于其物质的量之比,即5∶2,正确。
有关阿伏加德罗定律及其推论题的分析思路
题组一 与气体摩尔体积有关的计算1.下列关于阿伏加德罗常数和气体摩尔体积等的说法正确的是( )
A.1 ml O2和1 ml N2所占的体积都约为22.4 LB.H2的气体摩尔体积约为22.4 LC.在标准状况下,1 ml H2和1 ml H2O所占的体积都约为22.4 LD.标准状况下,22.4 L乙烷、丙烷的混合气体,所含的分子数为NA
解析 没有明确温度和压强,无法确定气体的体积,A错误;气体摩尔体积的单位不是“L”,而是“L·ml-1”或“m3·ml-1”,另外未指明气体所处温度和压强,H2的气体摩尔体积不一定为22.4 L·ml-1,B错误;在标准状况下,水为液态,C错误。
题组二 阿伏加德罗定律的应用2.同温同压下,a g甲气体和2a g乙气体所占的体积之比为1∶2,根据阿伏加德罗定律判断,下列叙述不正确的是( )
A.同温同压下甲和乙的密度之比为1∶1B.甲与乙的相对分子质量之比为1∶1C.同温同体积下等质量的甲和乙的压强之比为1∶1D.等质量的甲和乙中的原子数之比为1∶1
题组三 摩尔质量的计算3.在一定条件下,m g NH4HCO3完全分解生成NH3、CO2、H2O(g),按要求填空。
(1)若所得混合气体对H2的相对密度为d,则混合气体的物质的量为___________。NH4HCO3的摩尔质量为__________(用含m、d的代数式表示)。(2)若所得混合气体的密度折合成标准状况为ρ g·L-1,则混合气体的平均摩尔质量为____________(用含ρ的代数式表示)。(3)若在该条件下,所得NH3、CO2、H2O(g)的体积分数分别为a%、b%、c%,则混合气体的平均相对分子质量为____________(用含a、b、c的代数式表示)。
微专题2 包罗万象的阿伏加德罗常数
一、 “22.4 L·ml-1”的使用条件
(1)(2021·广东卷)11.2 L NO与11.2 L O2混合后的分子数目为NA( )(2)(2021·河北卷)22.4 L(标准状况)氟气所含的质子数为18NA( )(3)(2020·全国卷Ⅲ)22.4 L(标准状况)氮气中含有7NA个中子( )答案 (1)× (2)√ (3)×
抓住“三看”,破解关键
二、特殊物质的组成和结构
答案 (1)× (2)√ (3)√
三、电解质溶液中的离子
答案 (1)× (2)× (3)√ (4)×
解答此类试题要特别注意出题者从弱电解质(包括溶剂水)的不完全电离、盐类水解程度、是否指明溶液体积等方面设置的陷阱。
四、特殊反应或隐含反应
(1)(2021·湖南卷)2 ml NO与1 ml O2在密闭容器中充分反应后的分子数为2NA( )(2)(2021·湖南卷)11.2 L CH4和22.4 L Cl2(均为标准状况)在光照下充分反应后的分子数为1.5NA( )(3)(2018·全国卷Ⅱ)密闭容器中,2 ml SO2和1 ml O2催化反应后分子总数为2NA( )答案 (1)× (2)√ (3)×
常见的特殊反应、隐含反应❶NO与O2反应生成NO2,NO2又部分转化成N2O4。❷常见可逆反应如N2与H2、SO2与O2、Cl2与H2O、H2与I2、酯化反应和酯类的酸性水解反应等。❸浓度变化导致的化学反应的变化:①MnO2与浓盐酸、Cu与浓硫酸的反应,随着反应的进行,浓酸变稀酸反应停止。
②Cu与浓硝酸反应,随着反应的进行,浓硝酸变稀硝酸,得到NO2和NO的混合气体;Zn与浓硫酸反应,随着反应的进行,浓硫酸变稀硫酸,得到SO2和H2的混合气体。③常温下,铁、铝遇浓硝酸、浓硫酸发生“钝化”。❹金属精炼时阳极杂质的反应。
五、氧化还原反应中的电子转移
(1)(2021·全国甲卷)3 ml 的NO2与H2O完全反应时转移的电子数为4NA( )(2)(2021·河北卷)电解饱和食盐水时,若阴阳两极产生气体的总质量为73 g,则转移电子数为NA( )(3)(2019·全国卷Ⅱ)1 ml K2Cr2O7被还原为Cr3+转移的电子数为6NA( )答案 (1)× (2)× (3)√
1.(2020·全国卷Ⅲ)NA是阿伏加德罗常数的值。下列说法正确的是( )
A.22.4 L(标准状况)氮气中含有7NA个中子B.1 ml重水比1 ml水多NA个质子C.12 g石墨烯和12 g金刚石均含有NA个碳原子D.1 L 1 ml·L-1 NaCl溶液含有28NA个电子解析 22.4 L(标准状况)氮气为1 ml,含有的中子数为14NA,A项错误;1 ml重水与1 ml水中的质子数相同,B项错误;石墨烯与金刚石均为碳元素形成的单质,12 g石墨烯和12 g金刚石含碳原子数均为NA,C项正确;NaCl溶液中的水分子中也含有电子,D项错误。
2.(2018·全国卷Ⅰ)NA是阿伏加德罗常数的值。下列说法正确的是( )
g FeCl3水解形成的Fe(OH)3胶体粒子数为 L(标准状况)氩气含有的质子数为18NAC.92.0 g甘油(丙三醇)中含有羟基数为 ml CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
解析 16.25 g FeCl3的物质的量n(FeCl3)=0.1 ml,如果氯化铁完全水解,则生成0.1 ml Fe(OH)3,而氢氧化铁胶体粒子由许多氢氧化铁聚集而成,故氢氧化铁胶体粒子数远小于0.1NA,A项错误;氩气是单原子分子,1 ml Ar含18 ml质子,B项正确;甘油(丙三醇)的分子式为C3H8O3,相对分子质量为92,1 ml(92.0 g)甘油含3 ml羟基,C项错误;甲烷与氯气在光照下反应会生成四种有机产物,即1.0 ml甲烷反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4共为1 ml,D项错误。
3.(2021·浙江6月选考)设NA为阿伏加德罗常数的值,下列说法不正确的是( )
4.(2021·广东卷)设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1 ml CHCl3含有C—Cl键的数目为3NAB.1 L 1.0 ml·L-1的盐酸含有阴离子总数为2NAC.11.2 L NO与11.2 L O2混合后的分子数目为NAD.23 g Na与足量H2O反应生成的H2分子数目为NA
1.下列说法中正确的是( )
A.摩尔既是物质的数量单位又是物质的质量单位B.阿伏加德罗常数是0.12 kg 12C中含有的碳原子数C.1 ml 水分子中含有2 ml 氢原子和1 ml 氧原子D.一个NO分子的质量是a g,一个NO2分子的质量是b g,则氧原子的摩尔质量是(b-a) g·ml-1
解析 摩尔是物质的量的单位,故A错误;0.012 kg12C中含有的碳原子数为阿伏加德罗常数,故B错误;一个水分子含有2个氢原子和1个氧原子,因此1 ml H2O分子中含有2 ml 氢原子和1 ml 氧原子,故C正确;一个NO分子的质量是a g,一个NO2分子的质量是b g,则一个氧原子的质量为(b-a) g,氧原子的摩尔质量为(b-a)NA g/ml,故D错误。
2.2020年11月12日,我国在西昌卫星发射中心成功将移动通信卫星“天通一号02星”发射升空。卫星的发射需要用到运载火箭,偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生巨大能量,可作为航天运载火箭的推动力来源。下列叙述中正确的是( )
A.偏二甲肼的摩尔质量为60 g ×1023个偏二甲肼分子的质量为60 g C.1 ml 偏二甲肼的质量为60 g·ml-1D.6 g 偏二甲肼含有NA个偏二甲肼分子
3.(2021·山西太原模拟)下列关于气体摩尔体积的说法正确的是( )
A.22.4 L任何气体的物质的量均为1 ml B.非标准状况下,1 ml 任何气体不可能占有22.4 L体积C.标准状况下,CO2气体摩尔体积是22.4 L·ml-1D.某物质含有6.02×1023个粒子,则该物质的体积为22.4 L
解析 未指明气体所处的外界条件,就不能确定气体摩尔体积,因此不能根据气体体积判断气体的物质的量的多少,A错误;若温度升高使气体体积增大的影响与压强增大使气体体积减小的影响相同,则非标准状况下,1 ml 任何气体也可能占有22.4 L体积,B错误;在标准状况下,任何气体的气体摩尔体积都大约是22.4 L·ml-1,因此在此条件下CO2气体摩尔体积是22.4 L·ml-1,C正确;该物质的物质的量是1 ml,由于物质的状态不一定是气体,且所处的外界条件也没有指出,因此不能确定该物质的体积大小,D错误。
4.利用太阳能分解水制氢气,若光解0.02 ml水,下列说法正确的是( )
A.可生成H2的质量为0.02 gB.可生成氢的原子数为2.408×1023个C.可生成H2的体积为0.224 L(标准状况)D.生成H2的量理论上等于0.04 ml Na与水反应产生H2的量
5.下列说法中正确的是( )
A.2 ml CH4的质量和O2的摩尔质量都是32 gB.1 ml任何气体中都含有相同的原子数C.0.5 ml NaCl约含有6.02×1023个离子D.1 ml·L-1 KCl溶液中含有溶质1 ml解析 O2的摩尔质量为32 g·ml-1,A项不正确;气体有单原子分子如He,双原子分子如O2,三原子分子如O3,五原子分子如CH4等,B项不正确;每个NaCl中有两个离子,0.5 ml NaCl中含离子总数为NA,C项正确;未指明溶液的体积,无法确定,D项不正确。
6.28 g铁粉溶于稀盐酸中,然后加入足量的Na2O2固体,充分反应后过滤,将滤渣加强热,最终得到的固体质量为( )
A.36 g B.40 g C.80 g D.160 g
7.草酸(分子式为H2C2O4,沸点:150 ℃)是生物体的一种代谢产物,广泛分布于植物、动物和真菌体中。下列有关判断不正确的是( )
8.(2022·广东惠州一调)若NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 ml N2所占体积约为22.4 LB.标准状况下,22.4 L CCl4含有的分子数为NAC.100 mL 0.1 ml·L-1 HClO溶液中H+数目为0.01NAD.标准状况下,11.2 L N2和H2的混合气体所含分子数为0.5NA
解析 气体体积与温度、压强有关,没有给出具体的温度、压强,不能计算气体体积,A项错误;标准状况下,CCl4为液态,不能用标准状况下的气体摩尔体积计算其物质的量,B项错误;HClO是弱电解质,在水中不能完全电离,100 mL 0.1 ml·L-1 HClO溶液中H+数目小于0.01NA,C项错误;标准状况下,11.2 L N2和H2的混合气体的物质的量为0.5 ml,所含分子数为0.5NA,D项正确。
9.(2022·广东省实验中学等四校联考)设NA为阿伏加德罗常数的值。下列说法正确的是( )
10.(2021·甘肃兰州模拟)在标准状况下,a g 气体X与b g 气体Y的分子数相同,下列叙述正确的是( )
A.标准状况下,等质量的X和Y体积之比为b∶aB.同温同压下,气体X和气体Y的气体摩尔体积之比为b∶aC.25 ℃时,1 g 气体X和1 g 气体Y的原子数之比为a∶bD.同物质的量的气体X和Y的质量之比为b∶a
解析 同温同压下,气体体积之比等于物质的量之比,相同质量时,其体积之比与其摩尔质量成反比,所以标准状况下,等质量的两种气体体积之比为b∶a,A正确;同温同压下,气体摩尔体积为定值,则同温同压下,气体X和气体Y的气体摩尔体积之比1∶1,B错误;不能确定每个X、Y分子含有的原子数目,所以无法计算含有原子数目之比,C错误;相同物质的量时,其质量比等于摩尔质量之比,为a∶b,D错误。
11.按要求回答问题:
(1)已知标准状况下,气体A的密度为2.857 g·L-1,则气体A的相对分子质量为____________,可能是___________气体。(2)标准状况下,1.92 g 某气体的体积为672 mL,则此气体的相对分子质量为____________。(3)CO和CO2的混合气体18 g,完全燃烧后测得CO2体积为11.2 L(标准状况),则①混合气体在标准状况下的密度是____________ g·L-1。②混合气体的平均摩尔质量是____________ g·ml-1。答案 (1)64 SO2 (2)64 (3)①1.61 ②36
12.现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。回答下列问题:
(1)该混合气体的平均摩尔质量:__________。(2)混合气体中碳原子的个数:________。(用NA表示阿伏加德罗常数的值)(3)将混合气体依次通过如图装置,最后收集在气球中。①气球中收集到的气体摩尔质量:______________________________;②标准状况下气球中收集到的气体的体积为________________;③气球中收集到的气体的电子总数为________。(用NA表示阿伏加德罗常数的值)答案 (1)36 g·ml-1 (2)0.4NA (3)①28 g·ml-1 ②4.48 L ③2.8NA
13.如图,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在A、B、C内分别充入等质量的X、CO2、Y三种气体,当隔板静止时,A、C内的气体密度相等。下列说法不正确的是( )
A.物质的量:n(X)
14.(2021·山东卷)X、Y均为短周期金属元素,同温同压下,0.1 ml X的单质与足量稀盐酸反应,生成H2体积为V1 L;0.1 ml Y的单质与足量稀硫酸反应,生成H2体积为V2 L。下列说法错误的是( )
15.标准状况下,在乙室中充入1.2 ml HCl,甲室中充入NH3、H2的混合气体,静止时活塞如图。已知甲室中气体的质量比乙室中气体的质量少33.8 g。
请回答下列问题:(1)甲室中气体的物质的量为_______ml。(2)甲室中气体的质量为____________ g。(3)甲室中NH3、H2的物质的量之比为__________,质量之比为__________。(4)如果将活塞a去掉,当HCl与NH3完全反应后,活塞b将静止于刻度“____________”(填数字)处。答案 (1)2 (2)10 (3)1∶4 17∶8 (4)6
2023版创新设计高考化学(新教材鲁科版)总复习一轮课件第1章 认识化学科学: 这是一份2023版创新设计高考化学(新教材鲁科版)总复习一轮课件第1章 认识化学科学,文件包含2023版创新设计高考化学新教材鲁科版总复习一轮讲义第2讲氯及其化合物pptx、2023版创新设计高考化学新教材鲁科版总复习一轮讲义第1讲钠及其化合物pptx、2023版创新设计高考化学新教材鲁科版总复习一轮讲义第3讲物质的量气体摩尔体积pptx、2023版创新设计高考化学新教材鲁科版总复习一轮讲义第4讲物质的量浓度pptx、2023版创新设计高考化学新教材鲁科版总复习一轮讲义本章易错题强化练pptx等5份课件配套教学资源,其中PPT共253页, 欢迎下载使用。
2023版 创新设计 高考总复习 化学 鲁科版第11章 有机化学基础(选考): 这是一份2023版 创新设计 高考总复习 化学 鲁科版第11章 有机化学基础(选考),文件包含2023版创新设计高考总复习化学鲁科版第1讲认识有机化合物pptx、2023版创新设计高考总复习化学鲁科版第2讲烃和卤代烃pptx、2023版创新设计高考总复习化学鲁科版第3讲烃的含氧衍生物pptx、2023版创新设计高考总复习化学鲁科版第4讲基本营养物质有机高分子化合物pptx、2023版创新设计高考总复习化学鲁科版第4讲基本营养物质有机高分子化合物DOCX、2023版创新设计高考总复习化学鲁科版第1讲认识有机化合物DOCX、2023版创新设计高考总复习化学鲁科版第3讲烃的含氧衍生物DOCX、2023版创新设计高考总复习化学鲁科版第2讲烃和卤代烃DOCX、2023版创新设计高考总复习化学鲁科版本章常考必备的重要有机转化关系及反应方程式书写强化练pptx、2023版创新设计高考总复习化学鲁科版本章常考必备的重要有机转化关系及反应DOCX等10份课件配套教学资源,其中PPT共257页, 欢迎下载使用。
2023版 创新设计 高考总复习 化学 鲁科版第8章 物质在水溶液中的行为: 这是一份2023版 创新设计 高考总复习 化学 鲁科版第8章 物质在水溶液中的行为,文件包含2023版创新设计高考总复习化学鲁科版第1讲水溶液pptx、2023版创新设计高考总复习化学鲁科版第2讲弱电解质的电离pptx、2023版创新设计高考总复习化学鲁科版第3讲盐类的水解pptx、2023版创新设计高考总复习化学鲁科版第4讲沉淀溶解平衡pptx、2023版创新设计高考总复习化学鲁科版第4讲沉淀溶解平衡DOCX、2023版创新设计高考总复习化学鲁科版第1讲水溶液DOCX、2023版创新设计高考总复习化学鲁科版第2讲弱电解质的电离DOCX、2023版创新设计高考总复习化学鲁科版第3讲盐类的水解DOCX、2023版创新设计高考总复习化学鲁科版本章笔答题答题语言规范强化练pptx、2023版创新设计高考总复习化学鲁科版本章笔答题答题语言规范强化练DOCX等10份课件配套教学资源,其中PPT共254页, 欢迎下载使用。












