
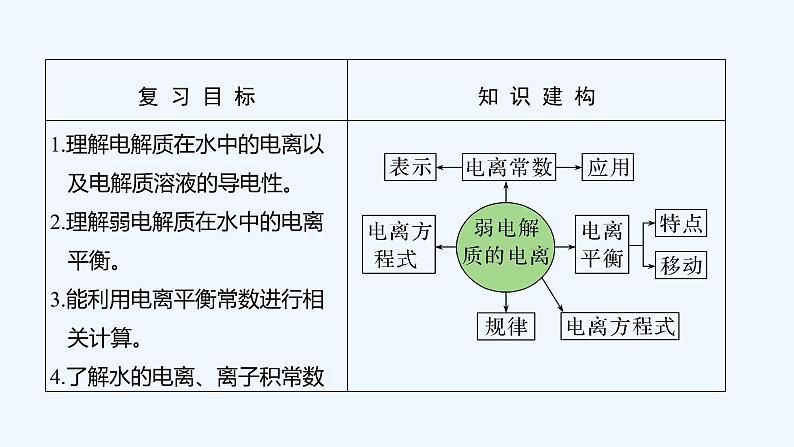






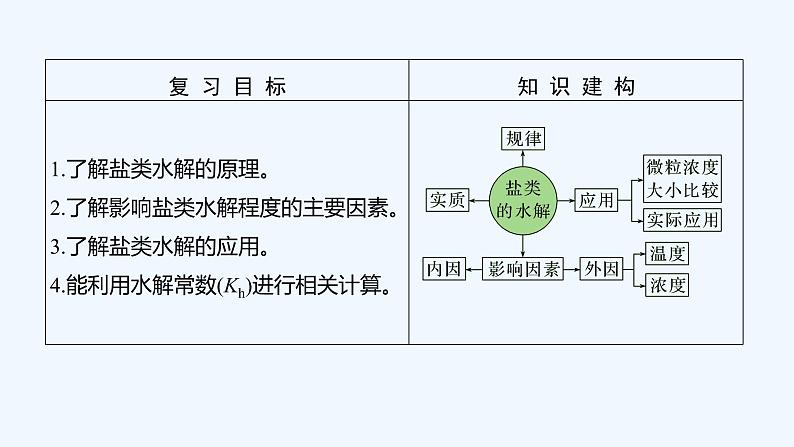






















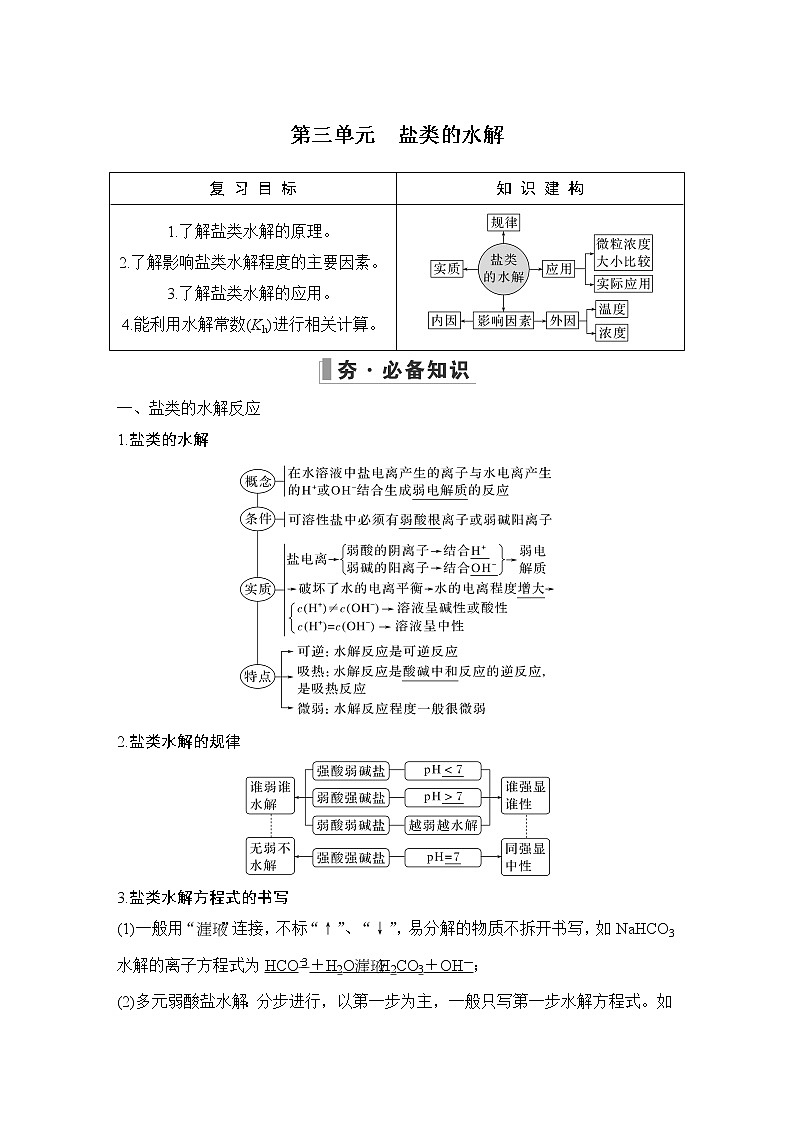


所属成套资源:2023版 创新设计 高考总复习 化学 苏教版【讲义+课件】
2023版 创新设计 高考总复习 化学 苏教版专题8 溶液中的离子反应
展开
这是一份2023版 创新设计 高考总复习 化学 苏教版专题8 溶液中的离子反应,文件包含2023版创新设计高考总复习化学苏教版第一单元弱电解质的电离pptx、2023版创新设计高考总复习化学苏教版第三单元盐类的水解pptx、2023版创新设计高考总复习化学苏教版第二单元溶液的酸碱性pptx、2023版创新设计高考总复习化学苏教版第四单元难溶电解质的沉淀溶解平衡pptx、2023版创新设计高考总复习化学苏教版第四单元难溶电解质的沉淀溶解平衡DOCX、2023版创新设计高考总复习化学苏教版第一单元弱电解质的电离DOCX、2023版创新设计高考总复习化学苏教版第二单元溶液的酸碱性DOCX、2023版创新设计高考总复习化学苏教版第三单元盐类的水解DOCX等8份课件配套教学资源,其中PPT共240页, 欢迎下载使用。
第四单元 难溶电解质的 沉淀溶解平衡
专题8 溶液中的离子反应
夯·必备知识
提·关键能力
微专题
目录
CONTENTS
成·学科素养
练·高考真题
热点强化练
方法篇
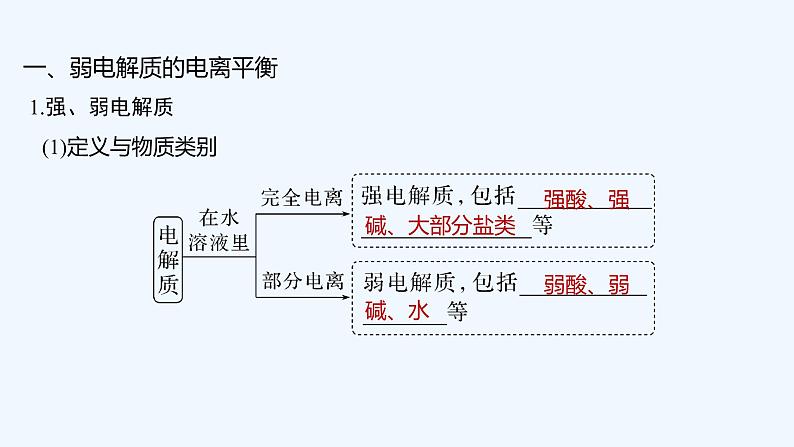
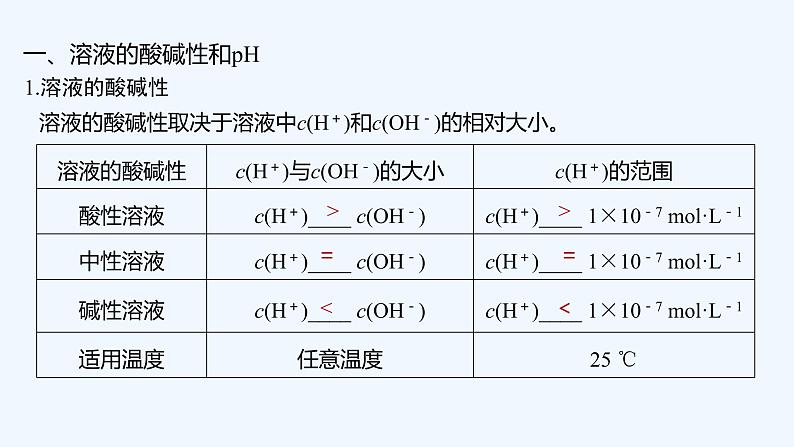
1.含义
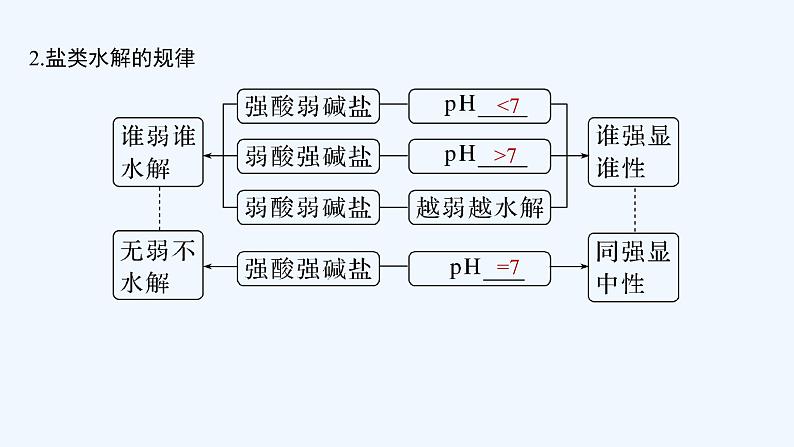
一、沉淀溶解平衡原理
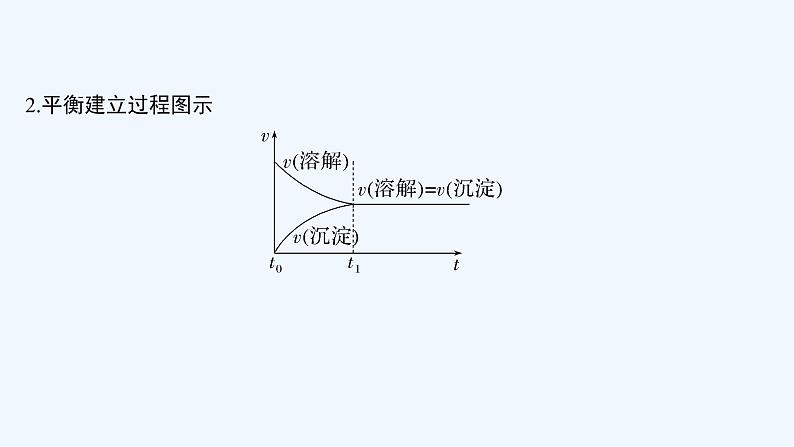
在一定温度下的水溶液中,当难溶电解质沉淀______和______的速率相等时,即建立了沉淀溶解平衡状态。
溶解
生成
2.平衡建立过程图示
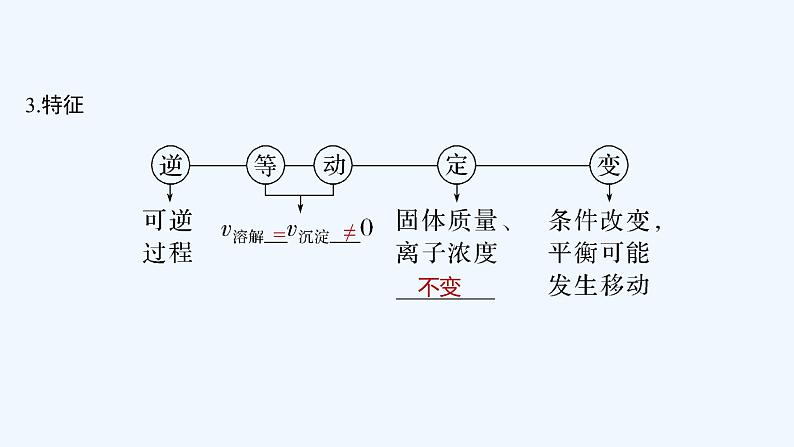
3.特征
=
≠
不变
4.影响沉淀溶解平衡的因素
沉淀溶
解方向
增大
沉淀溶解方向
不变
不变
生成沉淀方向
沉淀溶解方向
向
吸热
5.沉淀溶解平衡的应用
(1)沉淀的生成:如除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH,离子方程式为__________________________________________________________。(2)沉淀的溶解:如AgCl溶于氨水,离子方程式为______________________________________________________。
AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O
(3)沉淀的转化Ⅰ转化实质:沉淀溶解平衡的移动,沉淀的溶解度差别______,越容易转化。
越大
Ⅱ.应用:①锅炉除垢:将CaSO4转化为易溶于酸的CaCO3,离子方程式为__________________________________________________________________。②矿物转化:CuSO4溶液遇PbS转化为CuS,离子方程式为__________________________________________________________________。
【判一判】 判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)沉淀溶解时,溶液中各离子浓度相等( )(2)沉淀溶解达到平衡时,v(沉淀)=v(溶解)( )(3)升高温度,沉淀溶解平衡一定正向移动( )(4)室温下,AgCl在水中的溶解度小于在食盐水中的溶解度( )(5)常温下,向BaCO3的饱和溶液中加入Na2CO3固体,会有BaCO3生成( )
答案 (1)× (2)√ (3)× (4)× (5)√
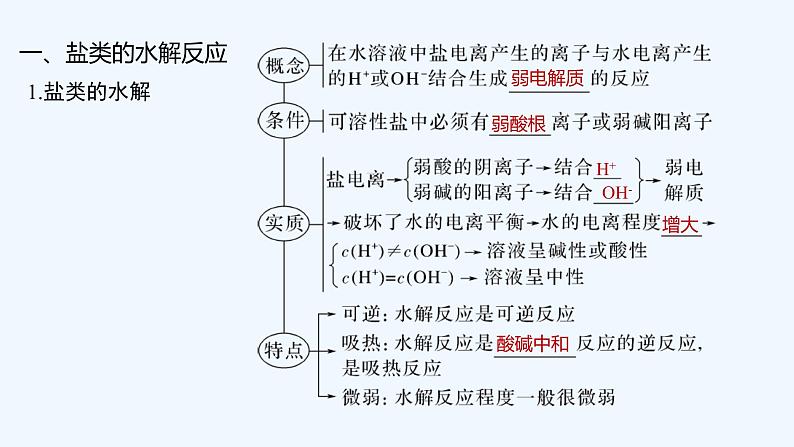
1.溶度积与离子积
二、溶度积常数
cm(An+)·cn(Bm-)
沉淀
平衡
未饱和
2.Ksp的意义
Ksp可以反映难溶电解质在水中的溶解能力。当化学式所表示的组成中阴、阳离子个数比相同时,Ksp越大的难溶电解质在水中的溶解能力______,一般溶解度也______。
越强
越大
3.Ksp的影响因素
(1)内因:难溶电解质本身的性质。(2)外因:温度,绝大多数难溶电解质升高温度,平衡向溶解方向移动,Ksp______。
增大
【判一判】 判断下列说法是否正确,正确的打“√”,错误的打“×”。
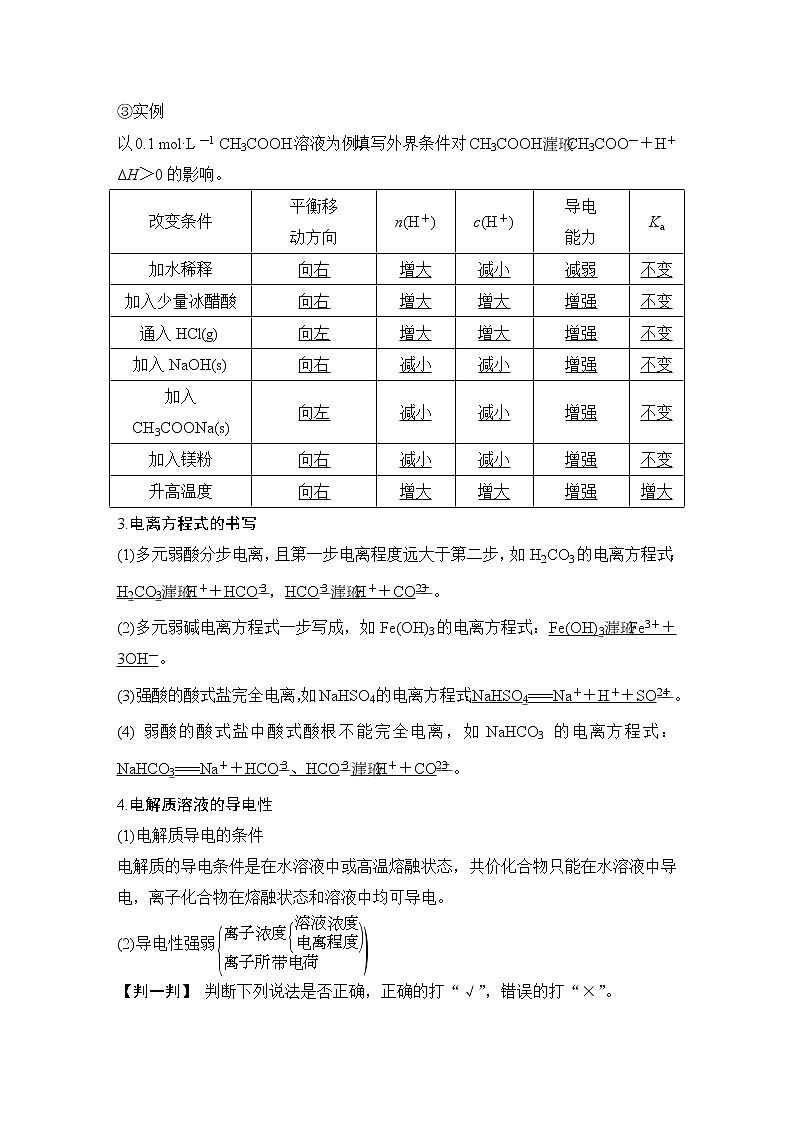
(1)Cu(OH)2的Ksp[Cu(OH)2]=c(Cu2+)·c(OH-)( )(2)常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小( )(3)溶度积常数Ksp只受温度影响,温度升高Ksp增大( )(4)常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2 的Ksp减小( )(5)25 ℃时,Ksp(Ag2CrO4)Ag2S,即Ksp(AgCl)>Ksp(AgI)>Ksp(Ag2S)。[注意问题] 试管(1)中NaCl必须过量,若AgNO3溶液过量,则得不到上述实验结论。
比较难溶电解质Ksp大小的实验设计方法方法一 沉淀转化法先制得沉淀A,然后使沉淀A自发地转化为沉淀B,则说明沉淀A的溶解度大于沉淀B。即Ksp(A)>Ksp(B),实验时要求沉淀的转化有明显的实验现象。方法二 沉淀先后顺序法❶以AgCl、AgI为例向等浓度NaCl和NaI的混合溶液中滴入几滴AgNO3溶液,首先产生黄色沉淀,说明KSP(AgCl)>Ksp(AgI)
【迁移应用】1.根据下列实验操作和现象得到的结论正确的是( )
A
2.(2021·安徽芜湖模拟)已知几种难溶电解质的溶度积常数Ksp(25 ℃)见表:
下列叙述正确的是( )A.向2 mL KCl、KI混合溶液中滴加2滴0.01 mol·L-1的AgNO3溶液,振荡沉淀呈黄色,说明Ksp(AgCl)>Ksp(AgI)B.向0.1 mol·L-1的Na2CrO4溶液中滴入AgNO3溶液至不再有砖红色沉淀(Ag2CrO4)产生,再滴加0.1 mol·L-1的NaCl溶液, 砖红色沉淀逐渐转变为白色,说明Ksp(AgCl)c(Na+)>c(H+)>c(OH-)C.FeS溶于稀硫酸,而CuS不溶于稀硫酸,则Ksp(FeS)>Ksp(CuS)D.在1 mol·L-1 Na2S溶液中,c(S2-)+c(HS-)+c(H2S)=1 mol·L-1
解析 酸根离子的水解能力越强,对应酸的酸性越弱,HF的酸性比HCOOH强,A项错误;等浓度的CH3COOH和CH3COONa混合溶液呈酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度,则离子浓度关系:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),B项正确;FeS溶于稀硫酸,而CuS不溶于稀硫酸,说明FeS的溶解度大于CuS,Ksp(FeS)>Ksp(CuS),C项正确;根据物料守恒可知,c(S2-)+c(HS-)+c(H2S)=1 mol·L-1,D项正确。
2.已知氢硫酸(H2S) 的电离平衡常数为:Ka1(H2S)=9.1×10-8,Ka2(H2S)=1.1×10-12。H2S溶液中c(总)=c(H2S)+c(HS-)+c(S2-)。室温下向25.00 mL 0.100 0 mol·L-1 H2S 溶液中逐滴滴入NaOH溶液。下列说法正确的是( )
A.随着NaOH溶液滴入,溶液中水的电离程度不断增大B.c(Na+)=c(总)的溶液: c(Na+)>c(S2-)>c(H2S)>c(H+)C.pH=7的溶液: c(Na+)>c(S2-)>c(HS-)>c(OH-)=c(H+)D.c(H+)=9.1×10-8 mol·L-1时: c(H2S)+2c(S2-)+c(OH-)=c(Na+)+c(H+)
D
3.(2021·广东惠州第一次调研)25 ℃时,向10 mL 0.01 mol·L-1 NaCN溶液中逐滴滴加0.01 mol·L-1的盐酸,其pH变化曲线如图所示。下列溶液中的关系一定正确的是(忽略体积微小变化)( )
A.a点的溶液的pH≥12B.b点的溶液:c(CN-)>c(HCN)C.c点的溶液:c(CN-)+c(HCN)+c(Cl-)=0.01 mol·L-1D.pH=7的溶液:c(Na+)+c(H+)=c(Cl-)+c(CN-)
C
解析 NaCN溶液的pH>7,说明NaCN是强碱弱酸盐,CN-在水溶液中部分水解,若NaCN完全水解,则溶液的pH等于12,而CN-不能完全水解,故a点溶液pH小于12,A项错误;b点加入了5 mL 盐酸,溶液中的溶质为等物质的量的NaCN、NaCl、HCN,此时溶液显碱性,说明NaCN的水解程度大于HCN的电离程度,c(CN-)<c(HCN),B项错误;c点加入10 mL 盐酸,溶液中的溶质为NaCl、HCN,根据物料守恒知溶液中c(CN-)+c(HCN)+c(Cl-)=(10×10-3 L×0.01 mol·L-1+10×10-3 L×0.01 mol·L-1)÷(20×10-3 L)=0.01 mol·L-1,C项正确;pH=7时c(OH-)=c(H+),根据电荷守恒:c(CN-)+c(OH-)+c(Cl-)=c(Na+)+c(H+),可得c(CN-)+c(Cl-)=c(Na+),D项错误。
D
4.常温下,用0.1 mol/L NaOH溶液分别滴定体积均为20.00 mL 、浓度均为0.1 mol/L的HX、HY溶液,pH随NaOH溶液体积变化如图。下列结论正确的是( )
A.水解常数:X->Y-B.10.00 mL 时,有c(Na+)>c(HX)>c(X-)>c(H+)C.pH=7时,c(Y-)>c(X-)D.a、b两点溶液混合后,c(HX)+c(HY)+c(H+)=c(OH-)
解析 根据图像知,开始时pH(HX)<pH(HY),则酸性:HX>HY,酸性越弱,对应阴离子的水解常数越大,A错误;B项,当向HX溶液中加入10.00 mL NaOH溶液时,溶液中溶质为HX和NaX,且物质的量之比为1∶1,分析图像知,HX的电离程度大于X-的水解程度,故c(X-)>c(Na+)>c(HX)>c(H+),B错误;pH=7时,溶液中c(H+)=c(OH-),根据电荷守恒,分别存在c(Na+)=c(X-),c(Na+)=c(Y-),但HX消耗的NaOH的量比HY大,故c(Y-)<c(X-),C错误;a、b两点溶液分别是完全中和后得到的NaX、NaY溶液,混合后根据质子守恒有c(HX)+c(HY)+c(H+)=c(OH-),D正确。
D
6.(2021·河南郑州一检)常温下,用0.10 mol·L-1的盐酸滴定20 mL 相同浓度的某一元碱BOH溶液,滴定过程中pH及电导率变化曲线如图所示:
D
下列说法正确的是( )A.BOH的Kb约为1×10-3B.a点的c(B+)大于b点C.a点溶液中:c(B+)+c(H+)=2c(OH-)+c(BOH) D.滴定至pH=7时,c(B+)=c(Cl-)<0.1 mol·L-1
a点溶液中存在电荷守恒c(B+)+c(H+)=c(OH-)+c(Cl-)、存在物料守恒c(B+)+c(BOH)=2c(Cl-),所以存在c(B+)+2c(H+)=2c(OH-)+c(BOH),故C错误;混合溶液pH=7时,溶液呈中性,c(H+)=c(OH-),溶液中存在电荷守恒c(B+)+c(H+)=c(OH-)+c(Cl-),则c(B+)=c(Cl-),酸碱混合后导致溶液体积增大,则导致溶液中c(Cl-)减小,所以存在c(B+)=c(Cl-)<0.1 mol/L,故D正确。
A.常温下,HPP的一级电离常数Kb1=10-5B.常温下,含等量HPP和HPPHCl的溶液显酸性C.HPP与过量稀硫酸反应得到的盐为HPPH2(HSO4)2D.HPPH2Cl2溶液中:c(H+)=c(HPPH+)+c(HPP)+c(OH-)
C
8.(2021·湖北卷)常温下,已知H3PO3溶液中含磷物种的浓度之和为0.1 mol·L-1,溶液中各含磷物种的pc-pOH关系如图所示。图中pc表示各含磷物种的浓度负对数(pc=-lgc),pOH表示OH-的浓度负对数[pOH=-lgc(OH-)];x、y、z三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。
下列说法正确的是( )
D
热点强化练16 Ksp在化工流程中的应用
1.七铝十二钙(12CaO·7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
煅粉主要含MgO和________,用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,若滤液Ⅰ中c(Mg2+)小于5×10-6mol·L-1,则溶液pH大于________[Mg(OH)2的Ksp=5×10-12];该工艺中不能用(NH4)2SO4代替NH4NO3,原因是_____________________________________________________________________________________________________________________________。
答案 CaO 11 易生成硫酸钙微溶物,在过滤时被除去,导致碳酸钙产率降低
2.工业上利用软锰矿(主要成分是MnO2,还含有Fe、Al、Mg、Zn、Ni、Si等元素的氧化物)进行烟气脱硫,并制备MnSO4和Mg(OH)2的工艺流程如下图所示。
(1)“沉锰”过程中pH和温度对Mn2+和Mg2+沉淀率的影响如下图所示。
①由图可知,“沉锰”的合适条件是___________________________。②当温度高于45 ℃时,Mn2+沉淀率减小的原因是_____________________。
答案 (1)①45 ℃、pH=7.5 ②随着温度升高,NH4HCO3分解(或NH3·H2O分解挥发)
(2)“沉镁”中MgSO4溶液的浓度为0.03 mol·L-1,加入某浓度氨水至溶液体积增加1倍时,恰好使Mg2+完全沉淀即溶液中c(Mg2+)=1.0×10-5 mol·L-1,此时溶液中NH3·H2O的物质的量浓度为________mol·L-1(计算结果保留2位小数。已知:Ksp[Mg(OH)2]=4.9×10-12,Kb(NH3·H2O)=1.8×10-5)。
1.17
3.制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中除含有硝酸锌外,还含有自来水带入的Cl-和Fe3+。在实验室里用“烂板液”制取ZnSO4·7H2O的过程如下:
(1)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠,写出Zn(OH)2被溶解的离子方程式__________________________________________________。(2)滤液D中除了含有OH-外,还含有的阴离子有________(填离子符号)。(3)若滤液E的pH=4, c(Zn2+)=2 mol/L,c(Fe3+)=2.6×10-9 mol/L能求得的溶度积是________(填字母)。A.Ksp[Zn(OH)2] B.Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C.Ksp[Fe(OH)3]
4.一种从乙醛工业中产生的废钯(Pd)催化剂(钯5%~6%,炭93%~94%,铁、铜、锌、镍1%~2%)中提取PdCl2和CuCl2的工艺流程如图所示:
请回答:(1)“酸溶”时,Pd转化为PdCl2,其化学方程式为____________________;该过程需控温70~80 ℃,温度不能太低或太高的原因为_________________________________________________________________。(2)“络合”时,溶液的pH需始终维持8~9,则络合后溶液中含铁离子的浓度≤________。[已知:Fe(OH)2、Fe(OH)3的Ksp分别为4×10-17、2.8×10-39]
答案 (1)Pd+3HCl+HNO3===PdCl2+NOCl+2H2O 温度太低反应速率过慢,温度太高王水易分解挥发(2)2.8×10-21 mol·L-1
5.二次电池锂离子电池广泛应用于手机和电脑等电子产品中。某常见锂离子电池放电时电池的总反应为: Li1-xCoO2+ LixC6=== LiCoO2+C6(x
相关课件
这是一份2023版创新设计高考化学(新教材苏教版)总复习一轮课件专题九 水溶液中的离子反应,文件包含2023版创新设计高考化学新教材苏教版总复习一轮课件第三单元盐类的水解pptx、2023版创新设计高考化学新教材苏教版总复习一轮课件第一单元弱电解质的电离平衡pptx、2023版创新设计高考化学新教材苏教版总复习一轮课件第二单元溶液的酸碱性pptx、2023版创新设计高考化学新教材苏教版总复习一轮课件第四单元沉淀溶解平衡pptx、2023版创新设计高考化学新教材苏教版总复习一轮课件本专题简答题答题语言规范强化练pptx等5份课件配套教学资源,其中PPT共255页, 欢迎下载使用。
这是一份2023版 创新设计 高考总复习 化学 苏教版专题12 物质结构与性质(选考),文件包含2023版创新设计高考总复习化学苏教版第一单元原子结构与性质pptx、2023版创新设计高考总复习化学苏教版第三单元晶体结构与性质pptx、2023版创新设计高考总复习化学苏教版第二单元分子结构与性质pptx、2023版创新设计高考总复习化学苏教版第二单元分子结构与性质DOCX、2023版创新设计高考总复习化学苏教版第三单元晶体结构与性质DOCX、2023版创新设计高考总复习化学苏教版第一单元原子结构与性质DOCX等6份课件配套教学资源,其中PPT共180页, 欢迎下载使用。
这是一份2023版 创新设计 高考总复习 化学 苏教版专题11 有机化学基础(选考),文件包含2023版创新设计高考总复习化学苏教版第一单元认识有机化合物pptx、2023版创新设计高考总复习化学苏教版第三单元烃的衍生物pptx、2023版创新设计高考总复习化学苏教版第二单元常见的烃pptx、2023版创新设计高考总复习化学苏教版第四单元生命活动的物质基础有机高分子化合物pptx、2023版创新设计高考总复习化学苏教版第四单元生命活动的物质基础有机高分子化合物DOCX、2023版创新设计高考总复习化学苏教版第一单元认识有机化合物DOCX、2023版创新设计高考总复习化学苏教版第三单元烃的衍生物DOCX、2023版创新设计高考总复习化学苏教版第二单元常见的烃DOCX等8份课件配套教学资源,其中PPT共240页, 欢迎下载使用。









