





高中人教版 (2019)第一节 硫及其化合物课前预习ppt课件
展开
这是一份高中人教版 (2019)第一节 硫及其化合物课前预习ppt课件,共59页。PPT课件主要包含了硫1物理性质,必备知识·自主学习,试管中液面上升,SO2易溶于水,溶液颜色变红色,SO2的水溶液显酸性,振荡后溶液红色,褪去再加热溶液,又恢复红色,SO2具有漂白性等内容,欢迎下载使用。
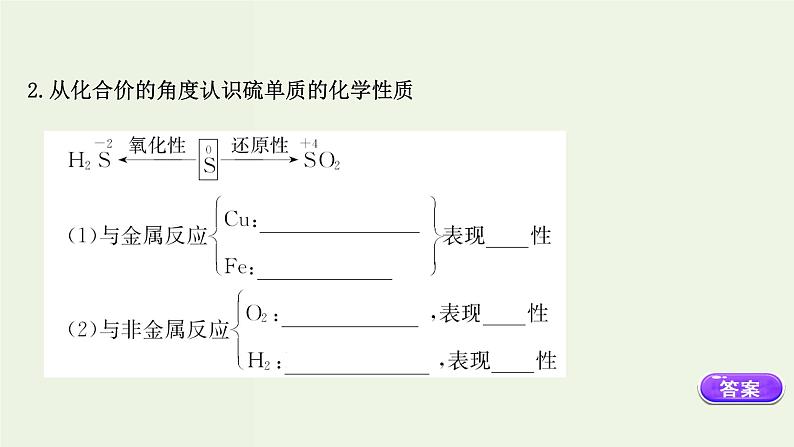
2.从化合价的角度认识硫单质的化学性质
【自主探索】 (1)判断下列是否正确。①硫只以化合态存在于自然界中。( )提示:×。硫在自然界中主要存在形式是化合态,也有游离态。②清洗试管内壁粘附的硫黄,可以用CS2清洗。( )提示:√。硫易溶于CS2,可清洗试管壁附着的S。③硫与Fe反应生成FeS,与Cu反应生成CuS。( )提示:×。与Cu反应生成Cu2S。
④硫在空气中的燃烧产物是SO2,在纯氧中的燃烧产物是SO3。( )提示:×。S+O2 SO2,产物只有SO2。
(2)(情境思考)我国晋代炼丹家、医学家葛洪所著《抱朴子》一书中记载有:“丹砂烧之成水银,积变又还成丹砂”。
这句话的意思是:Ⅰ.红色的硫化汞晶体(丹砂)在空气中灼烧有汞和硫蒸气生成;Ⅱ.汞和硫在一起研磨生成黑色硫化汞。①请写出该反应的化学反应方程式。提示:Ⅰ.HgS Hg+S;Ⅱ.Hg+S====HgS。②两个反应所发生的变化是物理变化还是化学变化?为什么?提示:两个反应均有新物质生成,所以两个反应均是化学变化。
③(前后串联)同一物质在同一反应中既可以作氧化剂又可作还原剂,反应3S+6NaOH 2Na2S+Na2SO3+3H2O中,氧化剂和还原剂的物质的量之比是多少?提示:3 ml S中,2 ml S化合价降低,作氧化剂,1 ml S化合价升高,作还原剂,氧化剂和还原剂的物质的量之比是2∶1。
二、二氧化硫1.物理性质
2.化学性质(1)实验探究
(2)二氧化硫的四性质
【自主探索】 (1)判断下列说法是否正确。①SO2有漂白性,所以SO2可使滴有酚酞的NaOH溶液褪色。( )提示:×。漂白性是指使有机色质褪色,SO2使滴有酚酞的NaOH溶液褪色体现了二氧化硫具有酸性氧化物的性质。②SO2与H2S气体可以共存。( )提示:×。二者不能共存,SO2+2H2S====3S+2H2O。
③SO2、漂白粉、Na2O2都能使鲜花褪色,其原理相同( )提示:×。SO2与有色物质发生化合反应,漂白粉、Na2O2利用强氧化性漂白。
(2)(情境思考)某化学兴趣小组从新闻中得知,管理部门从两种南瓜子中检测出二氧化硫;不法商贩常常采用加热硫的方法来熏制食品,达到漂白的目的。根据所学知识可以采用什么方法检验漂白过程使用了SO2?提示:SO2漂白后得到的无色物质不稳定,受热分解,恢复原色。(3)(前后串联)将足量CO2缓慢通入澄清石灰水中,什么现象?如何书写反应的化学方程式?若改为SO2呢?提示:先变浑浊后变澄清;CO2+Ca(OH)2====CaCO3↓+H2O、CaCO3+CO2+H2O====Ca(HCO3)2。先变浑浊后变澄清;SO2+Ca(OH)2====CaSO3↓+H2O、CaSO3+SO2+H2O====Ca(HSO3)2。
(4)(情境思考)我国的酸雨主要是因大量燃烧含硫量高的煤而形成的,多为硫酸雨,收集到的酸雨样品,放置时间稍长,酸性反而越强,原因是什么? 提示:酸雨中的H2SO3为中强酸,易被O2氧化为酸性强的H2SO4:2H2SO3+O2====4H++2 。
知识点一 SO2和CO2的性质比较
【易错提醒】 1.SO2、CO2分别通入BaCl2溶液中均无沉淀生成。2.SO2、CO2分别通入Ba(NO3)2溶液中,前者生成沉淀,后者无沉淀。
【合作探究】(1)(思维升华)在BaCl2溶液中通入CO2、SO2气体,均未见沉淀生成,通入Cl2、H2S等可否产生沉淀?写出与SO2气体有关反应的化学方程式,是离子反应的写离子方程式。(宏观辨识与微观探析)提示:CO2中无现象,SO2中产生沉淀。SO2+Cl2+2H2O==== +2Cl-+4H+、 +Ba2+====BaSO4↓(或SO2+Cl2+2H2O+Ba2+====BaSO4↓+2Cl-+4H+);2H2S+SO2====3S↓+2H2O。
(2)(情境应用)葡萄酒是由葡萄汁发酵而成的。在酿造葡萄酒的过程中面临两大问题:一是葡萄汁发酵过程中产生的杂菌会影响葡萄酒的酿造和保存;二是葡萄酒中含有的还原性物质一旦被氧化,葡萄酒的果香味会消失,影响口感。在酿酒实践中,酿酒师发现二氧化硫能完美解决这两大问题。葡萄酒中的二氧化硫一部分是葡萄汁发酵过程中产生的,但由于量少,还需要额外添加。为什么二氧化硫能够解决酿造葡萄酒过程中出现的两大难题?(科学探究与创新意识)
提示:二氧化硫是一种防腐剂,具有抗氧化和杀菌的作用。二氧化硫具有杀菌作用,所以能够去除葡萄汁发酵过程中产生的杂菌,二氧化硫具有较强的还原性,能够防止葡萄酒中的还原性物质被氧化。
【典例示范】【典例】(2020·邯郸高一检测)化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分,将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现溶液又变澄清,由此该小组成员对气体的成分提出猜想。[提出猜想]猜想1:该气体为CO2。猜想2:该气体为SO2。猜想3:______________________。 为了验证猜测,该小组设计实验加以探究。
[实验探究]该小组同学按如图所示装置,将气体从a端通入。
(1)B中应该装下列________试剂(填编号)。 A.NaCl溶液 B.酸性KMnO4溶液C.盐酸D.澄清石灰水(2)A中品红溶液的作用是___________________________。 (3)D中澄清石灰水的作用是___________________________。 通过该实验,该小组同学观察到以下三个实验现象:①A中品红溶液褪色②C中品红溶液不褪色③D中澄清石灰水变浑浊[得出结论](4)由上述现象,该小组同学确认该气体的成分为_________________。
【思维建模】检验SO2和CO2同时存在的一般流程:SO2和CO2都可使澄清的石灰水变浑浊,检验二者同时存在的一般流程为:检验SO2⇒除去SO2⇒检验SO2是否除尽⇒检验CO2。
【解析】回忆学过的能使澄清石灰水先变浑浊又变澄清的气体,只有CO2和SO2,所以提出的猜想是:①气体为CO2;②气体为SO2;③气体为CO2和SO2的混合气体。要验证气体的成分,必须先验证SO2是否存在,并除尽,再验证CO2气体的存在,因为SO2的存在对CO2的验证有干扰。答案:气体为CO2和SO2的混合气体(1)B (2)验证混合气体中是否含有SO2(3)验证混合气体中是否含有CO2(4)CO2和SO2的混合气体
【母题追问】(1)装置B中试剂还可以选择使用什么物质?提示:溴水。二氧化硫可以被溴水氧化而吸收,二氧化碳不能发生反应。(2)能否将除去SO2的B装置和检验SO2的C装置合并为一个装置?提示:可以。可用足量较浓的酸性KMnO4溶液代替B、C装置。
【规律方法】鉴别CO2与SO2的方法(1)鉴别SO2气体常用品红溶液,看其能否使品红溶液褪色,有时还需再加热看溶液颜色能否复原。(2)鉴别CO2气体常用澄清石灰水,看其能否使澄清石灰水变浑浊,过量时再变澄清。(3)当混有CO2时,不会影响SO2的鉴别;当混有SO2时会干扰CO2的鉴别,应先除去SO2,再用澄清石灰水鉴别CO2气体。(4)除去CO2中的SO2,常用的方法是使混合气体先通过足量的溴水或酸性KMnO4溶液(吸收SO2),再通过品红溶液(检验SO2是否被除尽)。
【素养训练】为确定某纯净的气体X的成分,进行了如下几种实验,其中不正确的是( )
【解析】选A。能使酸性KMnO4溶液褪色且有刺激性气味的气体还有HCl等,A项错误;能使澄清石灰水变浑浊的有CO2、SO2,但前者无气味,B项正确;使品红溶液褪色且加热又恢复红色的只有SO2,C项正确;SO2不能漂白紫色石蕊溶液,D项正确。
知识点二 SO2的性质再认识 1.SO2不能漂白酸碱指示剂,如只能使紫色的石蕊溶液变红,但不能使之褪色。2.SO2的漂白性和还原性的区别,SO2使品红溶液褪色表现的是SO2的漂白性,加热后溶液颜色复原;SO2使酸性高锰酸钾溶液、溴水、氯水、碘水褪色表现的是SO2的还原性,加热后溶液颜色不复原。3.SO2氧化性的表现,SO2通入氢硫酸、硫化钠溶液中都会出现淡黄色沉淀,表现了SO2的氧化性。
4.SO2和Cl2的漂白性比较
【合作探究】 1.(思维升华)SO2和Cl2都能用于漂白,若将SO2和Cl2等物质的量混合通入品红溶液,能达到“强强联合”的漂白效果吗?(宏观辨识与微观探析)提示:不能,因为SO2和Cl2会发生如下反应:SO2+Cl2+2H2O====H2SO4+2HCl,从而失去漂白效果。2.(教材二次开发)教材P3“二氧化硫的漂白作用是由于它能与某些有色物质生成不稳定的无色物质,这些无色物质容易分解而使有色物质恢复原来的颜色”。某气体通入品红溶液能使溶液褪色,如何验证该气体是SO2,还是Cl2?(科学探究与创新意识)提示:将褪色后的溶液加热,若能恢复原来颜色,则该气体是SO2;若不能恢复原色,则为Cl2。
3.(情境应用)根据国家标准,葡萄酒含硫量不能超过250 mg·L-1。检测葡萄酒中二氧化硫的含量是葡萄酒厂和相关食品质检部门的重要工作。某种检测方法用到硫酸溶液、碘水淀粉溶液等试剂,书写该方法涉及化学反应的离子方程式。该反应为什么可以检测出二氧化硫的含量?(科学态度与社会责任)
提示:离子方程式为SO2+I2+2H2O====4H++ +2I-。淀粉溶液遇到碘单质变蓝,可以向一定体积的待测葡萄酒中加入适量淀粉溶液,然后向溶液中滴加一定浓度的碘水,根据消耗I2的量计算二氧化硫的含量。
4.(情境应用)如图是研究二氧化硫性质的微型实验装置。现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气。 思考:图中品红溶液、紫色石蕊溶液、溴水、含酚酞的NaOH溶液如何变化?(科学探究与创新意识)
提示:SO2的水溶液显酸性,能使紫色石蕊溶液变红;SO2有漂白性,能使品红溶液褪色;SO2有强还原性,与溴水发生反应:Br2+SO2+2H2O====H2SO4+2HBr,使溴水褪色;SO2能与NaOH溶液反应生成Na2SO3,使红色变浅或褪色。
【典例示范】【典例】下列说法正确的是( )A.因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊试液褪色B.能使品红溶液褪色加热后复原的气体一定是SO2C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同D.SO2和Cl2等物质的量混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好
【解题指南】解答本题注意以下两点:(1)要正确解答本题,必须清楚常见漂白剂的漂白原理。(2)SO2的漂白性是指SO2与有机色素反应而使有机物褪色,但SO2不能使酸碱指示剂、红墨水等褪色。
【解析】选B。SO2使溴水、酸性KMnO4溶液褪色是因为SO2具有还原性,能使品红褪色是因其漂白性,SO2不能使指示剂褪色,A项错误;B项正确,SO2漂白时生成的无色物质不稳定,加热易复原;C项错误,因为这些漂白剂的漂白原理不相同,SO2漂白属于化合型,活性炭属于吸附型,漂白粉、Na2O2属于氧化型;D项错误,等物质的量的SO2和Cl2相遇在溶液中反应生成H2SO4和HCl,从而失去漂白能力。
【母题追问】(1)A项“将SO2、HCl气体分别通入滴有酚酞的NaOH溶液褪色”说明SO2和HCl都有漂白性吗?提示:SO2不能漂白酸碱指示剂。HCl气体能使滴有酚酞的NaOH溶液褪色的原理是HCl中和NaOH溶液使碱性变弱,并不是盐酸具有漂白性。(2)上题涉及的物质既能用于漂白又能用于杀菌消毒的有哪些?提示:氯气、Na2O2、漂白粉。既能漂白又能杀菌消毒的物质具有(或与水反应产生的物质具有)强氧化性。
【素养训练】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
(1)①反应开始一段时间后,观察到B、D两支试管中的品红溶液出现的现象是B:________________,D:________________。 ②停止通气后,再给B、D两支试管分别加热,两支试管中的现象分别为B:__________________,D:__________________。 (2)相同条件下,若将SO2与CO2按体积比1∶1混合后,再通入品红溶液,品红溶液能否褪色?________(选填“能”“不能”或“不能确定”)。其原因是____。(用离子方程式表示)
【解析】(1)SO2具有漂白性,可使品红溶液褪色,但其漂白性是可逆的,加热后溶液会恢复原来的颜色;Cl2通入品红溶液时与H2O反应生成HCl和HClO,HClO具有强氧化性,会把品红溶液氧化而褪色,且该过程不可逆,故加热溶液不会恢复原来的颜色。(2)由于Cl2与SO2混合后与水发生反应:SO2+Cl2+2H2O====H2SO4+2HCl,故不能使品红溶液褪色。答案:(1)①品红溶液褪色 品红溶液褪色 ②褪色的品红溶液又恢复成红色 无明显现象 (2)不能 Cl2+SO2+2H2O====4H++2Cl-+
三言两语话重点 1.牢记SO2的四个性质:酸性氧化物的性质、强还原性、弱氧化性、漂白性。2.明辨三类漂白原理:吸附型、氧化型和化合型。3.熟记以下重点化学方程式:(1)SO2+Ca(OH)2====CaSO3↓+H2O(2)SO2+2H2S====3S+2H2O(3)SO2+Cl2+2H2O====2HCl+H2SO4
SO2+2NaOH=Na2SO3+H2O
具有漂白性,能使品红溶液褪色
SO2+CaO===CaSO3
SO2+H2O=H2SO3
2SO2 +O2====2SO3
SO2+2H2S=3S+2H2O
SO2 SO42-
KMnO4、FeCl3
1.火山爆发涉及硫的反应,下列关于硫的说法不正确的是( )A.试管内壁附着的硫可用二硫化碳溶解除去B.硫粉与铜粉混合加热反应生成Cu2SC.单质硫既有氧化性,又有还原性D.硫在过量纯氧中的燃烧产物是三氧化硫【解析】选D。硫燃烧时只能生成SO2,SO3可由SO2氧化制取,D项错误。
2.下列物质在一定条件下能够与硫黄发生反应,且硫作还原剂的是( )A.O2 B.Fe C.H2 D.Zn【解析】选A。硫与活泼非金属单质氧气反应时,表现出还原性;硫与金属单质、氢气等反应时,表现出氧化性;硫与变价金属反应时,一般生成低价金属的硫化物。
3.(2020·济南高一检测)二氧化硫的下列化学性质中,体现二氧化硫作为还原剂的是( )A.SO2在一定条件下与O2反应转化为SO3B.通入品红溶液中,使品红褪色C.溶于水形成不稳定的亚硫酸D.与碱液反应生成亚硫酸盐【解析】选A。SO2在一定条件下与O2反应转化为SO3,反应中二氧化硫硫元素化合价升高被氧化,二氧化硫作还原剂,A选;通入品红溶液中,使品红褪色是因为二氧化硫与有色物质化合生成无色物质,没有化合价变化,不是氧化还原反应,B不选;溶于水形成不稳定的亚硫酸,过程中没有化合价变化,不是氧化还原反应,C不选;与碱液反应生成亚硫酸盐,反应过程中没有化合价变化,不是氧化还原反应,D不选。
4.下列实验中能证明某气体为SO2的是( )①使澄清石灰水变浑浊 ②使湿润的蓝色石蕊试纸变红③使品红溶液褪色 ④通入足量NaOH溶液中,再滴加BaCl2溶液,有白色沉淀生成,该沉淀溶于稀盐酸 ⑤通入溴水中,能使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀产生A.都能证明 B.都不能证明C.③④⑤均能证明D.只有⑤能证明【解析】选D。①CO2也能使澄清石灰水变浑浊;②酸性气体均能使湿润的蓝色石蕊试纸变红;③Cl2也能使品红溶液褪色;④CO2、SO2均有此现象。
5.下列离子方程式正确的是( )A.向NaOH溶液中通入少量的SO2SO2+OH-==== B.向氯水中通入少量的SO2Cl2+SO2+2H2O====4H++2Cl-+ C.将SO2通入饱和的NaHCO3溶液中2H++ ====H2O+CO2D.将SO2通入BaCl2溶液中SO2+H2O+Ba2+====BaSO3+2H+【解析】选B。A项为SO2+2OH-==== +H2O;C项中应为2 +SO2==== +2CO2+H2O;D项中不反应。
素养新思维 6.SO2和Cl2常用于漂白,为探究SO2和Cl2的漂白性,某同学将足量的SO2和Cl2分别通入石蕊溶液中,通SO2的溶液只是变红,而通Cl2的溶液先变红后褪色。为了探索比较SO2和Cl2的漂白原理,该同学继续做了如下对比实验:a.将干燥的SO2和干燥的Cl2分别通到干燥的品红试纸上,发现红色试纸均不褪色;b.将SO2和Cl2分别通入品红溶液中,发现品红溶液均褪色;c.加热b中漂白后的溶液,发现前者恢复红色,并产生刺激性气味气体,后者不能;d.将SO2和Cl2分别持续通入紫色石蕊溶液中,发现前者只变红,不褪色,后者先变红,后褪色。
(1)由实验a可以得到什么结论?(科学探究与创新意识)(2)由实验a、b可以得到什么结论?(科学探究与创新意识)(3)由实验c、d可以得到什么结论?(科学探究与创新意识)
相关课件
这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物评课ppt课件,共52页。PPT课件主要包含了第一节硫及其化合物,新课情景呈现,课前素能奠基,理性质,第三周期第ⅥA族,刺激性,试管中液面上升,溶液红色褪去,恢复红色,SO2易溶于水等内容,欢迎下载使用。
这是一份化学必修 第二册第一节 硫及其化合物教学ppt课件,共47页。
这是一份2021学年第一节 硫及其化合物教案配套ppt课件,共56页。PPT课件主要包含了NO1,知识点一知识点二,二硫化碳,刺激性,生成物,反应物,正反应,逆反应,NO2,学习任务1学习任务2等内容,欢迎下载使用。









