











所属成套资源:2023版创新设计高考化学(新教材人教版)总复习一轮讲义
2023版创新设计高考化学(新教材人教版)总复习一轮讲义第九章 水溶液中的离子反应与平衡
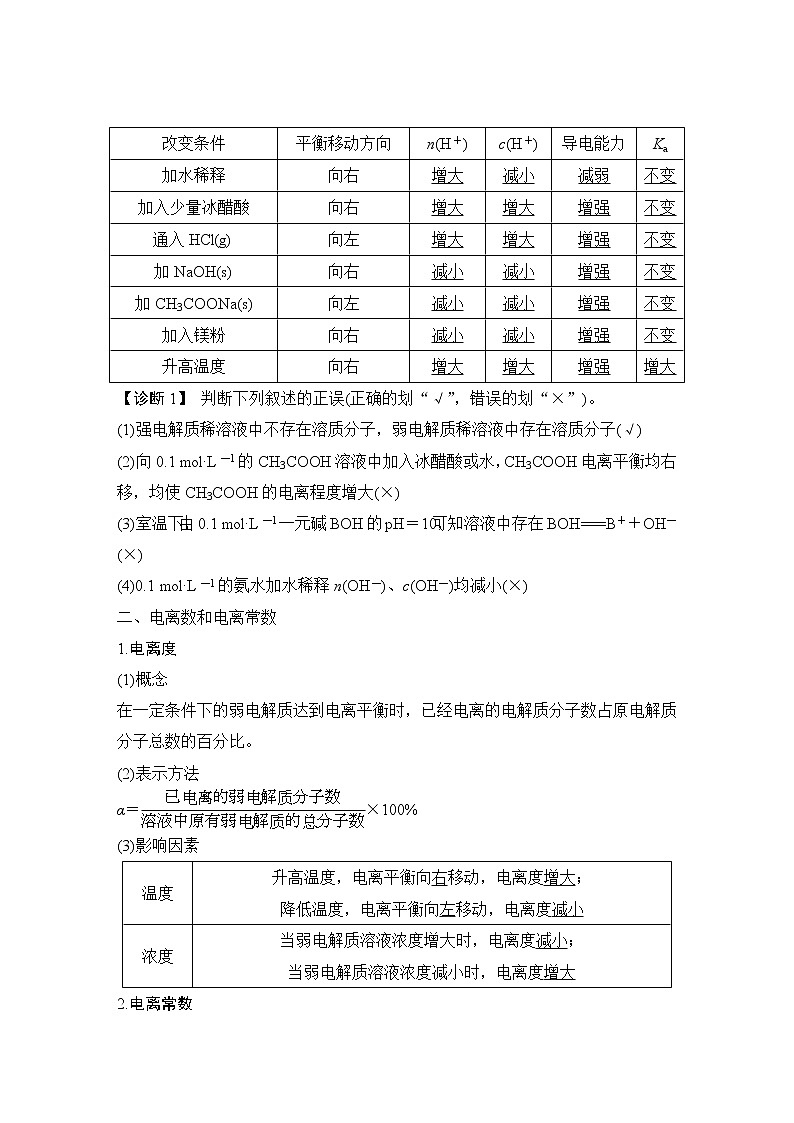
展开本章简答题答题语言规范强化练1.在80 ℃时,纯水的pH小于7,为什么? 答案 室温时,纯水中的c(H+)=c(OH-)=10-7 mol·L-1,又因水的电离(H2OH++OH-)是吸热过程,故温度升高到80 ℃,电离程度增大,致使c(H+)=c(OH-)>10-7 mol·L-1,即pH<7。2.甲、乙两瓶氨水的浓度分别为1 mol·L-1和0.1 mol·L-1,则甲、乙两瓶氨水中c(OH-)之比小于(填“大于”“等于”或“小于”)10。请说明理由。甲瓶氨水浓度是乙瓶氨水浓度的10倍,故甲瓶NH3·H2O的电离程度比乙瓶NH3·H2O的电离程度小,所以甲、乙两瓶氨水中c(OH-)之比小于10。3.利用浓氨水分解制备NH3,应加入NaOH固体,试用化学平衡原理分析NaOH的作用。答案 NaOH固体溶于氨水后放热促使NH3挥发;增大OH-浓度,使平衡NH3+H2ONH3·H2ONH+OH-逆向移动,加快氨气逸出。4.常温下,0.1 mol·L-1 NaHCO3溶液的pH大于8,则溶液中c(H2CO3)>(填“>”“=”或“<”)c(CO),原因是HCOCO+H+,HCO+H2OH2CO3+OH-,HCO的水解程度大于电离程度(用离子方程式和必要的文字说明)。5.(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式:MgCl2·6H2OMg(OH)Cl+HCl↑+5H2O↑,MgCl2·6H2OMgO+2HCl↑+5H2O↑或Mg(OH)ClMgO+HCl↑。(2)在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是在干燥的HCl气流中,抑制了MgCl2的水解,且带走MgCl2·6H2O受热产生的水蒸气,故能得到无水MgCl2。(3)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是分解出HCl气体,抑制CeCl3水解。6.用沉淀溶解平衡解答下列问题。(1)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。答案 加入MgCl2溶液,充分搅拌,过滤,沉淀用水洗涤。(2)Ba2+有很强的毒性,胃酸酸性很强(pH约为1),医学上进行消化系统的X射线透视时,服用大量BaSO4仍然是安全的,其原因是对于沉淀溶解平衡:BaSO4(s)Ba2+(aq)+SO(aq),H+不会影响Ba2+或SO的浓度,平衡不移动。(3)有一种工艺流程是通过将AgCl沉淀溶于氨水,从含金、银、铜的金属废料中来提取银。已知在溶解后的溶液中测出含有[Ag(NH3)2]+,试从沉淀溶解平衡移动的角度解释AgCl沉淀溶解的原因:AgCl固体在溶液中存在沉淀溶解平衡AgCl(s)Ag+(aq)+Cl-(aq),由于Ag+和NH3·H2O结合成[Ag(NH3)2]+,使Ag+浓度降低,导致AgCl的沉淀溶解平衡向着溶解的方向移动。(4)几种离子完全沉淀的pH物质(25 ℃)Fe(OH)2Cu(OH)2Fe(OH)3完全沉淀时的pH范围≥9.6≥6.4≥3除去CuSO4酸性溶液中的FeSO4,方法是首先滴加H2O2,将Fe2+完全转化为Fe3+,再慢慢加入CuO[或Cu2(OH)2CO3],调至3<pH<6.4,过滤。7.用0.1 mol·L-1的NaOH溶液分别滴定体积均为10 mL、浓度均为0.1 mol·L-1的HCl溶液和CH3COOH溶液,所得pH变化曲线如下:图Ⅱ是NaOH滴定CH3COOH的pH变化曲线,判断的理由是:CH3COOH为弱电解质,0.1__mol·L-1的CH3COOH的pH大于1。8.常考滴定终点的判断方法。(1)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再用KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+,滴定Ti3+时发生反应的离子方程式为Ti3++Fe3+===Ti4++Fe2+,达到滴定终点时的现象是当滴入最后半滴标准液,溶液变成红色,且半分钟内不褪色。(2)用标准酸性KMnO4溶液测定某补血口服液中Fe2+的含量时,酸性KMnO4溶液应放在酸式滴定管中,判断滴定终点的方法:滴入最后半滴酸性KMnO4溶液,溶液呈浅红色,且半分钟内不褪色。(3)测定维生素C(C6H8O6)含量的方法:向其溶液中加入过量的碘水,发生反应:C6H8O6+I2―→C6H6O6+2HI,然后用已知浓度的Na2S2O3滴定过量的碘,发生反应:(I2+2S2O===S4O+2I-),可选用淀粉溶液作指示剂,滴定终点的现象是滴入最后半滴Na2S2O3溶液,蓝色褪去,且半分钟不恢复。(4)已知:Ag++SCN-===AgSCN↓(白色)。实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应)。①称取2.000 g硝酸银样品,加水溶解,定容到100 mL。溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有100__mL容量瓶、胶头滴管。②准确量取25.00 mL溶液,酸化后滴入几滴铁铵矾[NH4Fe(SO4)2]溶液作指示剂,再用0.100 mol·L-1 NH4SCN标准溶液滴定。滴定终点的实验现象为当滴入最后半滴NH4SCN溶液,溶液变为红色,且半分钟内不褪色。





