





所属成套资源:2023版高考化学一轮总复习课件
2023版高考化学一轮总复习第十三章第一节原子结构与性质课件
展开这是一份2023版高考化学一轮总复习第十三章第一节原子结构与性质课件,共60页。PPT课件主要包含了价电子数,非金属等内容,欢迎下载使用。
[自主测评]1.易错易混辨析(正确的画“√”,错误的画“×”)。
(1)第二能层(L)上有 s、p、d、f 四个能级。(
(2)同一原子中,不同能层中同一能级,能量相同。(
(3)某原子核外电子排布为 ns2np7,它违背了能量最低原理。
)(4)第四周期元素中,Mn 原子价层电子未成对电子最多。)
(5)元素周期表中镧系元素和锕系元素都占据同一格,它们
(6)同周期元素,从左到右,原子半径逐渐减小,离子半径
错因:第二能层上有s、p 两个能级。
错因:不同能层中同一能级,能层序数越大能量越
高,如1s<2s<3s…,2p<3p<4p…。
错因:违背了泡利原理,每个轨道最多可容纳2 个
电子,np 能级有3 个轨道,p 轨道最多容纳6 个电子。
错因:第四周期元素Cr 原子价层电子3d54s1 中未成
错因:镧系元素和锕系元素都占据同一格,但是由
于核内质子数不相等,所以不是同位素。
错因:同一周期元素的离子半径不是逐渐减小的。
2.(教材选择性必修2 P28 第3 题改编题)以下有关元素性质
A.元素电负性:Na<P<OB.第一电离能:S>P>SiC.最高化合价:Mn>Cr>VD.离子半径:Cl->K+>Na+答案:B
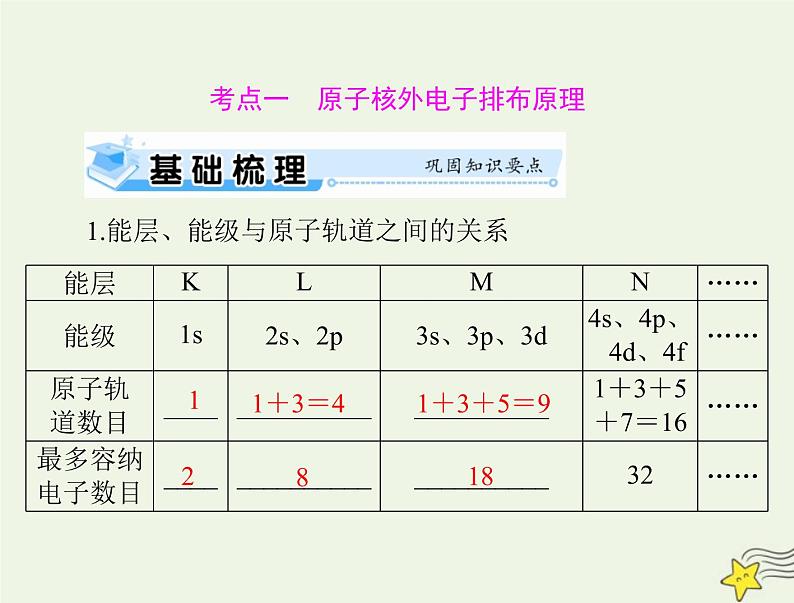
1.能层、能级与原子轨道之间的关系
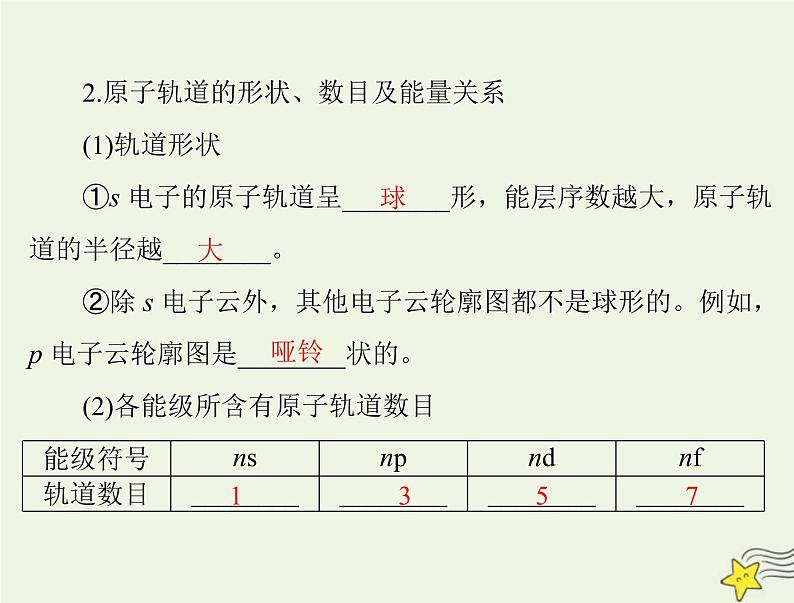
2.原子轨道的形状、数目及能量关系
①s 电子的原子轨道呈________形,能层序数越大,原子轨
道的半径越________。
②除 s 电子云外,其他电子云轮廓图都不是球形的。例如,p 电子云轮廓图是________状的。(2)各能级所含有原子轨道数目
3.基态原子核外电子排布
(2)填充顺序——构造原理
(3)核外电子排布的表示方法
4.原子状态和原子光谱
(1)基态原子:处于________能量状态的原子。(2)激发态原子:当基态原子________能量后,电子会跃迁到较高能级,变为激发态原子。(3)基态、激发态及光谱示意图
【练1】(2021 年河北区期末)下列说法中,正确的是(A.3s2 表示 3s 能级有两个轨道B.处于最低能量的原子叫做基态原子C.2p、3p、4p 能级的轨道数依次增多D.同一原子中,1s、2s、3s 电子的能量相同
解析:3s 能级只有 1 个轨道,3s2 表示 3s 能级有两个电子,A 错误;处于最低能量的原子叫做基态原子,B 正确;2p、3p、4p 能级的轨道数均为 3,C 错误;同一原子中,1s、2s、3s 电子的能量依次增大,D 错误。
【练2】(2021 年威海期末)下列说法正确的是(
A.玻尔的原子结构模型不但成功解释了氢原子光谱,而且还解释了其他原子光谱
B.基态氧原子轨道表示式
容原理C.在基态多电子原子中,p 轨道电子能量一定高于 s 轨道电子能量D.不同的能层所含的 s 能级的原子轨道数是不同的
解析:玻尔的原子结构模型成功解释了氢原子光谱是线状光谱的事实,但对多电子原子的光谱无法解释,A 错误;泡利不相容原理是每个轨道最多只容纳 2 个电子,且自旋相反,题中所给轨道式,违背了泡利不相容原理,B 正确;在多电子原子中,电子填充原子轨道时,电子按照能量由低到高的顺序填充,如 4s 的能量比 2p 高,C 错误;s 能级只有一个原子轨道,则不同的能层所含的 s 能级的原子轨道数是相同的,D 错误。
[归纳提升]正确理解排布依据(1)应用能量最低原理时,要注意原子轨道能量的高低,如能量 E3d>E4s。所以电子先排4s 轨道,再排3d 轨道,而失电子时,都先失4s 轨道上的电子。(2)书写轨道表示式时,空轨道不能省略。如C 的轨道表示
(3)半充满、全充满状态的原子结构稳定如 ns2、np3、np6、nd5、nd10Cr:3d54s1 Mn:3d54s2
(4)当出现d 轨道时,虽然电子按ns、(n-1)d、np 的顺序填充,但在书写时,仍把(n-1)d 放在 ns 前。
根据基态原子核外电子排布推断元素
【练3】(2021 年山东三模)短周期主族元素 X、Y、Z、W原子序数依次增大。基态 X 原子核外电子仅占据 5 个原子轨道且有 3 个未成对电子,Y 在周期表中位于ⅢA 族,Z 与 X 属于同一主族,基态 W 原子的核外有 1 个未成对电子。下列说法错
A.原子半径:Y>Z>WB.最高价含氧酸的酸性:W>X>ZC.简单氢化物的还原性:X>ZD.X、Y、Z 均可与 W 形成共价化合物
解析:基态 X 原子核外电子仅占据 5 个原子轨道且有 3 个未成对电子,则其核外电子排布式为 1s22s22p3,为 N 元素;Z与 X 属于同一主族,则 Z 为 P 元素;Y 在周期表中位于ⅢA 族,且原子序数大于 N,则 Y 为 Al 元素;基态 W 原子的核外有 1个未成对电子,且原子序数大于 P,则 W 为 Cl 元素。同周期主族元素自左至右原子半径依次减小,所以半径 Al>P>Cl,即 Y>Z>W,A 正确;非金属性越强,最高价含氧酸的酸性越强,非金属性:Cl>N>P,所以最高价含氧酸的酸性:W>X
>Z,B正确;非金属性越强,单质的氧化性越强,简单氢化物的还原性越弱,非金属性:N>P,则简单氢化物的还原性:Z>X,C 错误;N 可以和 Cl 形成共价化合物 NCl3,Al 可以和Cl 形成共价化合物 AlCl3,P 可以和 Cl 形成共价化合物 PCl3、PCl5,D 正确。
【练4】(2021年扬州模拟)短周期主族元素 X、Y、Z、W原子序数依次增大,其中 X、W 同主族,元素 X 的原子最外层电子数是其内层电子数的 3 倍,元素 W 基态原子的 3p 轨道上有 4 个电子,Y 是短周期中金属性最强的元素,Z 是地壳中含
量最多的金属元素。下列说法正确的是(
A.原子半径:r(W)>r(Z)>r(Y)>r(X)B.元素 Z、W 的最高价氧化物对应的水化物能发生反应C.元素 Z 的最高价氧化物对应水化物的碱性比 Y 的强D.元素 W 的简单气态氢化物的热稳定性比 X 的强
解析:元素 X 的原子最外层电子数是其内层电子数的 3 倍,则 X 为 O 元素;元素 W 基态原子的 3p 轨道上有 4 个电子,则其核外电子排布为[Ne]3s23p4,为 S 元素;Y 是短周期中金属性最强的元素,则为 Na 元素;Z 是地壳中含量最多的金属元素,则为 Al 元素。电子层数越多原子半径越大,电子层数相同核电荷数越小半径越大,所以原子半径:Na>Al>S>O,即 r(Y)>r(Z)>r(W)>r(X),A 错误;元素 Z、W 的最高价氧化物对应的水化物分别为 Al(OH)3 和 H2SO4 ,二者能发生中和反应,B正确;金属性:Na>Al,所以元素 Z 的最高价氧化物对应水化物的碱性比 Y 强,C 错误;非金属性:O>S,则简单气态氢化物的热稳定性:H2O>H2S,D 错误。
一、原子结构与元素周期表1.原子结构与周期表的关系(1)元素周期律、元素周期系和元素周期表①元素周期律:元素性质随着原子序数递增发生周期性的
②元素周期系:按其原子__________递增排列的序列称为元素周期系。③元素周期表:呈现元素周期系的表格。
2.构造原理与元素周期表
(1)核外电子排布与周期的划分
①电子排布与周期划分的本质联系
a.周期序数=电子层数。
b.本周期包含的元素种数=对应能级组所含原子轨道数的
2 倍=对应能级组最多容纳的电子数。
(2)核外电子排布与族的划分
①划分依据:取决于原子的价电子数目和价层电子排布。②特点:同族元素的价电子数目和价层电子排布相同。
③规律a.对于主族元素,同主族元素原子的价层电子排布完全相同,价电子全部排布在 ns1~2 或 ns2np1~5 轨道上(如表);价电子
c.稀有气体元素:价电子排布为 ns2np6(He 除外)。
(n-1)d1~10ns1~2
根据核外电子排布,可把元素周期表里的元素划分成5 个区:s 区、p 区、d 区、ds 区和f 区。除ds 区外,各区的名称来自按构造原理最后填入电子的能级的符号。
1.原子半径(1)影响因素
(2)递变规律①同周期:从左到右,核电荷数越大,半径________(稀有
②同主族:从上到下,__________越多,半径______。
(1)概念:_______________________失去一个电子转化为____________________ 所需要的________ 能量叫做第一电离
(2)元素第一电离能变化规律①对同一周期的元素而言,________________________的第一电离能最小,_________________________的第一电离能最大;从左到右,元素的第一电离能在总体上呈现从_____到_____
的变化趋势,表示元素原子越来越难失去电子。
②同族元素自上而下第一电离能________,表明自上而下
原子越来越________失去电子。
(3)电离能的应用:可以衡量元素的原子失去一个电子的难易程度。第一电离能数值越________,原子越容易失去一个电
子,元素金属性越________。
第一种元素(碱金属和氢)
最后一种元素(稀有气体)
3.电负性(1)键合电子和电负性的含义①键合电子:元素相互化合时,原子中用于形成________
②电负性:用来描述不同元素的原子对_________吸引力的大小。电负性越大的原子,对__________的吸引力_______。
以氟的电负性为________和锂的电负性为________作为相对标准,得出各元素的电负性(稀有气体未计)。
(3)递变规律(一般情况)
①同周期元素从左到右,元素的电负性逐渐________。②同主族元素从上到下,元素的电负性逐渐________。
(4)应用:判断金属性、非金属性强弱
【练1】(2021 年济宁期末)现有 4 种元素的基态原子的电子排布式如下:①1s22s22p3;②1s22s22p5;③1s22s22p63s23p3;
④1s22s22p63s23p4,则下列比较中正确的是(A.第一电离能:②>①>④>③B.原子半径:③>④>②>①C.电负性:②>①>④>③D.最高正化合价:②>③=①>④
解析:根据原子核外电子排布式可知①是 N 元素,②是 F元素,③是 P 元素,④是 S 元素,然后根据元素周期律分析解答。一般情况下,原子核外电子层数越少,第一电离能越大;当元素处于同一周期时,第一电离能随原子序数的增大而增大,若元素处于第ⅤA 族,电子处于轨道的半充满的稳定状态,第一电离能大于相邻元素,故上述四种元素的第一电离能大小关系为②>①>③>④,A 错误;原子核外电子层数越多,原子半径越大;同一周期元素原子序数越小,原子半径越大,则上述四种元素的原子半径大小关系为③>④>①>②,B 错误;
一般情况下,原子核外电子层数越少,元素的电负性越大;当元素处于同一周期时,元素的电负性随原子序数的增大而增大,所以上述四种元素的电负性大小关系为②>①>④>③,C 正确;一般情况下,元素最高化合价数值等于原子核外最外层电子数,但 F 由于原子半径小,得到电子能力强,没有+7价。N、P 最高价为+5价,S 最高价为+6价,所以上述四种元素的最高正化合价大小关系为④>③=①>②,D 错误。
子排布式为 3s23p4,下列说法不正确的是(
【练2】(2021年泰安期末)W、X、Y、Z、R 是五种短周期主族元素,原子序数依次增大。W 元素的一种离子与 Li+具有相同的电子层排布且半径稍大,X 原子核外 L 层的电子数与 Y原子核外 M 层的电子数之比为 3∶2,X 与 Z 同主族,Z 的价电
A.与 W 生成的气态化合物的热稳定性:Z>YB.W 与 Li 的原子半径:W
从上到下原子半径依次增大,则氢原子的原子半径小于锂原子,B 正确;非金属元素的非金属性越强,元素的第一电离能越大,则氧元素的第一电离能大于硅元素,C 正确;非金属元素的非金属性越强,元素的电负性越大,三种元素的非金属性强弱的顺序为 O>Cl>S,则电负性强弱的顺序为 S<Cl<O,D 错误。
【练3】(2021 年湖北期末)短周期主族元素 X、Y、Z、W的原子序数依次递增,基态 X 原子的最高能级的单电子数是 3,X、Y 形成的化合物较多,其中一种化合物为红棕色气体;Z、W 均为金属元素,其中基态 Z 原子最高能层与最低能层的电子
数之和是 L 层电子数的一半。下列说法正确的是(A.原子半径:W>Z>Y>XB.第一电离能:W>ZC.简单氢化物的沸点:Y>XD.W、Y 形成的化合物是碱性氧化物
解析:基态 X 原子的最高能级的单电子数是 3,即 P 能级有 3 个电子,结合短周期元素可初步推断基态 X 原子的核外电子排布为 1s22s22p3,则 X 为 N 元素,N 元素的化合物为红棕色气体的是 NO2,则 Y 为 O 元素;L 层为 8 个电子,则基态 Z 原子的最低能层与最高能层共 4 个电子,故其最高能级为 3s,且电子数为 2,故 Z 为 Mg 元素,W 为金属元素,且原子序数比Mg 大,则 W 为 Al 元素;X、Y、Z、W 的原子半径:
Z(Mg)>W(Al)>X(N)>Y(O),A 错误;因 Mg 的 3s 能级电子数为2,为全充满状态,而 Al 的 3p 能级只有 1 个电子,容易失去电子变为 3s 全充满的 2 个电子,故第一电离能:Mg>Al,B 错误;常温下,H2O为液态,而 NH3为气态,简单氢化物的沸点:Y >X,C 正确;Al2O3为两性氧化物, D 错误。
【练 4】(2021 年云浮期末)如图为周期表的一小部分,A、B、C、D、E 的位置关系如图所示。其中 B 元素最高化合价是最低化合价绝对值的 3 倍,它的最高价氧化物中含氧 60%。下
A.D、B、E 三种元素的第一电离能逐渐减小B.电负性:C>EC.D、B、E 三种元素形成的简单离子的半径逐渐增大D.气态氢化物的稳定性顺序:D<B<E
解析:B 元素最高化合价是最低负化合价绝对值的 3 倍,则 B 元素最高正价为+6 价,其最高价氧化物化学式表示为BO3,又最高氧化物中含氧 60%,令 B 元素相对原子质量为 b,
×100%=60%,解得 b=32,故 B 为 S 元素,由元
素在周期表中相对位置可知,A 为 O 元素、C 为 Se 元素、D 为P 元素、E 为 Cl 元素,非金属性越强,第一电离能越大,但 P元素的 3p 轨道电子半充满为稳定结构,则 E、D、B 三种元素
的第一电离能逐渐减小,A 错误;一般来说,同主族元素从上到下,元素的电负性减弱,同周期元素从左到右,电负性增大,则电负性:E>C,B 错误;D、B、E 三种元素形成的简单离子具有相同的核外电子排布,核电荷数越大离子半径越小,C 错误;非金属性:D(P)<B(S)<E(Cl),故氢化物稳定性:D<B<E,D 正确。
(1)判断元素金属性的强弱
电离能越小,金属越容易失去电子,金属性越强;反之越
(2)判断元素的化合价(I1、I2…表示各级电离能)
如果某元素的 In+1≫In,则该元素的常见化合价为+n 价。如钠元素:I2≫I1,所以钠元素的常见化合价为+1 价。
(3)判断核外电子的分层排布情况
多电子原子中,元素的各级电离能逐级增大,有一定的规律性。当电离能的变化出现突变时,电子层数就可能发生变化。
(4)反映元素原子的核外电子排布特点
同周期元素从左到右,元素的第一电离能并不是逐渐增大的,当能量相同的原子轨道在全空、半充满或全充满状态时,第一电离能就会反常的大,如 I1(N)>I1(O),I1(Mg)>I1(Al)。
【练5】(2021 年沈阳期末)X、Y 是同周期的两种非金属元素,不能说明 X 元素的非金属性比 Y 元素的非金属性强的事实
①将 X 的单质通入 HnY 溶液中产生 Y 单质
300 ℃,HnY 发生分解而 HmX 不分解
④电负性:X>Y ⑤单质的熔点:X
解析:X 与 HnY 溶液反应产生 Y 单质,说明 X 单质能置换出 Y 单质,故非金属性 X 强于 Y,①不符合题意;HmX 的热稳定性强于 HnY,X 元素的非金属性比 Y 元素的强,②不符合题意;第一电离能指气态电中性基态原子失去一个电子转化为气态基态正离子所需的最低能量,存在反常现象,如:I1(N)>I1(O),但非金属性:O>N,故第一电离能不能说明非金属性强弱关系,③符合题意;元素的非金属性越强,电负性越大,电负性:X>Y,能说明非金属性 X 比 Y 强,④不符合题意;熔点属于物理性质,非金属性属于化学性质,两者无一定关系,
故不能说明非金属性强弱关系,⑤符合题意;HCl 为强酸,HF为弱酸,相同条件下酸性:HCl>HF,而非金属性:F>Cl,故气态氢化物的水溶液的酸性强弱不能说明非金属性强弱关系,⑥符合题意;YmXn 中 X 元素显负价,说明 X 吸引电子能力强,电负性:X>Y,故非金属性:X>Y,能说明非金属性强弱关系,⑦不符合题意。
【练6】(2021年青岛期末)下列价电子排布对应的基态原
子中,电负性最大的是(A.2s22p1C.2s22p4
解析:可以先根据价电子排布推出具体的原子,再比较电负性。选项 A、B、C、D 对应的元素分别为 B、N、O、S;其中电负性最大的是 O。答案:C
(1)判断元素的金属性和非金属性
①金属元素的电负性一般小于1.8,非金属元素的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8 左右,它们既有金属性,又有非金属性。②金属元素的电负性越小,金属元素越活泼;非金属元素
的电负性越大,非金属元素越活泼。
(2)判断元素的化合价
①电负性数值小的元素在化合物中吸引电子的能力弱,元
②电负性数值大的元素在化合物中吸引电子的能力强,元
(3)判断化学键的类型一般认为:
①如果两个成键元素原子间的电负性差值大于1.7,它们之
②如果两个成键元素原子间的电负性差值小于1.7,它们之
(4)解释元素“对角线规则”
在元素周期表中,某些主族元素与其右下方的主族元素(如图所示)的有些性质是相似的,这种相似性被称为“对角线规则”。
1.(2021年广东卷)“天问一号”着陆火星,“嫦娥五号”采回月壤。腾飞中国离不开化学,长征系列运载火箭使用的燃
料有液氢和煤油等化学品。下列有关说法正确的是(A.煤油是可再生能源B.H2 燃烧过程中热能转化为化学能C.火星陨石中的 20Ne 质量数为 20D.月壤中的 3He 与地球上的 3H 互为同位素
解析:煤油是石油分馏的产物,不属于可再生能源,A 错误;H2 燃烧过程中化学能转化为热能,B 错误;元素左上角的数字表示质量数,20Ne 质量数为 20,C 正确;同一元素中质子数相同、中子数不同的各种原子称为同位素,He 和 H 是不互为同位素,D 错误。
2.(2021 年山东卷节选)非金属氟化物在生产、生活和科研
中应用广泛。回答下列问题:
(1)基态 F 原子核外电子的运动状态有________种。(2)O、F、Cl 电负性由大到小的顺序为________。
解析:(1)基态 F 原子共有 9 个核外电子,则每个电子都有对应的轨道和自旋状态,所以核外电子的运动状态有 9 种。(2)电负性一定程度上相当于得电子能力,半径越小,得电子能力越强,电负性越大,半径由小到大的顺序为 F、O、Cl,所以电负性大小顺序为 F>O>Cl。
答案:(1)9 (2)F>O>Cl
3.(2021 年全国乙卷节选)过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
对于基态 Cr 原子,下列叙述正确的是________(填标号)。A. 轨道处于半充满时体系总能量低,核外电子排布应为
B.4s 电子能量较高,总是在比 3s 电子离核更远的地方运动C.电负性比钾高,原子对键合电子的吸引力比钾大
解析:基态原子满足能量最低原理,Cr 有 24 个核外电子,轨道处于半充满时体系总能量低,核外电子排布式应为[Ar]3d54s1,A 正确;Cr 核外电子排布式为[Ar]3d54s1,由于能级交错,3s 轨道能量高于 4s 轨道的能量,即 3s 电子能量较高,B 错误;电负性为原子对键合电子的吸引力,同周期除零族原子序数越大电负性越强,钾与铬位于同周期,铬原子序数大于钾,故铬电负性比钾高,原子对键合电子的吸引力比钾大,C正确。
4.(2020 年全国Ⅰ卷节选)Gdenugh 等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019 年诺贝尔化学奖。回答下列问题:
(1)基态 Fe2+与 Fe3+离子中未成对的电子数之比为_______。(2)Li 及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)> I1(Na),原因是________________________________________________________________________________________。I1(Be)> I1(B)> I1(Li) ,原因是__________________________________________________________________________________。
解析:(1)基态铁原子的价电子排布式为 3d64s2,失去外层电子转化为 Fe2+和 Fe3+,这两种基态离子的价电子排布式分别为 3d6 和 3d5,根据洪特规则可知,基态 Fe2+有 4 个未成对电子,基态 Fe3+有 5 个未成对电子,所以未成对电子个数比为 4∶5。(2)同主族元素,从上至下,原子半径增大,第一电离能逐渐减小,所以 I1(Li)>I1(Na);同周期元素,从左至右,第一电离能呈现增大的趋势,但由于第ⅡA 族元素基态原子 ns 能级轨道处于全充满的状态,能量更低更稳定,所以其第一电离能大于同一周期的ⅢA 族元素,因此 I1(Be)>I1(B)>I1(Li)。
答案:(1)4∶5(2)Na 与 Li 同主族,Na 的电子层数更多,原子半径更大,
Li、Be 和 B 为同周期元素,同周期元素从
左至右,第一电离能呈现增大的趋势,但由于基态 Be 原子的ns 能级轨道处于全充满状态,能量更低更稳定,故其第一电离能大于 B 的
5.(2020年全国Ⅱ卷节选)钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态 Ti 原子的核外电子排布式为________。
(2)CaTiO3 的晶胞如图所示,其组成元素的电负性大小顺序是________;金属离子与氧离子间的作用力为________。
解析:(1)钛元素是 22 号元素,故其基态原子的核外电子排布式为 1s22s22p63s23p63d24s2或[Ar]3d24s2。 (2)CaTiO3 晶体中含有 Ca、Ti、O 三种元素,Ca、Ti 是同为第四周期的金属元素,Ca 在 Ti 的左边,根据同一周期元素的电负性从左往右依次增大,故 Ti>Ca,O 为非金属,故其电负性最强,故三者电负性由大到小的顺序是 O>Ti>Ca,金属离子和氧离子之间的作用力为离子键。
答案:(1)1s22s22p63s23p63d24s2
相关课件
这是一份2024届高考化学一轮总复习第十二章物质结构与性质第一节原子结构与性质课件,共56页。PPT课件主要包含了逐渐减小,②判断元素的化合价,3DC,答案D,哑铃纺锤形,4CD,答案A等内容,欢迎下载使用。
这是一份2024年高考化学一轮复习第十二章第一节原子结构与性质课件,共56页。PPT课件主要包含了逐渐减小,②判断元素的化合价,3DC,答案D,哑铃纺锤形,4CD,答案A等内容,欢迎下载使用。
这是一份人教版高考化学一轮复习11.1原子结构与性质课件












