




所属成套资源:2023版高考化学一轮总复习课件
2023版高考化学一轮总复习第五章第二节氮及其化合物课件
展开
这是一份2023版高考化学一轮总复习第五章第二节氮及其化合物课件,共60页。PPT课件主要包含了向上排空气,N2+3H2,2NH3等内容,欢迎下载使用。
[自主测评]1.易错易混辨析(正确的画“√”,错误的画“×”)。
(1)除去 NO 中 NO2,除杂试剂为 H2O、无水 CaCl2。(
(2)NO 中的 NO2 杂质气体,可通过盛有水的洗气瓶除去。
(3)NO2 是酸性氧化物,与水反应生成硝酸。(
(4)用 Ba(OH)2 溶液鉴别 NH4Cl、(NH4)2SO4 和 K2SO4。(
(5)液氨和氨水在组成上相同。(
(6)可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气。
(7)稀硝酸可除去试管内壁的银镜。(
(8)Cu 在 KNO3 溶液和稀 H2SO4 中均不溶解,但能溶解在其
混合液中。(答案:(1)√
(3)×(4)√(5)×(6)√
错因:NO2 不是酸性氧化物,硝酸不是NO2 的水合错因:液氨是纯净物,氨水属于混合物。(7)√ (8)√
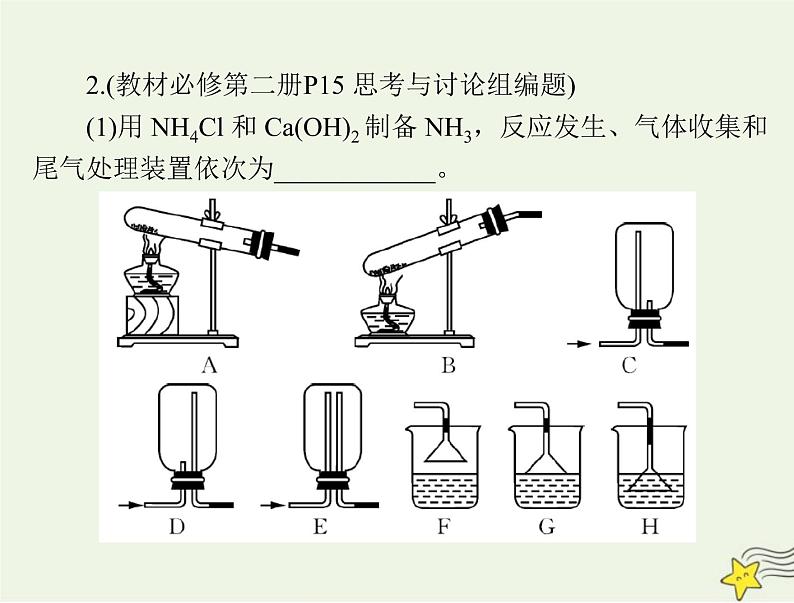
2.(教材必修第二册P15 思考与讨论组编题)
(1)用 NH4Cl 和 Ca(OH)2 制备 NH3,反应发生、气体收集和
尾气处理装置依次为____________。
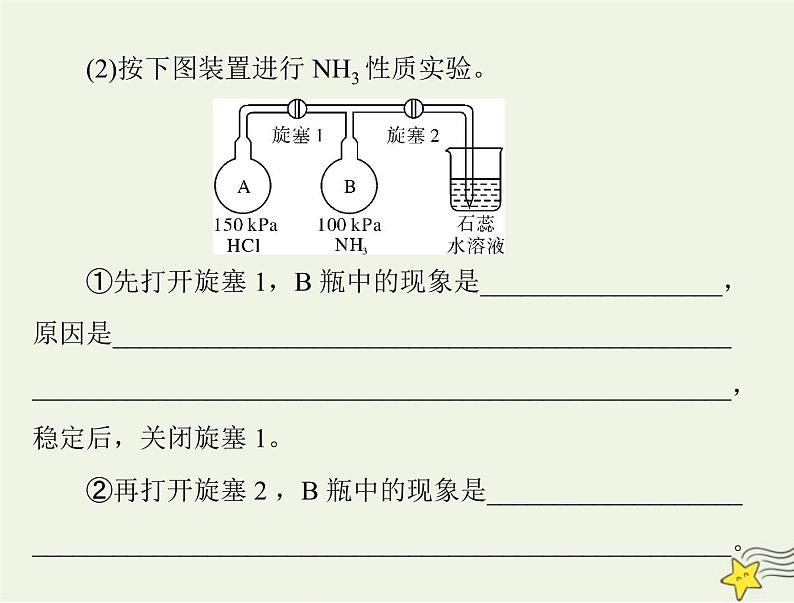
(2)按下图装置进行 NH3 性质实验。
①先打开旋塞 1,B 瓶中的现象是__________________,原因是__________________________________________________________________________________________________,稳定后,关闭旋塞 1。
②再打开旋塞 2 ,B 瓶中的现象是___________________
____________________________________________________。
答案:(1)A、C、G
A 瓶中的氯化氢移动到 B 瓶中,与 B 瓶
中的氨气反应生成氯化铵,能看到白烟②液体进入 B 瓶中,溶液的颜色变红
3.(教材必修第二册P15 实验5-8 组编题)(2021年长沙月考)用动态观点理解 Cu 与浓硝酸的反应,在浓硝酸中放入 Cu 片。(1)反应开始时的化学方程式为______________________,实验现象为__________________________________________。(2) 若 Cu 片有剩余,则反应将要结束时的化学方程式为___________________________________________________。(3)待反应停止后,再加入少量的稀硫酸,这时 Cu 片上又有气泡产生,原因是________________________________________________________________________________________。
答案:(1)Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O溶液逐渐变蓝色,有红棕色气体逸出
(2)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
(3)加入稀硫酸后,氢离子与原溶液中的硝酸根离子构成强
氧化性硝酸,又能与过量的铜反应
1.自然界中氮的存在和氮的固定
(1)物理性质:________色________味的气体,密度比空气略小,________溶于水。(2)化学性质
写出有关反应的化学方程式:
①_________________________________;②____________________________________;③____________________________________。3.氮的氧化物(1)氮有多种价态的氧化物
(2)NO 和 NO2 的比较
(1)N2O俗称笑气,有麻醉作用;N2O3是亚硝酸的酸酐;N2O5
(2)氮的氧化物的危害:NOx 在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾,称为光化学烟雾。NO2 可使平流层中的臭氧减少,破坏臭氧层,导致地面紫外线辐射增强。NO与血红蛋白结合使人中毒。NOx 参与酸雨的形成。
(3)验证某无色气体是NO 的方法是向无色气体中通入O2
(或空气),无色气体变为红棕色。
(4)鉴别溴蒸气和NO2 不能用淀粉KI 试纸、碱溶液等,但
可以利用它们性质上的差异性来鉴别。
①通入水中,NO2 溶于水发生反应:3NO2+H2O===2HNO3+NO,反应后溶液呈无色,而溴蒸气溶于水后溶液呈橙色。②通入AgNO3 溶液中,有淡黄色沉淀生成的为溴蒸气(Br2+H2O===HBr+HBrO,HBr+AgNO3===AgBr↓+HNO3),无此现象的为NO2。
③通入CCl4 有机溶剂中,易溶于CCl4 且CCl4 溶液呈橙红
色的为Br2(g),无此现象的为NO2。
【练1】(2021年肃宁期末)氮在自然界中的循环如下图所示。
(1)过程①称为________,写出合成氨反应的化学方程式:
_____________________________________________________
_____________________________________________________,
该反应中氮气显________性(填“氧化”或“还原”)。(2)过程②中能通过________ 的作用将空气中的氮气固定下来,写出③中固氮反应的化学方程式:_____________________________________________________________________,该反应中氮气显________性。
N2+O2=====2NO
答案:(1)人工固氮(2)豆科植物根瘤菌
【练2】(2021年惠州调研)下列物质转化关系,在给定条
解析:①根据 N2 的性质,氮气和氧气在放电条件下生成
NO,NO 和氧气、水反应生成硝酸,故①N2
HNO3 能实现;②钠燃烧生成过氧化钠,过氧化钠与二氧化碳反应生成碳酸钠和氧气,故②能实现;③铜属于不活泼金属,与浓盐酸不反应,故③中铜→氯化铜不能实现;④铁和氯气生成氯化铁,氯化铁能和氨水反应生成氢氧化铁,故
FeCl3 Fe(OH)3 能实现。答案:A
[归纳提升]俗话说“雷雨发庄稼”,这说明雷雨中含有能被植物吸收利用的化合态的氮。有关的化学方程式如下:
2NO;②2NO+O2===2NO2;
③3NO2+H2O===2HNO3+NO。
NO、NO2 的性质实验探究
【练3】(2021 年广东模拟节选)为了有效实现 NO 和 NO2的相互转化,设计如下实验:按图组装好实验装置,并检查装置气密性,实验前用排水法收集半瓶 NO 气体。
(1)打开止水夹,推动针筒活塞,使氧气进入烧瓶。关上止水夹,首先观察到烧瓶中的现象是_____________________________________________________________________________,产生此现象的化学方程式为__________________________________________________________________________________。(2)轻轻摇动烧瓶,观察到烧瓶中的现象为①___________________________;②________________________。
产生此现象的化学方程式为___________________________________________________________________________________。
解析:(1)无色的 NO 能与 O2 反应产生红棕色的 NO2。(2) 轻轻摇动烧瓶 , 使得 NO2 与水发生反应 3NO2 +H2O===2HNO3+NO,所以烧瓶中红棕色气体又变为无色,因为烧瓶内气体的量减少,引起烧瓶内气体的压强减小,所以烧杯内的水会倒吸入烧瓶中,使烧瓶中液面上升。
答案:(1)气体由无色变为红棕色(2)烧瓶中红棕色气体又变为无色
2NO+O2===2NO2烧杯中的水倒吸入烧
3NO2+H2O===2HNO3+NO
【练4】(2021 年湖南模拟)用如图所示装置探究 Cl2 和 NO2在 NaOH 溶液中的反应,若通入适当比例的 Cl2 和 NO2,即发生反应 Cl2+2NO2+4NaOH===2NaNO3+2NaCl+2H2O。
A.实验室中用二氧化锰与 1 ml·L-1 的盐酸共热制备氯气B.装置Ⅰ中盛放的试剂是浓硫酸,作用是干燥氯气C.装置Ⅲ的作用是便于控制通入 NO2 的量D.若制备的 NO2 中含有 NO,应将混合气体通入水中以除去 NO
解析:实验室中用二氧化锰与浓盐酸共热制取氯气,而
1 ml·L-1 的盐酸是稀盐酸,因此不能发生反应制取氯气,A 错
误;该实验不需要保证氯气是干燥的,所以装置Ⅰ中盛放的试剂是饱和 NaCl 溶液,作用是除去氯气中的杂质 HCl 气体,B错误;由于 NO2 气体不能在 CCl4 中溶解,气体通过装置Ⅲ,可根据导气管口气泡的多少,观察气体流速,因此其作用是便于控制通入 NO2 的量,C 正确;若制备的 NO2 中含有 NO,将混合气体通入水中,会发生反应:3NO2+H2O===2HNO3+NO,最后导致气体完全变为 NO,D 错误。
氮的氧化物与水的反应有关计算
【练5】(2021年莆田期末)将盛有 12 mL NO2 和 O2 的混合气体的量筒倒立于水槽中,充分反应后,还剩余 2 mL 无色气体,
则原混合气体中 O2 的体积和剩余的 2 mL 气体分别是(
A.1.2 mL,NOC.3.5 mL,O2
B.2.4 mL,O2D.4 mL,NO
①若剩O2,则V剩=x-—×(12mL-x)=2mL,
②若剩NO,则V剩=—×[(12mL-x)-4x]=2mL,
解析:解题依据的化学方程式:4NO2+O2+2H2O===4HNO3;3NO2+H2O===2HNO3+NO。
设 O2 的体积为 x,剩余的气体有两种可能:
解得 x=4 mL,B、C 两项均不正确;
解得 x=1.2 mL,D 不正确,A 正确。答案:A
【练6】(2021年辽宁期末)将 40 mL NO2 和 NO 的混合气体通入倒立在水槽中盛满水的试管中,充分反应后试管中剩下
20 mL 气体,则原混合气体中 NO2 和 NO 的体积比为(
解析:3NO2+H2O===2HNO3+NO ΔV
V(NO2) 20 mL3 2
得,V(NO2)=30 mL。
V(NO)=40 mL-30 mL=10 mL,V(NO2)∶V(NO)=30 mL∶10 mL=3∶1。答案:C
氮氧化物与O2、H2O反应的计算
①NO 和O2 通入水中
由2NO+O2===2NO2 和3NO2+H2O===2HNO3+NO得总
反应为4NO+3O2+2H2O===4HNO3
②NO2 和O2 混合气体通入水中
由3NO2+H2O===2HNO3+NO 和2NO+O2===2NO2 得总
反应为4NO2+O2+2H2O===4HNO3
③NO、NO2 和O2 三种气体通入水中
先按3NO2+H2O===2HNO3+NO 计算出生成的NO 体积,
然后加上原来混合气体中NO 体积,再按①计算。
当NOx 转化为硝酸时要失去电子,如果是NOx 与O2 混合,则反应中O2 得到的电子数与NOx 失去的电子数相等。
4NO2+O2 和4NO+3O2 从组成上均相当于2N2O5 的组成,都与N2O5+H2O===2HNO3 等效。当NO、NO2、O2 的混合气体通入水中时利用混合气体中N、O 原子个数比进行分析判断。
N(N)∶N(O) =2∶5 恰好完全反应
(1)氨的分子结构和物理性质
①原理:在短时间内使烧瓶内外产生较大的压强差,利用大气压将烧瓶下面烧杯中的液体压入烧瓶内,在尖嘴导管口形成喷泉。
a.HCl、NH3、V(NO)∶V(O2)=4∶3、V(NO2)∶V(O2)=4∶1
b.HCl、CO2、Cl2、SO2 溶于 NaOH 溶液。
铵盐都是____色固体,均易溶于水。
(3)NH 4 的检验
生成使湿润的____色石蕊试纸变
(1)制取氨时,不能用硝酸铵代替氯化铵。因为硝酸铵在加
热过程中可能发生爆炸性的反应,发生危险。
(2)制取氨时,不能用氢氧化钠代替熟石灰。因为氢氧化钠具有吸湿性,易结块,不利于产生NH3,且在加热条件下易腐蚀试管。
(3)氨是碱性气体,不能用酸性干燥剂(浓硫酸等)干燥,也不能用无水CaCl2 干燥,因为它们均能与氨发生反应,常用碱石灰做干燥剂。
【练1】(2021 年江苏白蒲高级中学期末)某实验兴趣小组利用如图实验装置探究氯气与过量氨气反应的实验,下列有关
A.打开 K1,关闭 K2,将注射器的活塞往外拉一段,然后松
开,活塞复原,说明装置气密性良好
B.打开 K1,推动注射器的活塞使过量的氨气与氯气混合时,
C.充分反应后,关闭 K1,打开 K2,可观察到烧杯中的溶液
D.实验室制备氨气和氯气可以用同一套发生装置
解析:打开 K1,关闭 K2,将注射器的活塞往外拉一段,然后松开,活塞复原,说明装置气密性良好,A 正确;氨气与氯气反应生成氯化铵固体,所以看到产生大量白烟,B 错误;充分反应后,关闭 K1,打开 K2,装置内气体反应后压强减小,打开 K2,在外界大气压作用下,烧杯中的溶液会倒吸至试管内,C 正确;气体发生装置的选择是依据反应物聚集状态和反应条件,实验室制备氨气可以用加热浓氨水方法,实验室制备氯气用加热二氧化锰和浓盐酸,所以二者可以用同一套发生装置,D 正确。答案:B
关分析或预测错误的是(
【练 2】(2021 年潍坊月考)如图是氮及其化合物的“价—类”二维图,结合二维图及氧化还原反应的基本规律,下列相
A.硝酸具有较强的氧化性,可用稀硝酸清洗“银镜实验”
B.NO、NO2 和 NH3 在一定条件下均能反应,可用氨气处理
C.可用加热 NH4NO3 的方法制取氨气
D.联氨(N2H4)可能被亚硝酸(HNO2)氧化生成氢叠氮酸 HN3
解析:HNO3 中氮元素为+5 价,具有强氧化性,稀硝酸能氧化许多不活泼的金属,如 Cu、Ag 等,A 正确;由题图可知NO、NO2 和 NH3 在一定条件下均能发生归中反应,产物是氮气和水,氨气可用于处理氮氧化物,B 正确;分析 NH4NO3 中氮元素价态可知,其可能发生自身的氧化还原反应,所以其受热分解产物不一定有 NH3,故不能加热 NH4NO3 来制备 NH3,C错误;依据价态分析,N2H4(氮为-2 价)和 HNO2(氮是+3 价)
反应可能生成 HN3答案:C
氨气制备与性质综合探究
【练3】(2020年滕州第一中学月考)氨催化氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示装置。
(1)某同学想用下列装置及试剂方便快速地制取少量氨气。化学试剂:①NH4Cl 固体、②浓氨水、③NaOH 固体。
应选择的装置是 ________( 填 字 母 ) , 选 用 的 试 剂 是
________(填序号)。
选用上述试剂制氨气的理由是________________________________________________________________________。实验过程中,制气时的实验操作是________________________________________________________________________。(2)乙装置的作用是_______________________________;写出受热时丙装置中发生反应的化学方程式: ________________________________________________________________。
(3)当戊中观察到________现象,则说明已制得硝酸。某同学按上图组装仪器并检验装置气密性后进行实验,没有观察到此现象,请分析实验失败的可能原因是:______________________________________________________________________,如何改进装置________________________________________。(4)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是_______________________________________________________________________________________。
NaOH 固体遇水放热,使氨气的溶解
NH3+H2O平衡向右移动,从而使氨气逸出
氨水逐滴滴加到 NaOH 固体上(2) 干燥氧气和氨的混合气体
(3)紫色石蕊溶液变红
的氨致使戊中溶液不一定呈酸性
在丙和丁之间连接盛有无水
氯化钙的干燥管或盛有浓硫酸的洗气瓶
慢上升,上升到一定高度不再变化,试管内气体颜色由红棕色逐渐变淡至无色
度降低,同时可使溶液中c(OH-)增大,促使NH +OH-
【练4】(2021年衡水中学月考)某化学兴趣小组利用以下装置探究氯气与氨气之间的反应。其中装置 A、F 分别为氨气和氯气的发生装置,装置 C 为纯净干燥的氯气与氨气发生反应的装置。回答下列问题:
(1)仪器 a 的名称为________。装置 A 的圆底烧瓶中盛放的固体物质可选用________(填字母)。
(2)装置 B、D 的作用均为________。从装置 C 的 b 处逸出的尾气中含有少量 Cl2,为防止其污染环境,可将尾气通过盛有________溶液的洗气瓶。(3)装置 F 的圆底烧瓶中发生反应的离子方程式为_____________________________________________________ 。 装 置 E的作用是除去 Cl2 中的 HCl,洗气瓶中盛放的试剂为_______。
(4)反应过程中,装置 C 的集气瓶中有大量白烟产生,另一种产物为 N2,该反应的化学方程式为__________________________________________________________________________。解析:(1)据图可知,仪器 a 是分液漏斗;氢氧化钠具有吸水性,氢氧化钠溶解时放出大量的热,促进浓氨水挥发,可快速制取氨气。(2)制取的氨气和氯气中均混有水蒸气,装置 B 中盛装的碱石灰、D 中盛装的浓硫酸均可以除去水蒸气,起干燥气体的作用;氯气有毒,能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收尾气中的氯气。(3)二氧化锰与浓盐酸在加热条
Mn2++Cl2↑+2H2O;浓盐酸易挥发,制得的
(3)MnO2+4H ++2Cl-
Mn2++Cl2↑+2H2O
件下反应生成氯气、氯化锰和水,反应的离子方程式为 MnO2
氯气中含有 HCl 杂质,通过盛有饱和食盐水的洗气瓶可以除去HCl 杂质。(4)反应过程中,装置 C 的集气瓶中有大量白烟产生,说明生成的产物有氯化铵,另一种产物为 N2,则该反应的化学方程式为 8NH3+3Cl2===6NH4Cl+N2。
答案: (1)分液漏斗
(2)除去水蒸气( 或干燥气体 )
(4)8NH3+3Cl2===6NH4Cl+N2
实验室制取氨的其他方法
【练5】(2020 年全国Ⅲ卷)喷泉实验装置如图所示。应用
下列各组气体-溶液,能出现喷泉现象的是(
解析:H2S 与稀盐酸不反应,且在稀盐酸中的溶解度较小,向圆底烧瓶中挤入少量稀盐酸,不能造成圆底烧瓶内气压明显减小,不能形成喷泉,A 错误;HCl 能与稀氨水反应,向圆底烧瓶中挤入少量稀氨水会造成圆底烧瓶内气压明显减小,能形成喷泉,B 正确;NO 与稀硫酸不反应,且在稀硫酸中溶解度非常小,向圆底烧瓶中挤入稀硫酸,不能造成圆底烧瓶内气压明显减小,不能形成喷泉,C 错误;CO2 在饱和 NaHCO3 溶液中的溶解度较小,向圆底烧瓶中挤入饱和 NaHCO3 溶液,不能造成圆底烧瓶内气压明显减小,不能形成喷泉,D 错误。
【练6】喷泉是一种常见的自然现象,其产生原因是存在
(1)图甲为化学教学中常用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中盛有液体。①下列组合中不可能形成喷泉的是________。
A.HCl 和 H2OC.NH3 和 H2O
B.O2 和 H2OD.CO2 和 NaOH 溶液
E.NO2 和 H2O②若用 D 组合做喷泉实验,烧杯中的液体一定是 NaOH 溶液吗?_____________________________________________________________________________________________________。
烧瓶中溶质的物质的量浓度是______________ml·L-1。
③用 A 组合做喷泉实验时,若烧瓶中充满 HCl 气体,则在标准状况下,做完实验后烧瓶中 c(HCl)=_______ml·L-1(假设溶质不扩散)。
④若用 E 组合做喷泉实验时,则标准状况下,做完实验后
(2)某学生积极思考产生喷泉的其他办法,并设计了如图乙
①在图乙的锥形瓶中,分别加入足量的下列物质,反应后
可能产生喷泉的是________。
A.Cu 与稀盐酸C.CaCO3 与稀硫酸
B.NaHCO3 与 NaOH 溶液D.NH4HCO3 与稀盐酸
这种方法产生喷泉的原理是______________________________________________________________________________。②在图乙锥形瓶外放一水槽,瓶中加入酒精,水槽中加入水后,再加入足量的下列物质,结果也产生喷泉。水槽中加入的物质可以是________。
这种方法产生喷泉的原理是__________________________________________________________________________。③比较图甲和图乙两套装置,从产生喷泉的原理来分析,图甲是________(填“增大”或“减小”,下同)上部烧瓶内气体压强;图乙是________下部锥形瓶内气体压强。
(3)城市中常见的人造喷泉及火山爆发的原理与上述_____
(填“图甲”或“图乙”)装置的原理相似。
解析:(1)①B 中 O2 难溶于水,不能使烧瓶中的压强减小。②只要烧杯中的物质能把 CO2 几乎完全吸收,使烧瓶中的压强减小,即可形成喷泉。(2)①NH4HCO3 与盐酸反应产生CO2气体,使锥形瓶内的压强增大。②浓 H2SO4 溶于水放出大量的热使酒精挥发,锥形瓶内压强增大。
②不一定,只要烧杯中盛有的浓碱溶液足
以把烧瓶中的 CO2 吸收即可
锥形瓶中发生反应:NH4HCO3+HCl===NH4Cl+
CO2↑+H2O,随着 CO2 气体的产生,锥形瓶中的压强增大而产
浓 H2SO4 溶于水时,放出大量的热,温度
升高使锥形瓶中的酒精挥发加快,瓶内压强增大,从而形成“喷
压强差原理在实验中的应用
(1)气密性检查:装置形成封闭体系→操作(微热、手捂、热
毛巾捂、加水等)→描述现象→得出结论。
(2)防倒吸:根据气体溶解度的大小造成装置系统内压强降低容易倒吸的现象,对吸收装置加以改进,从而起到防止倒吸的作用。如:
(3)防堵塞:A 装置中的橡皮管作用是平衡烧瓶和分液漏斗内的气压,便于分液漏斗内的液体顺利流下,可以起到防止堵塞的作用;B 装置中有一根导气管通大气,当气体产生速率过快而气压增大,或导气管堵塞而气压增大时,均可将瓶内的液体压入导气管甚至冲出,以平衡气压,防止堵塞;C 装置中将b 和 c 管连通,其原理与 A 装置相同,也能防堵塞。
(4)清洗仪器:清洗下列装置的操作是向g 中加蒸馏水;打开k1,关闭k2、k3,加热 b,水蒸气充满管路;停止加热,关闭k1,由于c、e及连接的管道内水蒸气冷凝后,装置内压强减小,小于外界大气压,故g 中蒸馏水倒吸进入 c 中,然后打开k2 放掉水,重复操作2~3 次,即可达到洗涤目的。
考点三1.硝酸的物理性质
2.硝酸的化学性质加热或光照(1) 不稳定性:4HNO3( 浓)=========== 2H2O +4NO2↑+O2↑。
(2)强氧化性:硝酸无论浓、稀都有强氧化性,而且浓度越
8HNO3(稀)+3Cu===3Cu(NO3)2+2NO↑+4H2O
4HNO3(浓)+Cu===Cu(NO3)2+2NO2↑+2H2O
4HNO3(浓)+C CO2↑+4NO2↑+2H2O
3.工业制备硝酸原理其反应的化学方程式为
①N2+3H2②4NH3+5O2
2NH3 4NO+6H2O
③2NO+O2===2NO2④3NO2+H2O===2HNO3+NO
(1)来源:煤、石油和某些金属矿物中含有硫,在燃烧或冶炼时往往会生成__________。在机动车发动机中,燃料燃烧产生的高温条件会使空气中的氮气与氧气反应,生成__________。(2)酸雨形成:___________、___________以及它们在大气中发生反应后的生成物溶于雨水会形成酸雨。正常雨水由于溶解了___________,其 pH 约为 5.6,而酸雨的 pH______5.6。
(3)危害:酸雨有很大的危害,能直接损伤________,破坏森林和草原,使土壤、湖泊酸化,还会加速建筑物、桥梁、工业设备、运输工具和电缆的________。(4)防治:工业废气排放到大气中之前,必须进行适当处理,防止有害物污染大气,并充分利用原料。
【练1】(2021 年渭南尚德中学月考)在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情
况,下列反应中属于这种情况的是(
少量的氮气在催化剂存在条件下充分反应;③过量的水与一定量氯气;④过量的铜与浓硫酸;⑤过量的铜与稀硝酸; ⑥过量的稀硫酸与块状石灰石;⑦常温下过量浓硫酸与铝
①过量的Zn与18 ml·L-1硫酸溶液反应;②过量的氢气与
解析:①锌不论与浓硫酸还是稀硫酸都能反应,一种物质过量时,另一种能完全反应,错误;②合成氨是一个可逆反应,无论如何充分反应,都不能完全反应而达到百分之百,正确;③氯气与水的反应是可逆反应,无论如何充分反应,都不能完全反应而达到百分之百,正确;④铜无法与稀硫酸反应,无论铜怎么过量,都不能完全消耗完硫酸,正确;⑤铜与稀硝酸能反应,物质Cu 过量时,另一种物质硝酸能完全反应,错误;⑥稀硫酸与块状石灰石反应生成微溶物硫酸钙,附着在碳酸钙表面阻止反应的进一步发生,正确;⑦常温下,金属铝遇到浓硫酸会钝化,无论浓硫酸怎么过量,都不能消耗完金属铝,正确。
【练2】为证明稀硝酸与铜反应产物中气体为 NO,设计如
A.关闭活塞 1,加入稀硝酸至液面 a 处B.在装置左侧稍加热可以加快稀硝酸与铜的反应速率C.通过关闭或开启活塞 1 可以控制反应的进行D.反应开始后,胶塞下方有无色气体生成,但不能证明该气体为 NO
解析:关闭活塞 1,将无法加液体到液面 a,A 错误;加热可以加快稀硝酸与铜的反应速率,B 正确;关闭活塞 1,生成的 NO 把稀硝酸压向右边,使铜丝与稀硝酸分离,C 正确;想证明该气体为 NO,必须使 NO 与O2 接触,生成红棕色的 NO2,D 正确。答案:A
(3)向 Ba(NO3)2 溶液中通入还原性气体SO2 可得到BaSO4
(4)向 Fe(NO3)2 溶液中加入非氧化性酸,如盐酸,Fe2+能被
(5)向过量铜与一定量硝酸反应后的混合物中加入非氧化
(6)向含还原性离子的酸性溶液中加入硝酸盐,还原性离子
硝酸浓度对氧化性的影响
【练3】(2021年福州模拟)某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将 NO 氧化成 NO2,而稀硝酸不能氧化 NO,由此得出的结论是浓硝酸的氧化性强于稀硝酸。可选药品:浓硝酸、3 ml·L-1 稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。已知:氢氧化钠溶液不与 NO 反应,能与 NO2 反应:2NO2+2NaOH===NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是____________________________________;(2)滴加浓硝酸之前的操作是:检验装置的气密性,加入药品,打开弹簧夹后,继续进行的操作是______________________________________________________________________;
(3)装置①中发生反应的离子方程式是______________________________________________________________________;(4)装置②的作用是________________________________,发生反应的化学方程式是___________________________________________________________________________________;(5)该小组得出结论依据的实验现象是______________________________________________________________________;(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。
同学们分别设计了以下 4 个实验来判断两种看法是否正
确。这些方案中可行的是________(填字母)。
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,
Cu 与浓 HNO3 反应的离子方程式为 Cu+4H++2NO3 ===Cu2+
解析:(1)根据装置的特点和实验目的,NO 不溶于水,装置⑤是收集 NO,所以装置③中应该盛放 3 ml·L-1 稀硝酸,达到验证稀 HNO3 不能氧化 NO 的目的,装置⑥中盛放 NaOH 溶液吸收 NO2,防止污染空气,装置④中应该盛放浓硝酸,达到验证浓 HNO3 能氧化 NO 的目的。(2)由于装置中残存的空气能氧化 NO,对实验产生干扰,所以滴加浓 HNO3 之前需要通入一段时间 CO2 赶走装置中的空气,同时也需将装置⑤中导管末端伸入倒置的烧瓶内防止反应产生的 NO 气体逸出。(3)装置①中
+2NO2↑+2H2O。(4)装置②中盛放 H2O,使 NO2 与 H2O 反应生成 NO,3NO2+H2O===2HNO3+NO。(5)NO 通过稀 HNO3 溶液后,若无红棕色 NO2 产生,说明稀 HNO3 不能氧化 NO,所以盛放稀 HNO3 装置的液面上方没有颜色变化即可说明;装置④中盛放的是浓 HNO3,若浓 HNO3 能氧化 NO,则装置④液面的上方会产生红棕色气体。(6)要证明是 Cu(NO3)2 浓度过高或是溶解了 NO2 导致装置①中溶液呈绿色,一是可设计将溶解的NO2 赶走(a、c 方案)再观察颜色变化,二是增大溶液中 NO2 浓度(d 方案),通过观察颜色变化可以判断。
(2)通入CO2 一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内
(4)将 NO2 转化为 NO
(5)装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色(6)acd
答案:(1)3 ml·L-1稀硝酸、浓硝酸、氢氧化钠溶液
则下列说法不正确的是(
【练4】(2020 年潍坊二中模拟) 如图表示铁与不同浓度硝酸反应时,各种还原产物的相对含量与硝酸溶液浓度的关系,
A.一般来说,硝酸与铁反应的还原产物不是单一的
B.用一定量的铁粉与大量的 9.75 ml·L-1 HNO3 溶液反应得到标准状况下气体 2.24 L,则参加反应的硝酸的物质的量为
C.硝酸的浓度越大,其还原产物中价态越高的成分越多D.当硝酸浓度为9.75 ml·L-1 时还原产物是 NO、NO2、N2O,
且其物质的量之比为 5∶3∶1
像可知当硝酸浓度为9.75ml·L-1时还原产物是NO、NO2、N2O,
解析:根据图像可知硝酸的还原产物有多种,因此一般来说,硝酸与铁反应的还原产物不是单一的,A 正确;参加反应的硝酸包括被还原的,以及没有被还原的(转化为硝酸铁),因此参加反应的硝酸的物质的量大于 0.1 ml,B 错误;根据图像可知随着硝酸浓度的升高,NO2 的含量增大,这说明硝酸的浓度越大,其还原产物中价态越高的成分越多,C 正确;根据图
且其物质的量之比为 10∶6∶2=5∶3∶1,D 正确。
[归纳提升] 硝酸浓度大小与氮元素的还原产物的关系
【练5】(2021 年常德模拟)将 Mg 和 Cu 的合金 1.52 g 投入稀 HNO3 中反应,固体全部溶解时,收集的还原产物为 NO,体积为 0.448 L(标准状况下),向反应后的溶液中加入适量 NaOH
溶液,使金属离子恰好完全沉淀,则形成沉淀的质量为(
解析:硝酸被还原为 NO 气体且标准状况下体积为 0.448 L,即物质的量为 0.448 L÷22.4 L·ml-1=0.02 ml,所以转移电子的 物 质 的 量 为 0.02 ml×(5 - 2) = 0.06 ml , 最 后 沉 淀 为Cu(OH)2、Mg(OH)2,金属提供的电子的物质的量等于氢氧根离子 的 物 质 的 量 , 故最后沉淀质量等于1.52 g + 0.06 ml×17 g·ml-1=2.54 g。
【练6】(2021年邯郸模拟)向 50 mL 稀硫酸与稀硝酸的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一阶段只对应一个反
应。下列说法正确的是(
A.开始时产生的气体为 H2B.AB 段发生的反应为置换反应D.参加反应的铁粉的总质量 m2=5.6 g
C.所用混合溶液中c(HNO3)=0.5 ml·L-1
=1.0 ml·L-1,C 错误;生成
稀硝酸的物质的量浓度是
0.05 ml0.05 L
氢气的体积是 0.56 L,物质的量为 0.025 ml,所以反应中共转移电子 0.05 ml×3+0.025 ml×2=0.2 ml,参加反应的铁最终在溶液中以 Fe2+的形式存在,因此根据得失电子守恒可知,消耗铁的物质的量是 0.1 ml,质量是 5.6 g,D 正确。答案:D
1.(2021年河北卷)关于非金属含氧酸及其盐的性质,下列
A.浓 H2SO4 具有强吸水性,能吸收糖类化合物中的水分并使其炭化B.NaClO、KClO3 等氯的含氧酸盐的氧化性会随溶液的 pH减小而增强C. 加热 NaI 与浓H3PO4 混合物可制备 HI,说明 H3PO4 比HI 酸性强D.浓 HNO3 和稀 HNO3 与 Cu 反应的还原产物分别为 NO2和 NO,故稀 HNO3 氧化性更强
为 ClO +H2O
HClO+OH ,pH 减小,则酸性增强,会促
解析:浓硫酸能使蔗糖炭化,体现的是其脱水性,而不是吸水性,A 错误;NaClO 在水溶液中会发生水解,离子方程式
酸性条件下可生成具有强氧化性的氯气、二氧化氯等气体,增强氧化能力,B 正确;HI 的沸点低,易挥发,加热 NaI 与浓H3PO4 混合物发生反应生成 HI 利用的是高沸点酸制备低沸点酸的原理,C 错误;相同条件下根据铜与浓硝酸、稀硝酸反应的剧烈程度可知,浓硝酸的氧化性大于稀硝酸的氧化性,D 错误。答案:B
使平衡向正反应方向移动,生成氧化性更强的HClO,ClO3 在
2.(2021 年河北卷)硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境问题也日益受
到关注,下列说法正确的是(
A.NO2 和 SO2 均为红棕色且有刺激性气味的气体,是酸雨的主要成因B.汽车尾气中的主要大气污染物为 NO、SO2 和 PM2.5C.植物直接吸收利用空气中的 NO 和 NO2 作为肥料,实现氮的固定D.工业废气中的 SO2 可采用石灰法进行脱除
解析:NO2 是红棕色且有刺激性气味的气体,而 SO2 是无色有刺激性气味的气体,A 错误;汽车尾气的主要大气污染物为 C 与 N 的氧化物,如 NOx 和 CO 等,B 错误;氮的固定是指将游离态的氮元素转化为化合态,且植物可吸收土壤中的铵根离子或硝酸根离子作为肥料,不能直接吸收空气中的氮氧化物,C 错误;工业废气中的 SO2 可采用石灰法进行脱除,如加入石灰石或石灰乳均可进行脱硫处理,D 正确。
3.(2020 年北京卷)某同学进行如下实验:
A.根据Ⅰ中试纸变蓝,说明 NH4Cl 发生了分解反应B.根据Ⅰ中试纸颜色变化,说明氨气比氯化氢气体扩散速率快C.Ⅰ中试纸变成红色,是由于 NH4Cl 水解造成的D.根据试管中部有白色固体附着,说明不宜用加热 NH4Cl的方法制备 NH3
相关课件
这是一份人教版高考化学一轮总复习课时质量评价17氮及其化合物课件,共41页。
这是一份高中化学人教版 (2019)必修 第二册第二节 氮及其化合物集体备课课件ppt,共18页。PPT课件主要包含了答案D,汽油的不完全燃烧,NaNO2,氨和铵盐,刺激性,产生白烟,3实验室制法,碱石灰,稀硫酸等内容,欢迎下载使用。
这是一份人教版高考化学总复习氮及其重要化合物完美课件PPT,共60页。PPT课件主要包含了红棕色,HNO3+NO,碱石灰,湿润的红色石蕊,易挥发,与水以任意比互溶,质量分数在,%以上的硝酸,本部分内容讲解结束等内容,欢迎下载使用。









